Innovations & Thérapeutiques en Oncologie
MENUProTcell: A platform for cellular therapy to rearm the immune system against cancer and infections based on the power of the thymus Volume 8, issue 6, November-December 2022
Smart Immune est une entreprise de biotechnologie de stade clinique qui développe une plate-forme de thérapies cellulaires capables de réarmer le système immunitaire en moins de 100 jours pour permettre au patient de lutter contre les cancers et infections. Basée sur une technologie particulièrement innovante qui utilise la fonction physiologique du thymus pour sélectionner les lymphocytes T armés, afin de reconnaître notamment les cellules cancéreuses ou infectées, et tolérants vis-à-vis des cellules normales du « soi » qu’il faut préserver, cette plate-forme a été conçue pour réarmer rapidement le système immunitaire de patients ayant des hémopathies malignes à risques ou des maladies héréditaires du système immunitaire, en leur redonnant les moyens de lutter efficacement contre cancers et infections.
Créée en 2017 à Paris par trois co-fondatrices, Isabelle André, PhD, Marina Cavazzana, MD, PhD, et Karine Rossignol, PharmD-HEC, Smart Immune a l’ambition de mettre à disposition des patients des produits de thérapie cellulaire utilisant le pouvoir anticancéreux et anti-infectieux des lymphocytes T allogéniques sans risque de réaction du greffon contre l’hôte, risque qui caractérise les médecines cellulaires allogéniques. Cette prouesse pourrait se concrétiser grâce au pouvoir éducatif du thymus.
Il existe de nombreux contextes physiologiques et pathologiques pouvant entraîner un déficit en lymphocytes T : certains cancers hématologiques, des maladies génétiques ou infectieuses, ainsi que des troubles auto-immuns. La greffe de cellules souches hématopoïétiques allogéniques (allo-HSCT) représente parfois la seule solution thérapeutique curative. Bien que permettant de reconstituer un système immunitaire à long terme chez ces patients, ce traitement est associé à une période de déficience immunitaire T prolongée, rendant les patients vulnérables aux infections et aux rechutes dans le cas de cancers. La toxicité et les limites de cette pratique sont encore importantes puisque le taux de mortalité/morbidité de l’allo-HSCT en Europe et aux États-Unis est encore de 50 % à trois ans.
Grâce à la plate-forme ProTcell, Smart Immune s’est donné l’objectif d’améliorer le pronostic de ces patients et de lever les principaux obstacles rencontrés aujourd’hui par les approches thérapeutiques basées sur l’utilisation de lymphocytes T allogéniques.
Un besoin médical important : accélérer la reconstitution de l’immunité T après une greffe de cellules souches hématopoïétiques
Tout patient recevant une HSCT présente une immunodéficience sévère causée par plusieurs facteurs qui agissent en synergie : la nature de la maladie à traiter, l’utilisation d’un conditionnement avant la greffe ainsi que celle d’immunosuppresseurs, le développement de la maladie du greffon contre l’hôte (GvHD). La reconstitution d’un compartiment T complet (répertoire polyclonal) et fonctionnel après la greffe peut prendre plus d’un an chez un adulte.
Dans le cas d’une greffe allogénique, l’utilisation de cellules souches provenant d’un donneur compatible apparenté est la meilleure approche en termes de bénéfices pour le patient. Cependant, l’accès à ce type de greffe reste limité par des contraintes de compatibilité HLA (Human Leukocyte Antigen) conduisant à utiliser dans la majorité des cas un donneur non apparenté compatible (MUD, Matched Unrelated Donor) ou apparenté mais moins compatible (haplo identique). Dans ces conditions, la reconstitution immunitaire est particulièrement lente, ce qui contribue de manière substantielle à la mortalité et à la morbidité liées aux infections et aux rechutes durant la première année post-greffe. L’utilisation de progéniteurs lymphoïdes ProTcell au moment de la greffe pourrait accélérer la reconstitution immunitaire post-greffe et donc améliorer ces types de greffes, permettant à plus de patients de bénéficier de ces traitements.
Parmi les différents produits développés pour améliorer les résultats de la greffe, certains visent à diminuer le risque de GvHD ou à accélérer la reconstitution du compartiment myéloïde après la greffe. Même si plusieurs approches semblent prometteuses, aucune ne permet une reconstitution rapide de l’immunité T, indispensable à une réponse anti-tumorale et anti-virale efficace.
ProTcell : une plate-forme de thérapies cellulaires pour réarmer le système immunitaire en moins de 100 jours
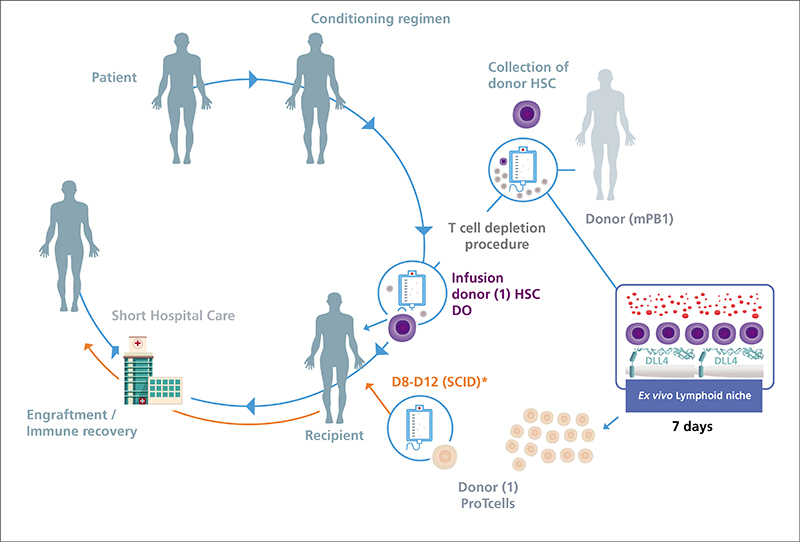
Grâce à sa technologie brevetée de différenciation lymphoïde ex vivo, Smart Immune est capable de produire un grand nombre de progéniteurs lymphoïdes de grade clinique à partir de cellules CD34+ allogéniques en seulement sept jours au lieu des 12 à 18 mois nécessaires physiologiquement. Ce processus de production labellisé GMP (Good Manufacturing Practice) ne nécessite pas de cellules de support mais utilise une protéine de fusion recombinante capable d’activer la voie Notch, simplifiant de façon importante leur utilisation en clinique.
Au bout de sept jours de culture, les progéniteurs lymphoïdes n’expriment encore aucun récepteur de lymphocytes T (TCR). Une fois injectés, ils migrent en grande quantité vers le thymus pour y être rapidement sélectionnés et éduqués, notamment à reconnaître le soi. Ainsi, ils génèrent un pool de cellules T naïves, tolérantes, en environ 100 jours. On y retrouve la polyclonalité nécessaire (estimée à 108 récepteurs de cellules T différents) pour garantir une protection contre les infections virales, fongiques et certaines infections bactériennes, et reconnaître les néo-antigènes de cellules tumorales.
Ces progéniteurs lymphoïdes ProTcell permettraient donc une reconstitution rapide, polyclonale et sûre du compartiment T. C’est ce qui a été observé en préclinique, en partenariat avec l’Institut Imagine, et chez les premiers patients traités dans le cadre d’essais cliniques réalisés en partenariat avec l’Assistance publique-Hôpitaux de Paris (AP-HP) (figure 1).
Le mode d’action de ces cellules ProTcell et de leurs thérapies dérivées repose toutefois sur un prérequis : le bon fonctionnement du thymus du patient receveur. Un thymus âgé, atrophié, fragilisé par plusieurs lignes de chimiothérapie peut-il jouer son rôle, essentiel au succès de cette approche thérapeutique ?
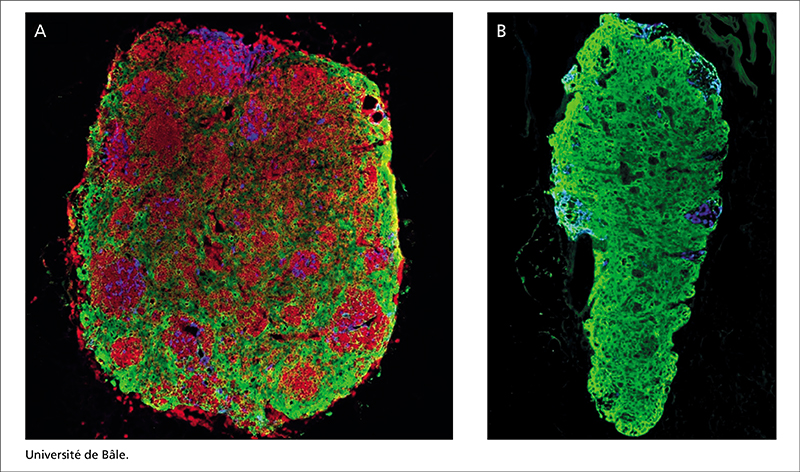
Les premières données obtenues chez la souris par Smart Immune, en collaboration avec l’université de Bâle et l’Institut Imagine, sont encourageantes et devraient être présentées d’ici la fin de 2022 (figure 2).
Après l’injection cellules de ProTcell, on observe une réorganisation et une repopulation plus rapide du thymus qu’avec les cellules CD34+. Cette observation suggère que l’injection des progéniteurs lymphoïdes pourrait permettre la régénération du thymus.
La plate-forme ProTcell est aussi prometteuse pour de multiples applications en immuno-oncologie cellulaire : CAR (Chimeric Antigen Receptor) ProTcell, récepteur des lymphocytes T (TCR-T), CAR-Treg), natural killer (NK).
Dans ce cadre, Smart Immune a initié en 2021 une collaboration de recherche avec le Memorial Sloan Kettering Cancer Center (MSK) pour accélérer le développement d’une nouvelle génération de progéniteurs lymphoïdes armés d’un récepteur chimérique permettant de reconnaître spécifiquement un antigène. Les CAR ProTcell sont actuellement testés en étude préclinique dans des modèles murins.
Le potentiel d’applications thérapeutiques de la plate-forme est encore enrichi par la possibilité de différencier, à partir des mêmes progéniteurs lymphoïdes, un grand nombre de cellules NK et de CAR-NK à forte cytotoxicité.
En quoi la première génération de cellules CAR-T, éduquées et sélectionnées par le thymus du patient, représenterait-elle une innovation en immuno-oncologie ?
L’essor d’immunothérapies ciblées, CAR-T contre le cancer
Six préparations à base de cellules CAR-T ont déjà été mises sur le marché. Elles représentent une innovation radicale dans le traitement des lymphomes non-hodgkiniens, des leucémies aiguës lymphoblastiques et des myélomes multiples. Elles sont pour l’instant réservées aux patients atteints de cancers réfractaires. Bien que le taux de rémission complète (RC) juste après le traitement avec les CAR-T atteigne 57 %, voire 93 %, de nombreux patients rechutent quelques mois plus tard, avec un taux de rechute pouvant atteindre 66 % [1, 2]. Cela représente une forte limitation pour l’utilisation de ces cellules. Un des facteurs importants est lié à la source des cellules utilisées pour produire les CAR-T. En effet, celles-ci sont généralement préparées à partir de lymphocytes T matures dont la persistance est souvent brève. Il a été montré que des cellules CAR-T produites à partir de cellules moins différenciées et moins épuisées produisent de meilleurs résultats [3].
Les préparations thérapeutiques de CAR-T commercialisées sont dites autologues, c’est-à-dire fabriquées à partir de lymphocytes T du patient lui-même. Bien qu’elles ne nécessitent pas la recherche d’un donneur compatible, la production de ces thérapies cellulaires présente d’autres difficultés. Tout d’abord, la logistique associée à la fabrication de ces produits est complexe car elle nécessite de collecter les cellules T de chaque patient, de les envoyer dans un centre de thérapie cellulaire pour introduire la séquence du récepteur chimérique, et de contrôler la qualité du produit obtenu avant d’acheminer ce produit de thérapie cellulaire vers le site clinique qui l’administrera au patient. La qualité des lymphocytes utilisés pour réaliser cette production peut être altérée si le patient a reçu une chimiothérapie ou est âgé. Comme évoqué précédemment, les lymphocytes utilisés pour produire les cellules CAR-T sont généralement des cellules effectrices matures qui vont avoir tendance à s’épuiser lors de leur amplification en culture. Ces cellules CAR-T autologues, bien qu’ayant permis une avancée remarquable dans le traitement des cancers, présentent certaines limites à leur utilisation : une faible persistance, une fabrication onéreuse, une logistique complexe et une altération de la qualité des cellules lorsqu’elles sont prélevées sur des patients ayant reçu plusieurs lignes de chimiothérapie.
La production de CAR-T à partir de cellules allogéniques prêtes à l’emploi permettrait d’utiliser les cellules d’un donneur sain qui n’ont pas été exposées à une chimiothérapie, ainsi que de simplifier la logistique, de réduire le coût de production par traitement. Cette approche permettrait aussi la préparation de plusieurs doses prêtes à l’emploi à partir d’un seul lot et donc de traiter plusieurs patients à partir d’une unique production de cellules. Étant immédiatement disponibles pour être administrées aux patients, le délai entre la décision thérapeutique et le traitement serait ainsi raccourci : un gain de temps précieux, notamment dans le traitement d’hémopathies malignes à haut risque. Enfin, une meilleure persistance, en améliorant l’efficacité à long terme des thérapies CAR-T, pourrait aussi se traduire par une diminution de la durée d’hospitalisation des patients et du coût de la prise en charge (nouvelles thérapies antitumorales, de soins de support ou palliatifs).
L’une des solutions pour éviter les difficultés liées à l’utilisation des cellules du patient comme source pourrait être d’utiliser des cellules iPSCs (Induced Pluripotent Stem Cells). Celles-ci offrent une source illimitée de matériel de départ pour générer des cellules T allogéniques. Cependant, le processus de différenciation est complexe. La qualité de la différenciation, la stabilité du génome et la capacité des cellules T dérivées des iPSCs à être fonctionnelles et à durer in vivo après perfusion doivent encore être évaluées par des études précliniques et des essais cliniques. Les cellules CAR-T allogéniques générées à partir d’iPSCs relèvent donc d’un concept prometteur mais encore loin de la commercialisation.
Pour le moment, les thérapies allogéniques ont une persistance réduite par rapport aux thérapies autologues. Les principales limites de l’immunothérapie cellulaire allogénique sont liées au rejet des cellules ou au risque d’induire une GvHD déclenchée par les incompatibilités HLA. Ces risques nécessitent l’introduction de modifications génétiques complexes au niveau des gènes codant le TCR ou les protéines HLA, qui pourraient altérer le fonctionnement des cellules.
Dans ce contexte, Smart Immune propose une approche originale basée sur la physiologie du thymus, potentiellement capable de répondre à l’ensemble de ces défis : risque de GvHD, faible persistance in vivo, lente reconstitution d’un compartiment polyclonal de cellules T, temps de manipulation et de production, coût élevé.
Essais cliniques en cours
Le produit le plus avancé de Smart Immune, la préparation de ProTcell, progéniteurs T lymphoïdes, fait déjà l’objet d’études cliniques.
Un partenariat avec l’AP-HP a permis la mise en place de deux essais pour évaluer la sécurité et l’efficacité de ces préparations dans les déficits immunitaires héréditaires ou acquis (hémopathies malignes).
Un essai clinique de phase I/II pour les déficits immunitaires combinés sévères (SCID) a été initié en 2019 sous la direction de la Pr Marina Cavazzana afin d’évaluer le bénéfice de ProTcell (NCT03879876). Les premiers résultats cliniques sont très encourageants notamment en termes de reconstitution immunitaire après HSCT. Les données ont été présentées lors de la 63e réunion annuelle de l’American Society of Hematology (ASH1).
En oncologie, un essai clinique de phase I/II pour les hémopathies malignes réfractaires et à haut risque a été ouvert en janvier 2020 sous la direction du Pr Olivier Hermine (NCT04707300).
Smart Immune a déposé un dossier de demande d’essai clinique aux États-Unis (IND, Investigational New Drug) et a été autorisé par la Food and Drug Administration (FDA) à réaliser un essai évaluant la sécurité et l’efficacité de son produit chez des enfants et des adultes ayant une leucémie à haut risque et recevant une HSCT. Cet essai clinique est dirigé par Miguel Perales et Jaap Boelens au MSK (NCT04959903).
Deux autres essais cliniques sont en préparation.
Une innovation protégée et distinguée
ProTcell constitue donc une nouvelle plate-forme cellulaire pour l’immunothérapie, permettant de générer des progéniteurs lymphoïdes qui, une fois éduqués par le thymus du patient, génèrent les « Smart T cells ». Les préparations dérivées, telles que les CAR ProTcell ou CAR / NK ProTcell, devraient ainsi générer des « Smart CAR-T cells » et « Smart NK cells ».
Cette technologie, issue des travaux des équipes de Marina Cavazzana, MD, PhD, et Isabelle André, PhD, à l’Hôpital Necker-Enfants malades (AP-HP) et l’Institut Imagine, et de l’équipe de recherche et développement de Smart Immune, a été brevetée et distinguée à plusieurs reprises.
Nominée pour le Prix Galien US 2022 dans la catégorie Startup et pour le HealthTech For Care Innovation Award, l’entreprise a déjà reçu les prix des concours I-lab en 2018 et 2019 et I-nov « Concours innovation » en 2020, le prix de la meilleure innovation thérapeutique et le prix « Oncology Upward Investment » (OUI session) à Matwin, le prix du meilleur poster à Mabdesign en 2022.
Le soutien du programme sélectif Matwin, qui vise à accélérer le développement d’innovations thérapeutiques en oncologie en France, a été déterminant pour Smart Immune. L’accompagnement d’une grande valeur apporté par des experts du secteur a permis de mieux définir une stratégie de développement claire, convaincante et ambitieuse.
Demain, des banques de produits prêts à l’emploi
C’est par la création de banques de traitements cryopréservés que Smart Immune a l’ambition de rendre ses traitements accessibles à tout patient en ayant besoin. Pour ce faire, l’entreprise étudie la possibilité de réduire les contraintes de compatibilité HLA. Une première étape vers la création de banques de thérapies cellulaires prêtes à l’emploi et plus accessibles… grâce au thymus.
1 Moshous D, Magrin E, Winter S, et al. Rapid and Safe T Cell Immune Reconstitution by T Cell Progenitor Injection Following Haploidentical Transplantation for Severe Combined Immunodeficiency (SCID). Poster 1752 – Session 704. Cellular Immunotherapies. Clinical Poster I. Dec 11th, 2021.