Hépato-Gastro & Oncologie Digestive
MENUIron deficiency in digestive oncology Volume 26, supplement 1, Octobre 2019
Introduction
La carence martiale affecte 50 % à 70 % des patients avec un cancer digestif, mais elle est largement sous-diagnostiquée. La ferritinémie ne serait dosée que dans un cas sur deux, et à peine 15 % des patients auraient un dosage du coefficient de saturation de la transferrine [1]. Selon la même étude, une fois la carence martiale identifiée, elle ne serait traitée que dans un tiers des cas. Pourtant, les conséquences négatives de la carence martiale, qu’elle soit associée à une anémie ou isolée, sont nombreuses : fatigue, dyspnée, céphalées, atteinte des muqueuses et des phanères, dépression, voire majoration de la mortalité. Il en résulte une altération significative de la qualité de vie avec une baisse de productivité au travail. Chez les patients avec une tumeur digestive traités par chimiothérapie, la carence martiale conduira inexorablement à l’anémie, conduisant à la prescription d’agents stimulants l’érythropoïèse (ASE), voire de transfusions de culots globulaires. Or, ces thérapeutiques ne sont pas sans risques, avec des effets indésirables potentiels (accidents thrombotiques, réactions, transmissions d’agents infectieux…), et ont un impact médico-économique notable. Un diagnostic et un traitement précoce de la carence martiale pourraient alors probablement éviter le recours aux ASE et aux transfusions, tout en améliorant la qualité de vie des patients sous chimiothérapie. Dans cette revue seront abordés l’épidémiologie de la carence martiale en oncologie digestive, les moyens de la détecter, et surtout quels patients traiter et selon quelles modalités.
Épidémiologie
À l’échelle mondiale, la carence martiale représente le déficit nutritionnel le plus répandu, même si les études dédiées et robustes en population sont rares, compte tenu de l’intrication entre la carence martiale et l’anémie. En 2015, on estimait que l’anémie touchait un tiers de la population mondiale, soit 2,4 milliards de personnes, dont 63 % étaient carencées en fer [2]. L’anémie par carence martiale (ACM) affecterait donc environ 1,5 milliards d’individus, soit 20 % de la population mondiale, avec une globale stabilité entre 2005 et 2015 (+ 1,5 %). Il existe cependant de grandes disparités entre les régions du globe quant à la part de l’anémie expliquée par la carence martiale. En Europe de l’Ouest, la carence martiale est la quatrième cause d’anémie chez les hommes et la huitième chez les femmes [3].
La carence martiale a une forte prévalence chez les patients atteints d’un cancer digestif. Comme en population générale, il est difficile d’un point de vue épidémiologique de la différencier de l’anémie par carence martiale. Dans une étude européenne sur plus de 15 000 patients dont 17 % avec un cancer digestif (n = 2 566), la prévalence de l’anémie à l’inclusion était de 31 % parmi ces derniers. Durant les six mois qu’a duré l’étude, 61 % des patients ont présenté au moins une fois une anémie [4]. Dans une autre étude européenne, ayant inclus 1 528 patients avec une tumeur solide ou hématologique, dont 366 avec un cancer colorectal, 51 avec un cancer œsogastrique, 38 avec un cancer du pancréas, la prévalence de la carence martiale était respectivement de 52 %, 49 % et 63 % [5].
Dans une étude prospective multicentrique française portant sur 129 patients dont 110 avec une tumeur solide, la prévalence de la carence martiale variait de 50 % à 60 % pour la plupart des localisations, avec cependant un pic à 70 % pour les cancers colorectaux [6]. Dans une autre étude prospective britannique, 60 % des patients avec un cancer colorectal présentaient une carence martiale [7]. Concernant le cancer gastrique, une étude rétrospective canadienne évaluait à 56 % la proportion de patients avec une carence martiale au diagnostic [8]. On peut donc estimer qu’entre 50 % et 70 % de nos patients avec un cancer digestif ont une carence martiale (tableau 1). Cependant, selon une étude européenne menée chez 375 oncologues médicaux et hématologues exerçant dans neuf pays différents, seuls 48 % de leurs patients bénéficiaient d’un dosage de la ferritine et 14 % du coefficient de saturation de la transferrine (CST) [1]. En cas d’ACM, seulement un tiers des patients (31 %) recevait une supplémentation en fer, et par voie orale dans trois quarts des cas (74 %). D’où ce paradoxe : une majorité de nos patients atteints de tumeurs digestives sont carencés en fer mais seuls quelques-uns sont diagnostiqués et potentiellement traités. Entre 50 % et 70 % des patients avec un cancer digestif ont une carence martiale. Très peu ont un bilan du fer adapté et seulement un tiers des patients carencés avec anémie ont une supplémentation en fer
Métabolisme du fer
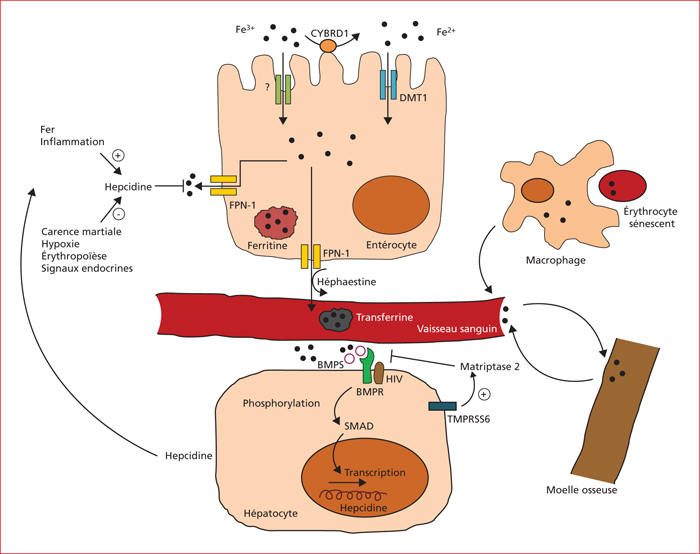
Le fer est un composant essentiel de l’hémoglobine des hématies et de la myoglobine des muscles, qui contiennent environ 60 % du fer de l’organisme. Le fer est également impliqué dans de nombreux mécanismes cellulaires, comme des réactions enzymatiques, la synthèse de l’ADN et la production énergétique mitochondriale. Un corps adulte contient 3 à 5 g de fer, en sachant de 20 à 25 mg par jour sont nécessaires pour l’érythropoïèse et le métabolisme cellulaire [9]. Les apports alimentaires en fer étant limités (1-2 mg/jour), d’autres sources sont requises pour maintenir l’homéostasie martiale (recyclage des hématies âgées par les macrophages, échange de fer entre les enzymes qui en contiennent, stocks martiaux…). Les pertes quotidiennes sont estimées entre 1 et 2 mg, du fait des menstruations, de la sudation, de la desquamation cutanée et de l’excrétion urinaire. Cette dernière n’étant pas finement régulée, l’équilibre entre les apports alimentaires, l’absorption intestinale et le recyclage du fer doit être optimal pour éviter les carences. Par voie alimentaire, le fer est disponible sous deux formes : le fer héminique et non héminique. Dans la forme héminique, le fer ferreux (Fe 2+) est contenu dans l’hémoglobine, et on le retrouve dans les aliments d’origine animale (viande rouge, volaille, produits de la mer). Le fer non héminique (Fe 3+ ou fer ferrique) est présent dans les céréales, les fruits secs, le cacao, le thé noir… Le fer héminique contribue pour 10 à 15 % des apports en fer, mais comme il est mieux absorbé que le fer non héminique (taux d’absoprtion de 15 à 35 %), il peut représenter jusqu’à 40 % du fer absorbé [10]. Dans l’homéostasie martiale, un petit peptide appelé l’hepcidine a un rôle crucial dans le contrôle de la disponibilité du fer pour les tissus (figure 1). Principalement sécrété par les hépatocytes, il a été décrit pour la première fois en 2001 chez des souris avec une surcharge en fer. L’hepcidine est aussi produite de manière marginale par les macrophages, les adipocytes, le cœur et les reins. Dans le plasma, l’hepcidine est fixée à l’α2-macroglobuline et l’albumine, avant d’être excrétée par les reins. Son rôle principal est de réguler l’expression de la ferroportine 1 (FPN1) en s’y fixant, entraînant son internalisation puis sa dégradation par les lysosomes [11]. FPN1 est à l’heure actuelle la seule protéine permettant d’exporter le fer, donc après sa dégradation, les entérocytes, les macrophages et les hépatocytes ne peuvent plus exporter le fer qui se retrouve séquestré au sein de ces cellules. Concrètement, une expression élevée de l’hepcidine diminue la concentration plasmatique du fer, et inversement, un faible niveau d’expression de l’hepcidine augmente la concentration en fer dans le sang. L’expression de l’hepcidine est stimulée par de fortes concentrations en fer dans le foie et le plasma, l’inflammation et l’activité physique [12], tandis qu’elle est diminuée par la carence martiale, l’érythropoïèse, l’hypoxie, et certains signaux endocrines (testostérone, œstrogènes, facteurs de croissance). Une nouvelle hormone, appelée érythroferrone, a été décrite pour la première fois en 2014. Elle est produite par les érythroblastes en réponse à l’érythropoïétine, et régule l’expression de l’hepcidine durant l’érythropoïèse [13].
En cas de cancer digestif, il existe une augmentation de la sécrétion de cytokines pro-inflammatoires comme l’IL-6, l’IL-1, le TNF-α, l’interféron-γ, mais aussi en réaction de cytokines anti-inflammatoires comme l’IL-10 [14]. L’ensemble de ces signaux aboutit à une hyperexpression de l’hepcidine et donc in fine à une diminution de la concentration plasmatique en fer. L’autre mécanisme prépondérant dans la carence martiale en cas de tumeur digestive est l’hémorragie occulte ou extériorisée. Les autres étiologies ont une participation plus modeste, comme les carences d’apport ou les défauts d’absorption intestinale. En cas de cancer digestif, il existe une augmentation de la sécrétion de cytokines pro-inflammatoires responsable d’une hyperexpression de l’hepcidine conduisant à une diminution de la concentration plasmatique en fer
Comment diagnostiquer une carence martiale ?
La carence martiale est définie par un manque de biodisponibilité du fer pour assurer les fonctions cellulaires, au premier rang desquelles la synthèse de l’hème pour l’érythropoïèse. On définit deux types de carence martiale : absolue et fonctionnelle. Dans la première, il existe une déplétion des stocks martiaux. Dans la seconde, la disponibilité du fer est insuffisante malgré des stocks normaux, potentiellement en rapport avec une séquestration du fer dans les zones de stockage ou une augmentation des besoins en fer en cas de traitement par des ASE.
Le diagnostic de la carence martiale est parfois complexe, mais l’utilisation combinée de plusieurs indicateurs du statut martial semble être la méthode la plus performante. En l’absence d’inflammation, la ferritine sérique est le biomarqueur le plus spécifiquement corrélé avec le stock martial global de l’organisme. Une ferritinémie < 30 ng/mL définit ainsi la carence martiale absolue [15], avec une sensibilité de 92 % et une spécificité de 98 % [16]. Cependant, la ferritinémie est augmentée indépendamment du statut martial en cas de maladie inflammatoire aiguë ou chronique, de cancer ou d’hépatopathie chronique, ce qui limite considérablement sa rentabilité diagnostique, surtout si elle est utilisée de manière isolée. Dans ces situations, le seuil recommandé est de 100 ng/mL [15]. En cas de carence martiale, le fer sérique est diminué et la capacité totale de fixation du fer est augmentée, ce qui diminue la saturation de la transferrine (ratio entre le fer sérique et la capacité totale de fixation du fer). En cas d’inflammation, un CST < 20 % définit la carence martiale. Si, en plus, la ferritinémie est inférieure à 30 ng/mL ou à 100 ng/mL en situation inflammatoire, on parle de carence martiale absolue. Si la ferritine est normale ou augmentée, il s’agit d’une carence martiale fonctionnelle. Le couple ferritine + CST semble donc le plus approprié en pratique courante pour diagnostiquer la carence martiale en cas de cancer digestif.
Cependant, il existe d’autres biomarqueurs, parfois plus performants, mais moins accessibles en routine et plus onéreux (tableau 2). Les récepteurs solubles de la transferrine (RST) dérivent de la protéolyse des récepteurs membranaires à la transferrine. Ce phénomène est donc corrélé à la carence en fer et inversement à la quantité de fer disponible pour l’érythropoïèse. Ainsi, en cas de carence martiale, la synthèse des récepteurs à la transferrine est augmentée, conduisant à une augmentation des RST. Une des forces de ce biomarqueur est que sa concentration n’est pas affectée par l’inflammation. Les RST sont augmentés en cas de stimulation de l’érythropoïèse, comme lors d’une anémie hémolytique ou chez les patients recevant des ASE. Une autre limite est l’absence de seuil universellement admis pour définir une carence martiale. Une méta-analyse sur dix études publiée en 2012 concluait à une sensibilité de 86 % et une spécificité de 75 % [17]. Les RST ne sont pas nécessaires en routine pour diagnostiquer une carence en fer, mais peuvent permettre de lever un doute, notamment en cas de situation inflammatoire marquée gênant l’interprétation du couple ferritine + CST. Le ratio entre les RST et le logarithme de la ferritine sérique (l’index RST-F) semble intéressant pour différencier l’origine d’une anémie, notamment en cas de maladie chronique [17]. Ce rapport est directement proportionnel au déficit tissulaire en fer chez les patients carencés. En cas d’index RST-F bas, l’anémie est probablement due à la maladie chronique sous-jacente, alors que l’ACM est à évoquer prioritairement si l’index RST-F est élevé. Il n’y a pas de seuil clairement établi, mais un ratio supérieur à 2-3 peut être utilisé en pratique pour diagnostiquer une ACM [18]. Les limites de cet index sont les mêmes que celles des RST.
Même si le myélogramme est toujours considéré comme le « gold standard » pour le diagnostic de la carence martiale, il n’est pas envisageable en pratique courante car invasif, gênant pour le patient, onéreux et faussé en cas de traitement concomitant par ASE. Cependant, le prélèvement de moelle n’est pas affecté par l’inflammation et s’avère être hautement spécifique.
Trois autres marqueurs sériques présentent des performances diagnostiques intéressantes : la protoporphyrine zinc (PPZ), le pourcentage de globules rouges circulants hypochromes, et le contenu en hémoglobine des réticulocytes. En cas de carence martiale, le transport du zinc au travers de la muqueuse intestinale augmente. Ainsi, une augmentation de la PPZ dans les globules rouges (> 80 μg/dL) est associée à une ACM. Par rapport au myélogramme, la PPZ a une sensibilité de 78 % et une spécificité de 70 % [19]. Les autres causes d’augmentation de la PPZ sont le sepsis, l’inflammation, le saturnisme, l’anémie hémolytique, l’hyperbilirubinémie et l’hémodialyse. De plus, l’automatisation de la mesure de ce biomarqueur est difficile, rendant son accessibilité modérée. Chez les patients insuffisants rénaux chroniques, le pourcentage de globules rouges circulants hypochromes (par rapport aux globules rouges totaux) est le marqueur le plus sensible pour mettre en évidence une carence martiale, avec un seuil de 6 % [20]. Cependant, un échantillon de sang frais est nécessaire et les automates de mesure sont très peu répandus. Le contenu en hémoglobine des réticulocytes est un indicateur très précoce du statut martial. Il indique le fer disponible pour l’érythropoïèse durant les trois à quatre jours qui précèdent le prélèvement [21]. En cas de valeur inférieure à 27,2 pg, le diagnostic de carence martiale est posé. Une fois encore, l’accès à ce marqueur est très limité, et l’on assiste à des valeurs faussement normales en cas de volume globulaire moyen augmenté ou de thalassémie.
En conclusion, chez les patients atteints d’un cancer digestif, le meilleur compromis en termes de performance et d’accessibilité pour le diagnostic de la carence martiale semble être le couple ferritine + CST, avec les RST en complément en cas de doute. Le couple ferritine + coefficient de saturation de la transferrine semble donc le plus approprié en pratique courante pour diagnostiquer la carence martiale en cas de cancer digestif
Pourquoi traiter une carence martiale ?
L’ACM est responsable de nombreux symptômes comme la fatigue, la dyspnée, les céphalées, la pâleur, le syndrome des jambes sans repos ou encore l’atteinte des muqueuses et des phanères (glossite atrophique, alopécie, xérose…). L’anémie serait également associée à une surmortalité dans de nombreux cancers [22]. Mais la carence martiale isolée, même sans anémie associée, est aussi à l’origine d’une altération de la qualité de vie, d’une baisse de productivité au travail, de fatigue, de dépression voire de troubles cognitifs. La carence martiale isolée, même sans anémie associée, est à l’origine d’une altération de la qualité de vie, d’une baisse de productivité au travail, de fatigue, de dépression voire de troubles cognitifs
Dans la majorité des essais randomisés contrôlés disponibles en oncologie, la supplémentation martiale intraveineuse (IV) associée aux ASE a montré des bénéfices en termes d’augmentation du taux d’hémoglobine [23], d’amélioration de la qualité de vie [24], de réduction du recours à la transfusion [25] et de diminution des doses d’ASE [26], en comparaison avec les ASE prescrits seuls. Dans une méta-analyse de 11 études ayant inclus 1 681 patients atteints de tumeurs solides et d’hémopathies malignes, le fer IV était associé à une augmentation significative du taux d’hémoglobine (risque relatif (RR) 1,28 intervalle de confiance à 95 % (IC 95 %) 1,13-1,45) et à une diminution du recours aux transfusions, même en l’absence de prescription simultanée d’ASE (RR 0,52 IC 95 % 0,34-0,80) [27]. Il n’y avait pas de différence entre les groupes quant aux effets indésirables ou à la mortalité. Une autre méta-analyse retrouvait des résultats similaires avec la supplémentation martiale injectable, contrairement au fer oral qui n’augmentait pas la réponse hématologique (p = 0,59) et ne réduisait pas le recours aux transfusions (p = 0,08) [28]. Le bénéfice de la supplémentation martiale sans prescription concomitante d’ASE chez des patients non anémiques n’est pas clairement établi en cancérologie. Dans une étude sur 75 patientes avec un cancer du col utérin traité par chimiothérapie, 40 % de celles qui étaient supplémentées en fer IV ont eu besoin d’une transfusion contre 64 % dans le groupe contrôle [29]. Dans une étude prospective observationnelle française, 367 patients avec une tumeur solide ou une hémopathie maligne, traités par carboxymaltose ferrique IV ± ASE étaient suivis pendant trois mois [30]. L’augmentation médiane du taux d’hémoglobine était similaire avec ou sans ASE (1,4 et 1,3 g/dL, respectivement). La supplémentation martiale intraveineuse associée aux agents stimulant l’érythropoïèse est bénéfique sur le taux d’hémoglobine, la qualité de vie, le recours à la transfusion et les doses requises d’agents stimulant l’érythropoïèse
La littérature est plus probante dans l’insuffisance cardiaque chronique, où le bénéfice de la supplémentation martiale IV en l’absence d’anémie est clairement démontré. Dans l’étude FAIR-HF, 50 % des patients traités par carboxymaltose ferrique se disaient modérément voire très améliorés sur l’échelle PGA (Patient Global Assessment), contre 28 % des patients sous placebo [31]. Les résultats étaient similaires en cas d’ACM ou de carence martiale isolée. Dans une analyse post-hoc de FAIR-HF, la qualité de vie était elle aussi significativement augmentée en cas d’administration de fer IV, indépendamment de la présence d’une anémie [32]. L’étude CONFIRM-HF était un essai multicentrique contrôlé contre placebo, portant sur 304 patients ambulatoires avec une insuffisance cardiaque chronique symptomatique et carencés en fer [33]. L’étude était positive sur son critère de jugement principal, représenté par une amélioration de la distance au test de marche des six minutes entre l’inclusion et la semaine 24. La supplémentation IV d’une carence martiale, même sans anémie, apparaît donc comme une stratégie validée chez les patients insuffisants cardiaques, et fait même partie des recommandations de la Société européenne de cardiologie. En oncologie, les données robustes manquent pour adopter une telle attitude, et cette approche ne peut être recommandée d’après la littérature disponible (recommandations ESMO 2018). En l’absence de données robustes, la supplémentation martiale en cas de carence isolée sans anémie n’est pas recommandée mais à discuter au cas par cas
Qui traiter ?
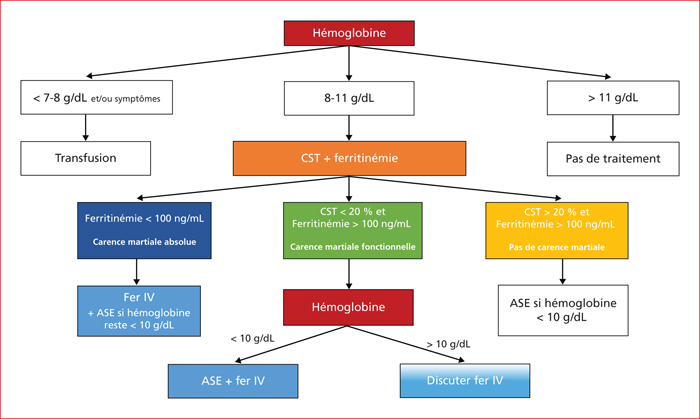
Selon les recommandations 2018 de l’ESMO [15], une supplémentation martiale IV doit être envisagée chez les patients atteints d’un cancer traités par chimiothérapie et présentant une anémie (Hb ≤ 11 g/dL ou une diminution ≥ 2 g/dL) avec une carence martiale absolue (ferritinémie < 100 ng/mL) ou fonctionnelle (ferritinémie > 100 ng/mL avec un CST < 20 %). En cas d’hémoglobine entre 8 et 10 g/dL, un traitement concomitant pas ASE doit être prescrit. En dessous de 7-8 g/dL d’hémoglobine, une transfusion doit être discutée (figure 2). Cependant, la limite supérieure de ferritinémie définissant la carence martiale fonctionnelle n’est pas clairement établie. Certains auteurs estiment qu’en cas de CST < 20 % mais avec une ferritinémie > 500 ng/mL, la décision d’une supplémentation martiale doit être basée sur le rapport bénéfices/risques individuel de chaque patient, avec un arrêt de la supplémentation en cas de ferritinémie > 800 ng/mL [34]. L’ESMO précise aussi que l’administration de fer injectable ne doit pas être simultanée d’une chimiothérapie cardiotoxique du fait de l’absence de données de pharmacovigilance à long terme dans cette situation. Une supplémentation martiale IV doit être envisagée chez les patients atteints d’un cancer traités par chimiothérapie et présentant une anémie (Hb ≤ 11 g/dL ou une diminution ≥ 2 g/dL) avec une carence martiale absolue (ferritinémie < 100 ng/mL) ou fonctionnelle (ferritinémie > 100 ng/mL avec un coefficient de saturation de la transferrine < 20 %)
Comment traiter une carence martiale ?
Le but du traitement est de reconstituer le stock martial pour corriger l’anémie ou la prévenir, et ainsi améliorer la qualité de vie, les symptômes liés à la carence martiale voire le pronostic de la maladie. Tout d’abord, l’ESMO recommande la supplémentation martiale IV, la voie orale restant possible uniquement chez les patients avec une carence martiale absolue (férritinémie < 100 ng/mL) et en situation non inflammatoire (CRP < 5 mg/L), ce qui n’est presque jamais le cas chez les patients avec une tumeur digestive en cours de chimiothérapie. En effet, l’absorption intestinale du fer est sévèrement altérée en cas de cancer, avec plus de 95 % d’élimination fécale. De plus, le fer oral est associé à des effets indésirables chez un tiers des patients (épigastralgies, nausées, diarrhée, constipation), et jusqu’à 70 % dans certaines études [35].
Les formulations de fer injectables contiennent du fer trivalent associé à des transporteurs de type dextrans (isomaltose) ou non (carboxymaltose ou saccharose). Les préparations les plus récentes de type carboxymaltose ferrique et isomaltose ferrique permettent l’administration de hautes doses de fer en une seule injection (en général un gramme), ce qui réduit le nombre d’hospitalisations ambulatoires nécessaires. Le carboxymaltose ferrique est composé d’un cœur d’hydroxyde de fer entouré d’une enveloppe glucidique, permettant une diffusion maîtrisée du fer aux tissus cibles, sans risque de relargage de grandes quantités de fer ionisé dans la circulation systémique. Après injection, le carboxymaltose ferrique est rapidement éliminé du plasma (environ 80 % est transféré dans la moelle, les 20 % restants dans le foie et la rate). L’isomaltose ferrique possède des propriétés similaires, avec du fer encapsulé dans une matrice évitant le relargage excessif de fer dans le sang. Il n’existe pas d’argument solide pour préférer une préparation de fer injectable à une autre. La dose cumulée de fer à administrer devrait être déterminée par la formule de Ganzoni, mais sa complexité la rend peu utilisable en pratique. Cependant, elle reste recommandée chez les patients pour lesquels un ajustement individuel de la posologie sera probablement nécessaire (anorexie mentale, cachexie, obésité hémorragie). En pratique, la posologie de fer injectable dépend de deux paramètres : le poids et le taux d’hémoglobine. En cas d’hémoglobine ≥ 10 g/dL et de poids ≥ 70 kg, 1 500 mg de fer IV sont requis, et 1 000 mg avec un poids entre 50 et 70 kg. Si l’hémoglobine est < 10 g/dL, les doses correspondantes sont 2 000 mg (≥ 70 kg) et 1 500 mg (entre 50 et 70 kg). La dose maximale est de 20 mg/kg, administrée sur 15 minutes, avec une surveillance d’au moins 30 minutes après injection. Si la dose cumulée de fer dépasse les 20 mg/kg de poids corporel, elle doit être fractionnée en deux administrations séparées d’un intervalle d’au moins une semaine. L’objectif est de normaliser le bilan martial, c’est-à-dire obtenir un CST > 20 % et une ferritinémie > 30 ng/mL. La supplémentation martiale doit se faire par voie intraveineuse avec une posologie adaptée au poids et au taux d’hémoglobine
La tolérance du fer injectable est globalement satisfaisante. Dans une étude observationnelle portant sur 619 patients avec une tumeur solide ou une hémopathie maligne, traités par carboxymaltose ferrique ± ASE, le taux d’effets indésirables liés au traitement n’était que de 2,3 %, les plus fréquemment rapportés étant les nausées et la diarrhée [36]. Dans cette même étude, 97 % des praticiens jugeaient l’efficacité et la tolérance du fer injectable « bonne » à « très bonne ». Un des freins majeurs à l’utilisation du fer injectable reste le risque allergique. Celui-ci était surtout associé aux anciennes formulations de type dextrans de haut poids moléculaire, actuellement retirés du marché. Dans une étude prospective multicentrique randomisée contre placebo en double aveugle, ayant inclus 2 534 patients hémodialysés, la fréquence de l’intolérance du fer injectable (de type dextrans) n’était que de 0,4 % contre 0,1 % avec le placebo (p = 0,02) [37]. Il n’y avait aucune différence en termes d’effets indésirables sévères. L’agence européenne du médicament (EMA) concluait dans son rapport de 2013 que le bénéfice du fer IV était supérieur aux risques potentiels, à condition que des mesures adéquates soient prises pour minimiser les réactions allergiques. Concrètement, l’EMA ne recommande plus l’administration de doses tests pour prédire ou éviter les réactions allergiques. Cependant, le fer injectable doit être administré par des équipes formées au diagnostic et au traitement des réactions anaphylactiques, avec des équipements de réanimation immédiatement accessibles. Le fer jouant un rôle essentiel dans la prolifération cellulaire, certaines inquiétudes ont pu émerger quant à la majoration du risque infectieux ou de la croissance tumorale. Mais aucune augmentation significative du risque infectieux n’a été observée avec le fer IV dans les principaux essais randomisés en oncologie [24, 25, 38]. Le fer libre, non lié à la transferrine, catalyse la production de ROS (espèces réactives de l’oxygène), conduisant à des lésions oxydatives de l’ADN. Mais dans des modèles murins, le fer à lui seul n’était pas responsable de la carcinogénèse. Une fois encore, aucune progression tumorale n’a été mise en évidence dans les essais randomisés ayant évalué le fer IV ± associé aux ASE [24, 25, 38]. Au final, seules l’allergie et la surcharge en fer contre-indiquent l’administration de fer injectable. Une fois la carence martiale traitée, il est recommandé de doser régulièrement l’hémoglobine et le bilan martial et de maintenir les niveaux-cibles de ces marqueurs avec le traitement minimum efficace. Le rythme de surveillance n’est pas clairement défini, mais un bilan martial (CST + ferritinémie) lors de chaque biologie pré-chimiothérapie peut être envisagé. La tolérance des fers injectables les plus récents est excellente, sans augmentation significative du risque allergique, infectieux ou de de progression tumorale
Conclusion
Depuis une dizaine d’années, les soins dits de support ont pris une place majeure en cancérologie. Nous avons appris à penser la prise en charge du patient au-delà de l’administration de thérapies anti-cancéreuses. En cas de tumeur digestive, la carence martiale est très fréquente, avec un impact négatif en termes de qualité de vie, tout en favorisant l’anémie et ses complications. Tout cela a un retentissement oncologique sur le bon déroulement de la chimiothérapie et un retentissement économique au travers des coûts engendrés par les ASE ou les transfusions. Pourtant, nous ne recherchons pas assez la carence en fer, alors que le couple CST + ferritinémie est suffisant au diagnostic dans la grande majorité des cas. En cas d’anémie par carence martiale, la supplémentation martiale IV associée aux ASE est indiscutable, permettant une augmentation du taux d’hémoglobine, une amélioration de la qualité de vie, ainsi qu’une réduction du recours à la transfusion et des doses d’ASE. Les préparations injectables les plus récentes autorisent l’administration de hautes doses de fer, avec une excellente tolérance. En revanche, nous ne disposons pas de preuves suffisantes pour recommander le traitement d’une carence martiale isolée sans anémie en oncologie, contrairement à ce qui est démontré dans la prise en charge de l’insuffisance cardiaque où cette stratégie est pleinement validée. Des essais prospectifs randomisés sont nécessaires et permettront probablement d’envisager un changement de pratiques similaire chez les patients avec un cancer.Take home messages
Liens d’intérêts
L’auteur déclare les liens d’intérêts suivants en rapport avec l’article : financement de travaux de recherche (Roche, Vifor Pharma). Consulting (Amgen, Bayer). Interventions orales (Sanofi, Vifor Pharma, Merck, Ipsen, Bayer).
![]() This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License
This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License