e-VEGF-IMMUNO-actu
MENUUn environnement hypoxique... Volume 11, issue 4, Octobre 2016
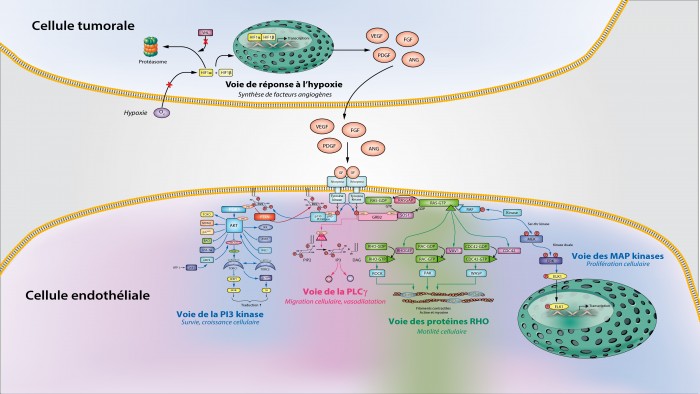
La cellule tumorale est une cellule qui manque d’oxygène : tant qu’elle n’est pas alimentée en oxygène par une vascularisation efficace, la tumeur ne peut croître au delà de quelques millimètres de diamètre. Elle va donc émettre des signaux à destination des cellules endothéliales pour les inciter à se multiplier et à s’organiser pour former des tubes qui viendront prolonger les vaisseaux existants pour coloniser la tumeur.
En présence d’oxygène, un facteur appelé HIF1α est normalement inactif et conduit vers le protéasome après sa conjugaison avec l’ubiquitine, réalisée par la protéine VHL. En absence d’oxygène, ce facteur devient actif ; il peut se combiner avec son partenaire, HIF1β, et l’ensemble est dirigé vers le noyau où il préside à la transcription de gènes cibles nombreux nécessaires à la stimulation de l’angiogenèse. Parmi ces gènes figurent les gènes de facteurs de croissance (GF), en particulier les VEGF, spécialement dédiés à la stimulation des cellules endothéliales, mais aussi les FGF, PDGF, angiopoïétines, etc. Tous ces facteurs de croissance, synthétisés dans la cellule tumorale, sont destinés à l’exportation vers le microenvironnement tumoral où ils sont reconnus par des récepteurs à activité tyrosine kinase (RTK) exprimés par les cellules endothéliales.
L’activation des RTK se déroule en deux temps : la liaison avec le facteur de croissance entraîne d’abord la dimérisation du récepteur, et cette dimérisation permet la mise en contact des domaines catalytiques des deux molécules de récepteur : il en résulte une autophosphorylation du récepteur sur des résidus tyrosine localisés dans la région C-terminale du récepteur. Ces résidus tyrosines phosphates sont reconnus par toute une série de protéines spécialisées dans leur reconnaissance par l’intermédiaire d’un domaine appelé « domaine SH2 » ; plusieurs voies de signalisation peuvent alors être activées, selon la nature de la protéine à domaine SH2 qui s’est fixée sur un résidu tyrosine phosphate. Quatre d’entre elles figurent sur ce schéma.
La première est la voie de la PI3 kinase. Cette enzyme est un hétérodimère constitué d’une sous-unité régulatrice, p85, portant un domaine SH2, et d’une sous-unité catalytique, capable de phosphoryler un lipide membranaire, le phosphatidylinositol 4,5-diphosphate. Elle fixe sur ce lipide (plus précisément sur la partie inositol) un troisième groupement phosphate, en position 3, ce qui explique son nom de PI3 kinase. La réaction inverse de cette phosphorylation est une déphosphorylation, catalysée par une phosphatase, PTEN, qui vient donc exercer un frein sur l’activation de la voie. Des protéines porteuses d’un domaine spécialisé appelé « domaine PH » sont capables de reconnaître spécifiquement le phosphate en 3 de l’inositol du lipide et leur liaison à ce domaine active leur activité kinase : ainsi, la protéine PDK1 est activée, ce qui lui permet de phosphoryler la protéine AKT, qui phosphoryle à son tour une grande variété de substrats. Tous ces substrats, que nous ne détaillerons pas, et qui peuvent être activés ou désactivés par phosphorylation, sont impliqués dans la prolifération et la survie cellulaires : activation du cycle cellulaire, inhibition de l’apoptose, etc. Une place spéciale est donnée à la protéine mTOR, qui est activée par AKT en deux étapes inhibitrices (deux inhibitions valant une activation !). Cette kinase, associée à RAPTOR dans le complexe TORC1, active plusieurs mécanismes assurant la traduction des ARN messages en protéines : elle est ainsi responsable de la croissance des cellules, en termes d’acquisition de biomasse. mTOR peut également s’associer à RICTOR pour former le complexe TORC2, qui active la kinase AKT, réalisant ainsi un feed-back positif renforçant l’activation de cette voie.
La seconde voie présentée sur ce schéma est la voie de la phospholipase C gamma (PLCγ). Cette protéine à domaine SH2 clive le phosphatidylinositol 4,5-diphosphate membranaire pour former le diacylglycérol (DAG) et l’inositol 1,4,5-triphosphate (IP3). [La PLCγ a donc le même substrat lipidique que la PI3 kinase, mais elle ne lui fait pas subir les mêmes transformations]. IP3 et DAG sont des seconds messagers libérés dans le cytoplasme. À leur tour, ils ont de multiples actions en faveur de la prolifération cellulaire, mais aussi à de nombreux niveaux métaboliques : libération de l’ion calcium Ca2+ dans le cytoplasme, à partir des réserves du réticulum endoplasmique, activation de la protéine kinase C, stimulation de la motilité des cellules, etc. Et rappelons que le DAG est connu de longue date comme promoteur de la croissance tumorale.
La troisième voie est celle de la voie des MAP kinases, sur laquelle vient se brancher la quatrième voie, celle des protéines RHO. La protéine à domaine SH2 qui ouvre cette voie s’appelle GRB2 ; c’est une protéine adaptatrice qui « recrute » une enzyme, appelée SOS1, qui a pour fonction d’échanger un nucléotide soluble, le GDP (guanosine diphosphate) contre un autre, le GTP (guanosine triphosphate), au niveau de son substrat, une protéine membranaire appelée RAS. Lorsqu’elle est liée au GDP, RAS est inactive ; lorsqu’elle est liée au GTP elle est active, change de conformation, et peut alors reconnaître une kinase appelée RAF. Cette activation de RAS est très brève, car cette protéine est dotée d’une activité enzymatique d’hydrolyse du GTP : elle revient, lors de cette hydrolyse facilitée par la protéine RASGAP, à sa liaison préférée avec le GDP… RAS-GTP active la kinase RAF simplement par démasquage d’un site de phosphorylation de cette dernière : elle peut alors être phosphorylée, et cette phosphorylation est activatrice, par diverses kinases. S’enclenche alors un processus de phosphorylation en trois étapes, une véritable cascade de phosphorylations : la kinase RAF phosphoryle et active la kinase MEK, qui phosphoryle et active la kinase ERK, qui phosphoryle et active des facteurs de transcription qui peuvent alors migrer dans le noyau. Ces facteurs de transcription étaient autrefois appelés des mitogen activated proteins ou MAP, et la kinase qui les phosphoryle a reçu le nom de MAP kinase ; la kinase MEK qui phosphoryle la MAP kinase est alors une MAP kinase kinase ou MAP2K, et la kinase RAF qui phosphoryle la MAP2K est bien sûr une MAP3K. Quant aux facteurs de transcription activés par la MAP kinase, ils sont nombreux, ELK1 en est l’exemple ; ils permettent la transcription de nombreux gènes nécessaires à la prolifération cellulaire : cycline D1 pour l’entrée des cellules dans le cycle cellulaire, enzymes de la machinerie de la réplication de l’ADN, protéines impliquées dans la réalisation de la mitose, etc.
Au niveau de RAS s’ouvre une quatrième voie de signalisation : celle des protéines de la famille RHO. Ces protéines, dont trois membres sont représentés sur le schéma, RHO, RAC et CDC42, sont, comme RAS, des petites protéines G : elles sont activées par échange de leur GDP contre du GTP, échange réalisé par des protéines comme RHOGEF, VAV1, CDC42GEF. Lorsqu’elles sont activées grâce à leur liaison au GTP, elles peuvent activer des kinases, tout comme nous avons vu RAS-GTP activer la kinase RAF. Ces kinases, dont les exemples mentionnés ici sont ROCK, PAK et WASP, sont impliquées dans le contrôle de l’activité du cytosquelette d’actine et de myosine : selon leur degré de phosphorylation, les filaments contractiles du cytosquelette sont plus ou moins étirés ou relâchés, et permettent ainsi à la cellule de se déplacer : la voie des protéines RHO est ainsi impliquée dans la motilité cellulaire, motilité qui permet les migrations nécessaires aux cellules endothéliales pour constituer les tubes qui deviendront les artérioles et les veinules de la vascularisation tumorale.
Survie, prolifération, motilité : les récepteurs à activité tyrosine kinase peuvent ainsi intervenir à toutes les étapes de l’angiogenèse, comme ils peuvent intervenir d’ailleurs à toutes les étapes de l’oncogenèse et de la progression tumorale. Tout va dépendre en fait d'une part de la nature des récepteurs exprimés à la surface d’une cellule, normale ou tumorale (récepteurs du VEGF pour la cellule endothéliale, récepteurs de l’EGF et d'autres facteurs de croissance pour la cellule tumorale, etc.), et d'autre part de la nature des protéines à domaine SH2, médiateurs obligatoires de leur mise en jeu, qui sont exprimées dans cette cellule au moment où elle reçoit le message apporté par un facteur de croissance.
Liens d’intérêts : L’auteur déclare ne pas avoir de lien d’intérêt en rapport avec cet article.
Lexique
Dans le schéma, les kinases sont coloriées en bleu, les phosphatases en rouge, les facteurs de croissance en beige, les facteurs de transcription en jaune, les petites protéines G en vert, les GEF en fuchsia, les GAP en saumon…
AKT : nom d’une souche de souris
AMPK : AMP-dependent kinase
ANG : angiopoïétine
DAG : diacylglycerol
EBP : EIF-binding protein
EIF : elongation initiation factor
ELK : E-twenty-six oncogene homolog (ETS)-like kinase
ERK : extracellularly-regulated kinase
FGF : fibroblastic growth factor
FGFR : fibroblastic growth factor receptor
GAP : GTPase-activating protein
GEF : guanosine nucleotide exchange factor
GPCR : G-protein-coupled receptor
GRB : growth factor receptor-binding protein
HIF : hypoxia-induced factor
ΙP3 : inositol-1,4,5-trisphosphate
LKB1 : liver kinase B1
MAP : mitogen-activated protein
MEK : MAPK-ERK kinase
mTOR : mammalian target of rapamycin
PDGF : platelet-derived growth factor
PDGFR : platelet-derived growth factor receptor
PDK : phosphatidylinositol-3,4,5-trisphosphate – dependent kinase
PH : plekstrin-homology domain
PI3K : phosphatidylinositol-4,5-diphosphate 3-kinase
PKC : protein kinase C
PLCγ : phospholipase Cγ
PTEN : phosphatase and tensin homolog
RAF : rat fibrosarcoma
Raptor : regulatory associated protein of mTOR
RAS : rat sarcoma
RHO : RAS homolog family protein
Rictor : Rapamycin-independent companion of mTOR
S6 : sous-unité S6 du ribosome
S6K : S6 kinase
SH2 : SRC-homology domain-2
TSC : tuberous sclerosis complex
VEGF : vasculo-endothelial growth factor
VEGFR : vasculo-endothelial growth factor receptor
VHL : von Hippel-Lindau protein