e-VEGF-IMMUNO-actu
MENURôle du VEGF dans l’épuisement des lymphocytes T intratumoraux Volume 10, issue 3, Septembre-octobre 2015
Cet article de revue fait le point, de manière synthétique et en langue française, sur les bases immunologiques nécessaires pour mieux comprendre les stratégies récentes de traitement des cancers.
La reconnaissance des cellules tumorales par le système immunitaire et la capacité de ce dernier à réprimer le développement des tumeurs, ou immuno-surveillance, ont été évoquées il y a plus d’un siècle par Paul Erhlich. Ce concept est, à l’heure actuelle, à la base des études d’immunologie antitumorale.
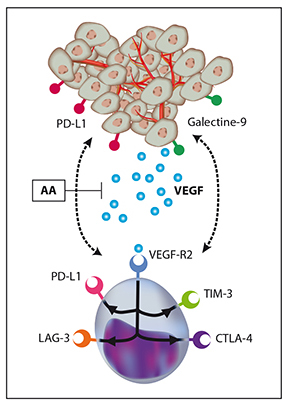
Les cellules tumorales acquièrent progressivement des propriétés qui leur permettent d’échapper au contrôle de leur prolifération par le système immunitaire. Elles sont en particulier capables de créer un microenvironnement immuno-suppresseur favorisant l’accumulation de cellules immuno-régulatrices, telles que les lymphocytes T régulateurs (Treg) et les cellules myéloïdes suppressives (MDSC), ainsi que l’inhibition des fonctions des lymphocytes T effecteurs (LT CD8+). Cette perte de fonction, appelée « épuisement », est associée à l’expression de molécules inhibitrices telles que PD-1 (programmed cell death 1), TIM-3 (T-cell immunoglobulin and mucin 3 domain), CTLA-4 (cytotoxic T lymphocyte antigen 4) et LAG-3 (lymphocyte activation gene 3).
La liaison de ces molécules à leurs ligands aboutit à une perte graduelle des fonctions des leucocytes infiltrant les tumeurs. Au sein de ce microenvironnement tumoral, le VEGF-A a longtemps été étudié pour ses propriétés pro-angiogéniques. Cependant, le VEGF-A possède également des propriétés immuno-modulatrices favorisant l’échappement des cellules tumorales à la surveillance par le système immunitaire (induction de Treg et cellules myéloïdes suppressives).
Le format de ce résumé est trop court pour rendre compte en détail de cette excellente revue que nous vous encourageons vivement à consulter directement (http://dx.doi.org/10.1051/medsci/20153105004).
En résumé, on dispose de données expérimentales et cliniques qui permettent d’affirmer :
1- que le blocage de la voie VEGF-A/VEGF-R diminue l’expression de PD-1 à la surface des lymphocytes T CD8+ infiltrant la tumeur et favorise donc l’épuisement de ces cellules. Il semble que l’effet antitumoral observé après traitement par anti-VEGF-A n’est pas seulement lié à une activité anti-angiogénique, mais également à un effet stimulant de l’immunité antitumorale ;
2- que le VEGF-A agit directement sur l’expression de PD-1 sur les lymphocytes T CD8+ activés.
L’équipe d’Éric Tartour a montré que l’expression des récepteurs du VEGF est associée à l’activation des lymphocytes et que le VEGF-A permet d’augmenter l’expression de PD-1 à la surface des LT CD8+ ;
3- que le VEGF-A module le degré d’épuisement des lymphocytes T cytotoxiques infiltrant la tumeur.
Le VEGF-A module directement l’expression de PD-1 à la surface des LT CD8+ activés et est également responsable d’une augmentation de l’expression d’autres molécules de co-stimulation inhibitrices (TIM-3, CTLA-4) et d’une augmentation de la densité de ces molécules (TIM-3, CTLA-4 mais aussi LAG-3). De plus, le VEGF-A favorise la co-expression simultanée de ces molécules, qui est associée à un degré d’épuisement plus important du lymphocyte. L’administration d’un anti-VEGF-A permet enfin de réduire la proportion de LT CD8+ intratumoraux co-exprimant trois ou quatre molécules de co-stimulation inhibitrices.
Intérêt d’une combinaison thérapeutique associant un anti-VEGF-A à un anti-PD-1
Avec le développement récent de nouvelles stratégies d’immunothérapie anticancéreuse bloquant les molécules de co-stimulation inhibitrices (anti-CTLA-4, anti-PD-1) et offrant des réponses objectives prolongées, les stratégies thérapeutiques visant à restaurer une immunité antitumorale efficace semblent prometteuses. Toutefois, ces réponses objectives ne sont pas observées chez tous les patients (31 % de réponses objectives dans le mélanome avec un anti-PD-1 [10] et 11 % avec un anti-CTLA-4, suggérant que, chez certains patients, cette restauration de l’immunité pourrait être insuffisante). En diminuant la proportion de LT CD8+ épuisés exprimant différentes molécules de co-stimulation inhibitrices, un traitement par anti-VEGF-A pourrait permettre d’accroître la sensibilisation des tumeurs à des immuno-modulateurs tels que l’anti-PD-1.
L’équipe a analysé l’effet d’un traitement par anti-PD-1 sur des sarcomes murins produisant du VEGF-A (MEF) ou non (MEF-KO). De façon intéressante, l’effet anti-tumoral de l’anti-PD1 n’a été observé que sur les tumeurs MEF-KO, ce qui suggère que le VEGF-A intratumoral limite l’action de l’anti-PD-1. De même, le traitement par anti-PD-1 seul paraît inefficace sur les tumeurs CT26, alors qu’une association anti-PD-1 + anti-VEGF-A a un effet anti-tumoral supérieur à celui d’un traitement par anti-VEGF-A seul.
Conclusion
Les résultats rapportés par Voron et al. montrent pour la première fois le rôle clé, et direct, du VEGF-A présent dans le microenvironnement tumoral sur l’épuisement des LT CD8+ intratumoraux. Deux essais cliniques associant le bévacizumab (anti-VEGF) à un anti-PD-1 sont en cours pour évaluer l’intérêt d’une telle combinaison dans le cancer du rein métastatique (NCT02348008) et dans le cancer pulmonaire non à petites cellules métastatique (NCT02039674).