e-VEGF-IMMUNO-actu
MENUBases moléculaires de la réponse immunitaire cellulaire contre les tumeurs Volume 11, issue 2, Avril 2016
Les principales cellules effectrices de cette action sont les lymphocytes T CD8+, également appelés les lymphocytes cytotoxiques, qui détruisent des cellules tumorales. Le mécanisme de reconnaissance des cellules cibles est médié par un récepteur spécifique qui se trouve à la surface des lymphocytes T, appelé le cell receptor (TCR). Le TCR reconnait des peptides antigéniques présentés par les cellules présentatrices d’antigènes (CPA) à travers les molécules du complexe majeur d’histocomptabilité (CMH, appelé également HLA chez l’humain). Les lymphocytes CD8+ interagissent avec les CMH de classe I, et lorsqu’un d’eux reconnait un peptide antigénique, il est activé et procède à la destruction de la cellule tumorale.
Des nombreux peptides tumoraux sont identifiés à ce jour. Nous pouvons les diviser en deux grands groupes :
- les antigènes spécifiques de la tumeur, qui sont des molécules exprimées exclusivement par les cellules cancéreuses et qui déclenchent une réaction très spécifique ;
- les antigènes associés à la tumeur, regroupant des molécules retrouvées non seulement dans les cellules tumorales mais également dans les cellules saines ; ces antigènes sont par conséquent moins spécifiques [1].
Le cancer pulmonaire non-à petites cellules et le mélanome sont deux tumeurs solides parmi les plus fréquentes ; elles présentent un fort caractère immunogénique expliqué par le nombre important de mutations qu’elle portent, donnant naissance à des variants protéiques qu’on appelle souvent des « néo-antigènes », c’est-à-dire des antigènes propres à une tumeur qui surviennent suite à une mutation [2].
Le cycle immunitaire dans le cancer se déroule en plusieurs étapes.[3]
- La première est déterminée par le largage de peptides antigéniques par les cellules tumorales. Ces antigènes sont ensuite capturés et traités par les cellules dendritiques (CD). La cellule dendritique présente ensuite ces peptides aux lymphocytes T, à travers les CMH de classe I (interaction avec les CD8+) et de classe II (interaction avec les CD4+). Il s’ensuit une phase d’initiation (priming) et d’activation des cellules immunitaires, qui concerne des lymphocytes T effecteurs (CD4+ et CD8+), mais également des lymphocytes T régulateurs. Ces derniers vont jouer un rôle clé dans la régulation de cette activation immune. Les lymphocytes T activés vont migrer vers la tumeur et vont reconnaître les cellules tumorales via le TCR. Une prolifération suffisante de lymphocytes T permettra de détruire les cellules tumorales.
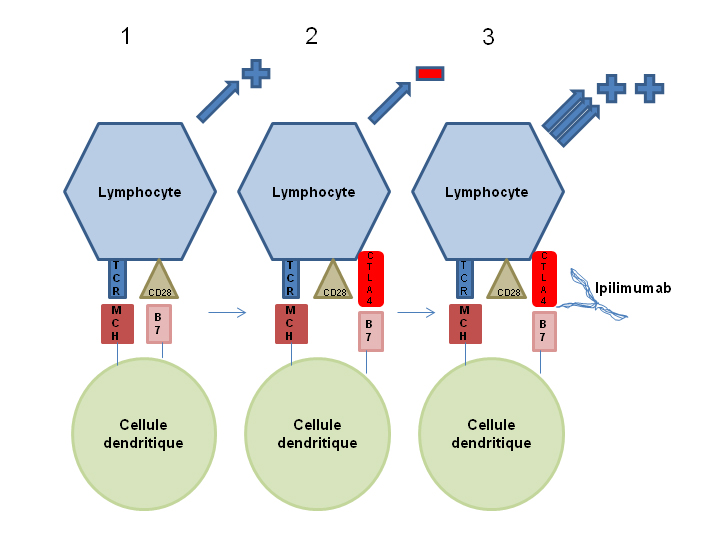
CTLA-4 (Cytotoxic T-lymphocyte antigen-4)
Lorsque la cellule dendritique (CD) présente les peptides aux lymphocytes T, une cascade de signaux de prolifération se déclenche. L’engagement du TCR avec la CMH de classe I (phase de reconnaissance) provoque l’expression d’une molécule B7 par la cellule dendritique CD qui stimule les lymphocytes T grâce à son interaction avec le récepteur CD28, présent à la surface de ces lymphocytes (phase d’activation), provoquant un feedback positif qui stimule la prolifération lymphocytaire. Le récepteur CTLA-4 (exprimé également au niveau des cellules T), quant à lui, régule négativement les lymphocytes T au moment de cette phase d’activation. C’est également un récepteur des molécules B7, et comme il a pour ces molécules une affinité plus forte que celle du CD28, il en résulte une diminution de l’activation lymphocytaire par la cellule dendritique. Ces systèmes de communication entre cellules dendritiques et lymphocytes T, qui modulent l’activation lymphocytaire, sont appelés les checkpoints immunologiques.
Un anticorps anti-CTLA-4, l’ipilimumab (Yervoy®), peut être utilisé comme inhibiteur du checkpoint de régulation négative gouverné par CTLA-4 en empêchant cette interaction. Les différentes étapes et l’effet de l’ipilimumab sont représentés dans la figure 1.
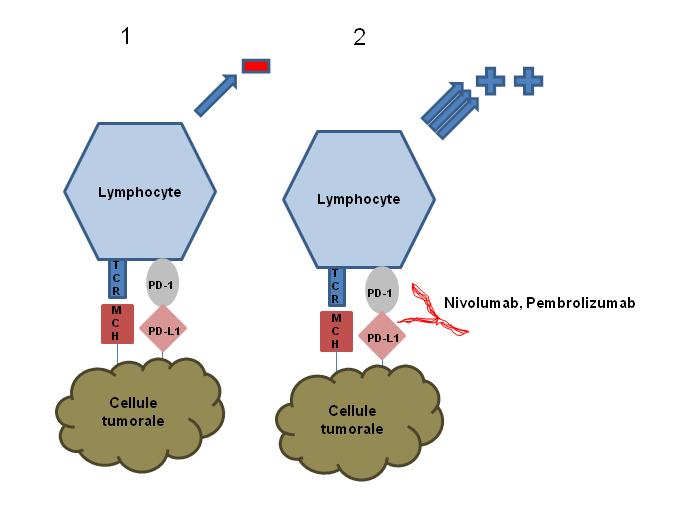
PD-1 et PD-L1 (Programmed-death 1 et son ligand)
Le PD-1 est un autre récepteur inhibiteur des cellules T qui est exprimé plus tard dans le cycle immunitaire et qui représente un autre checkpoint immunitaire. Il reconnaît deux ligands, le PD-L1 (le principal) et le PD-L2, tous deux retrouvés dans les cellules présentatrices d’antigènes et dans les cellules tumorales. L’interaction entre PD-1 et PD-L1 joue un rôle important dans la régulation de la phase effectrice de la réponse des cellules T dans les tissus périphériques, en raison de l’expression des ligands PD-L1 et PD-L2 au niveau des cellules tumorales. L’interaction entre PD-1 et PD-L1 inhibe également l’activation des lymphocytes. Le nivolumab et le pembrolizumab sont deux exemples d’inhibiteurs du checkpoint PD-1 et le durvalumab et le atezolizumab, médicaments encore expérimentaux, sont des exemples d'inhibiteurs du PD-L1. L’interaction entre la cellule tumorale et les lymphocytes est représentée dans la figure 2.
Les thérapies visant à lever des régulations immunes inhibitrices, tant dans la phase de priming (anti-CTLA-4) que dans la phase effectrice (anti-PD1 ou anti-PD-L1) de l’immunité acquise, sont actuellement les traitements le plus efficaces dans le mélanome métastatique [4]. Les anti-PD-1 sont à ce jour approuvés en deuxième ligne dans le cancer pulmonaire métastatique non à petites cellules [5]. De nombreux essais cliniques de phase III sont en cours dans d’autres pathologies tumorales, comme (liste non-limitative) le cancer rénal, le cancer de la vessie, le cancer des voies aérodigestives supérieures.
Les différentes stratégies d’immunothérapie anti-tumorale apportent déjà et vont certainement encore plus apporter des changements drastiques dans la prise en charge des cancers.
Liens d’intérêts : L’auteur déclare ne pas avoir de lien d’intérêt en rapport avec cet article.