Hépato-Gastro & Oncologie Digestive
MENUAnoperineal lesions Volume 25, issue 8, Octobre 2018
Introduction
Au cours des maladies inflammatoires chroniques de l’intestin (MICI) les lésions anopérinéales observées peuvent être spécifiques, elles concernent la maladie de Crohn (MC), ou non. Les lésions non spécifiques (maladie hémorroïdaire, fissure…) ne sont pas liées à une atteinte inflammatoire de la maladie : leur incidence est mal connue variant dans la littérature de 3,3 à 20,7 %. Elles représentent un événement intercurrent dans l’histoire de la MICI, sont favorisées par la diarrhée, posent des problèmes de diagnostic différentiel et leur traitement doit toujours être le plus conservateur possible.
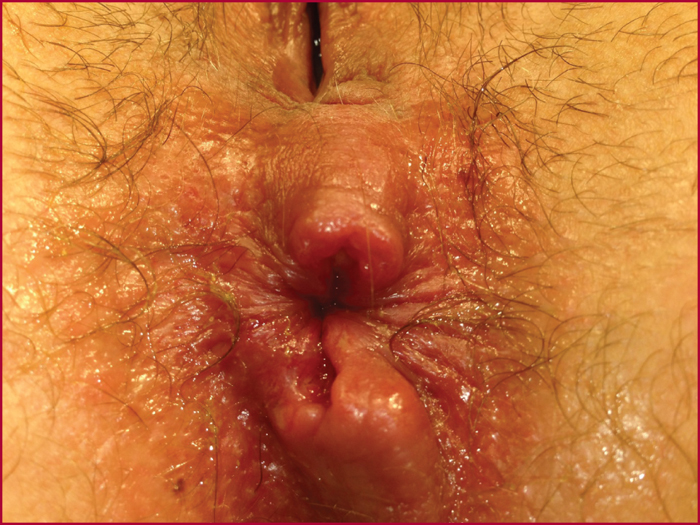
On appelle lésions anopérinéales (LAP) spécifiques de la MC l’ensemble des lésions attribuables à la MC touchant le canal anal, la peau du périnée, le bas rectum et la cloison rectovaginale. Il existe trois types de lésions élémentaires : les ulcérations, les suppurations et les sténoses. On distingue les lésions primaires contemporaines d’une poussée aiguë de la MC principalement représentées par les ulcérations (figure 1). Les suppurations et les sténoses sont souvent considérées comme la conséquence des lésions primaires : on parle de lésions secondaires d’évolution indépendante de la maladie luminale. Les différents types de lésions peuvent coexister.
Les LAP sont fréquentes au cours de la MC avec une probabilité cumulée de survenue à 20 ans de 43 %, 26 % pour les suppurations [1]. Ces lésions peuvent être inaugurales de la maladie dans 8 à 20 % des cas. Le risque de LAP est d’autant plus important qu’il existe une atteinte rectale : 80 % pour cette localisation versus 25 % pour les atteintes iléales isolées [2]. Les LAP altèrent souvent considérablement la qualité de vie des malades [3].
La prévalence de l’incontinence anale au cours des MICI est estimée à 24 % dans une méta-analyse récente [4], la chirurgie des fistules anales est un facteur de risque indépendant d’incontinence anale mais le processus inflammatoire pariétal rectal, l’existence d’ulcérations profondes du canal anal ou la présence d’une fistule rectovaginale peut également être source de troubles de la continence.
Les lésions anales de la maladie de Crohn représentent un processus inflammatoire chronique exposant à un risque propre de dysplasie et de cancer du canal anal, du rectum ou dans le trajet de la suppuration chronique [5]. Elles imposent une vigilance particulière notamment dans le cas des sténoses anorectales et justifient la réalisation de biopsies.
Évaluer la sévérité des lésions anopérinéales de la maladie de Crohn
L’existence de LAP au cours de la MC altère le pronostic de la maladie et constitue un facteur péjoratif [6]. La moitié des gestes chirurgicaux réalisés pour la prise en charge de la MC concerne des gestes proctologiques [7].
La gravité des lésions anales de la MC est corrélée à la taille des lésions et à leur retentissement anatomique. Plusieurs classifications sont utilisées pour quantifier cette sévérité. La plus courante, celle de Cardiff et Hughes (ou classification UFS) prend en considération l’ensemble des lésions anales de la maladie dans trois rubriques classiques (ulcération, fistules et abcès, sténose) (tableau 1)[8].
Les recommandations américaines proposent de classer les fistules, en distinguant les fistules simples (superficielles, intersphinctérienne, transsphinctérienne basse) des fistules complexes (intersphinctérienne haute transsphinctérienne haute, extrasphinctérienne, suprasphinctérienne, rectovaginale, à trajet multiples) [9]. Le score PDAI (Perineal Disease Activity Index) permet d’obtenir un score global de sévérité qui peut varier entre 0 et 20 (tableau 2). Il regroupe les principaux items symptomatiques et anatomiques recueillis lors de l’entretien et l’examen clinique d’une personne ayant des LAP de MC. Chaque item est associé à une valeur de pondération numérique. L’évaluation clinique de la gravité des lésions anales se heurte malheureusement à deux écueils importants qui sont une concordance interobservateur parfois insuffisante en fonction du type de lésion d’une part, un manque de sensibilité pour le diagnostic et l’évaluation des suppurations d’autre part. En effet, l’évaluation et la description des lésions sont très variables lorsqu’elles sont appréciées par des praticiens différents et de façon indépendante. Il existe un relatif consensus pour qualifier le caractère inflammatoire d’un orifice externe mais pas pour la qualité du drainage ou le caractère complexe ou non de la fistule. L’évaluation de la sévérité d’une ulcération anale n’a pas une bonne concordance interobservateur [10].
Lorsqu’on compare les données de l’examen clinique à celle de l’IRM en utilisant la même classification, il apparaît que la concordance entre les données cliniques et radiologiques n’est correcte que dans 58 % des cas pour évaluer la gravité des fistules ; l’examen clinique sous-estime les fistules complexes une fois sur quatre et surestime les fistules simples dans trois quarts des cas [11].
L’IRM est incontournable pour le cas particulier des suppurations anopérinéales parce qu’elle apprécie la gravité des lésions avec une meilleure sensibilité que l’examen clinique. Elle permet de décrire de façon précise les lésions et leur topographie et de définir un score d’activité d’intérêt pronostique, à la fois pour la prise en charge immédiate, et pour l’évolution à distance de la suppuration [12]. À l’inverse, la sensibilité diagnostique de l’IRM est très insuffisante au diagnostic des ulcérations anales (souvent identifiées comme des fistules intersphinctériennes) et des sténoses [11]. L’IRM est incontournable pour le cas particulier des suppurations anopérinéales
Prendre en charge une suppuration aiguë au cours de la maladie de Crohn
La prise en charge d’une suppuration anale de MC à la phase aiguë repose essentiellement sur le drainage des collections. L’abcès anopérinéal est une urgence chirurgicale proctologique et rien ne doit différer sa prise en charge chirurgicale, notamment l’obtention d’une IRM. Le drainage chirurgical peut être effectué par une incision sous anesthésie locale en consultation lorsque l’abcès est facilement accessible et superficiel. Il doit être réalisé sous anesthésie générale dans les autres cas. Lors de l’examen proctologique sous anesthésie générale, il faut chercher un orifice interne de fistule et la présence d’un trajet fistuleux qui conduisent à la mise en place d’un drainage par séton non serré. L’appareil sphinctérien doit toujours être respecté, aucun geste de mise à plat n’est concevable hormis pour d’éventuels décollements sous-cutanés. Les antibiotiques ne peuvent pas constituer à eux seuls le traitement d’un abcès anal. Il n’existe pas d’essai randomisé évaluant l’efficacité des antibiotiques dans le traitement des fistules anales à la phase aiguë. Les antibiotiques ayant une couverture anti-bacilles à Gram négatifs et anti-anaérobies sont généralement prescrits, métronidazole et ciprofloxacine sont régulièrement utilisés pour encadrer le geste chirurgical de drainage. Les biothérapies ne constituent pas un traitement des suppurations lorsqu’il existe une collection non ou mal drainée, elles doivent être dans ce cas suspendues jusqu’au drainage. Les anti-inflammatoires, stéroïdiens ou non, utilisés de façon intempestive à titre antalgique, sont formellement contre-indiqués car ils favorisent la diffusion de la suppuration et son évolution vers une cellulite. Un abcès anal nécessite un drainage chirurgical en urgence et ne peut en aucun cas être traité de façon purement médicale
Traitements médicaux des lésions anopérinéales
La stratégie thérapeutique concernant les LAP de MC est loin d’être encore parfaitement codifiée. Les buts du traitement sont de soulager les douleurs, de tarir la suppuration éventuelle, d’éviter les récidives et de préserver la fonction sphinctérienne en évitant le recours ultime à la proctectomie.
Le traitement des LAP de la maladie de Crohn, et en particulier des suppurations, nécessite fréquemment la mise en œuvre d’un traitement médical associé à une prise en charge interventionnelle proctologique.
Traitement médical des fistules
La réponse sous placebo observée dans les essais cliniques visant à traiter des fistules anales de la MC a été étudiée dans une méta-analyse : une amélioration symptomatique est observée chez un malade sur cinq et un tarissement des fistules anales chez un peu plus d’un malade sur sept [13].
Les aminosalycilés n’ont aucune place dans le traitement des LAP de MC. Les corticostéroïdes ne sont pas recommandés dans cette situation car ils augmentent le risque de survenue d’un abcès anopérinéal.
Les anti-TNF-alpha permettent d’obtenir un meilleur tarissement des trajets fistuleux drainés que le placebo après traitement d’induction et au cours traitement d’entretien. Le premier essai contrôlé randomisé dédié au traitement des fistules anales a été publié en 1999 [14]. Les taux d’amélioration symptomatique et de guérison étaient respectivement de 68 et 55 % sous infliximab versus 26 et 13 % sous placebo au terme du traitement d’induction. Le traitement d’entretien permettait, à un an, un tarissement durable de la fistule dans 36 % des cas sous infliximab et 19 % sous placebo [15]. Pour l’adalimumab des résultats comparables étaient observés dans une analyse de sous-groupe d’essais non spécifiquement dédiés aux fistules anales [16]. Une méta-analyse des essais contrôlés randomisés confirme un bénéfice deux à trois fois supérieur au placebo au terme du schéma d’induction [17].
Un travail multicentrique transversal récent suggère un lien statistique entre la proportion de malades cicatrisés et les taux résiduels d’infliximabémie mesurés [18] : les taux étaient trois fois supérieurs chez les malades ayant une fistule tarie que chez les malades ayant encore une fistule active.
L’efficacité du védolizumab, un antagoniste sélectif des intégrines α4β7 du tube digestif, est évaluée dans une étude de sous-groupe de l’étude GEMINI 2 [19]. À la semaine 52, le taux de fermeture des fistules était de 52 % dans le groupe védolizumab versus 11 % pour le groupe placebo. L’échec préalable d’un traitement anti-TNF était un facteur prédictif négatif d’efficacité. Un essai contrôlé dédié aux fistules est en cours (essai ENTERPRISE ClinicalTrials.gov NCT02630966).
Concernant l’ustékinumab (anticorps monoclonal visant à inhiber les interleukines IL12 et IL23), un travail, rapporté sous forme d’abstract, concernant les études pivots, observait une efficacité dans 27,7 % des cas à la semaine 8, à la dose de 6 mg/kg, ce résultat étant à la limite de la significativité [20]. On ne peut donc à ce jour conclure quant à l’efficacité de ce traitement qui doit être mieux évalué dans cette indication.
Le mode d’évaluation de la réponse thérapeutique reste un point crucial dans l’évaluation de l’efficacité des traitements. Dans l’essai princeps de Present [14], la guérison était définie par l’absence d’écoulement de l’ensemble des orifices externes visibles soumis à une pression digitale douce et la réponse symptomatique par l’absence d’écoulement d’au moins la moitié des orifices. Ce critère clinique paraît pertinent mais il est finalement assez grossier par rapport aux données de l’IRM. Les deux tiers des malades considérés cliniquement comme cicatrisés ont encore des fistules actives sur le plan radiologique dans le travail prospectif d’un centre bordelais [21]. La rémission profonde en IRM dans une autre expérience ne concerne qu’un tiers des patients alors que 53 % étaient en rémission clinique après 40 mois de traitement par infliximab [22].
L’intérêt d’un traitement anti-TNF prolongé et d’une combothérapie, associant un immunosuppresseur comme l’azathioprine à l’infliximab, paraissent confirmés pour augmenter l’efficacité du traitement des LAP [23]. Un autre travail conclut à une potentialisation de l’efficacité de l’adalimumab par l’adjonction d’une antibiothérapie par ciprofloxacine pendant 12 semaines ; malheureusement cette efficacité n’est pas maintenue à l’arrêt de l’antibiotique [24]. Les anti-TNF et en particulier l’infliximab sont des médicaments recommandés dans la prise en charge des suppurations anales de la maladie de Crohn drainée. Le bénéfice clinique concerne deux tiers des malades mais la rémission profonde radiologique est plus rare. Il paraît nécessaire d’optimiser la posologie, de maintenir le traitement longtemps et d’associer des thiopurines
L’arrêt du traitement par anti-TNF expose à un risque de récidive de la fistule une fois sur deux après cinq ans [25].
Plusieurs travaux émanant de centres tertiaires illustrent la difficulté d’analyse d’efficacité des thérapeutiques lorsque sont associés des gestes chirurgicaux et des médicaments. Ces stratégies combinées concernent l’immense majorité sinon la totalité des malades : l’azathioprine (ou le méthotrexate), l’infliximab et la chirurgie sont proposés à 80 %, 77 % et 95 % des malades ayant une fistule de MC [26]. Le tarissement de la fistule est observé plus de trois fois sur quatre après un suivi de 48 mois mais il est difficile d’analyser la part des gestes chirurgicaux itératifs ou des changements de traitement médical dans le bénéfice thérapeutique acquis. Les stratégies de traitement d’entretien et de désescalade, de même que les autres biothérapies, ne sont pas bien évaluées
Traitement médical des ulcérations et sténoses
Les études de cohortes dédiées à évaluer l’efficacité des anti-TNF dans cette indication sont peu nombreuses. Les ulcérations anales de la maladie de Crohn cicatrisent dans 47 et 70 % des cas après un et deux ans de suivi respectivement [27]. Les sténoses du canal anal sont plus rares que les ulcérations et les suppurations mais leur prise en charge thérapeutique est difficile et le pronostic fonctionnel est souvent péjoratif. La composante inflammatoire est souvent présente et les suppurations complexes y sont associées dans deux tiers des cas. La régression de la sténose est observée dans 32 et 45 % des cas après un et deux ans de suivi respectivement, avec une évolution meilleure pour les malades ayant une suppuration associée [28].
Traitements chirurgicaux des lésions anopérinéales
Traitement chirurgical des fistules
Dans le cas des fistules anales cryptogénétiques le traitement de référence est la fistulotomie en un ou plusieurs temps. Au cours de la maladie de Crohn, afin de respecter la fonction de continence, les traitements visant à mettre à plat le trajet fistuleux (geste de section : fistulotomie ou traction élastique) sont dans la grande majorité des cas contre-indiqués au cours de la maladie de Crohn. Ce type de traitement se discute uniquement chez les malades ayant une fistule très superficielle en l’absence d’atteinte rectale associée.
Dans les autres cas, les gestes envisageables sont soit le drainage prolongé par séton lâche, soit des gestes de réparation visant à obturer le trajet fistuleux.
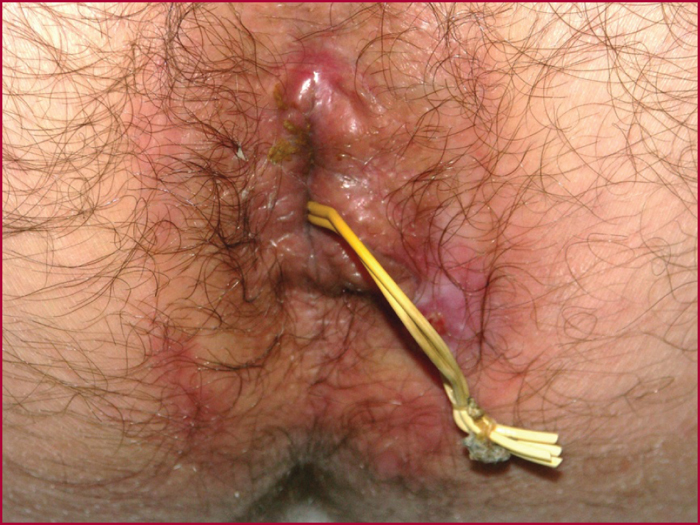
Le drainage prolongé par séton lâche (figure 2) consiste à introduire dans le trajet fistuleux un drain de nature variée (caoutchouc, nylon…). Ce drain n’est pas serré. Le but de ce traitement est de faire disparaître les phases de rétention purulente et d’abcès, de drainer la suppuration, ce qui peut permettre à la fistule de devenir quiescente avec une épidermisation de son trajet ou une fermeture à l’ablation du drainage. La durée de ce drainage n’est pas définie, elle peut être prolongée plusieurs mois ou années. Ce traitement est efficace, cependant des récidives d’abcès peuvent s’observer séton en place lorsque le drainage est insuffisant.
Le maintien prolongé d’un séton, même efficace, altère significativement la qualité de vie des malades et ce d’autant que la maladie luminale est par ailleurs en rémission. Plusieurs techniques sont proposées pour tenter d’obturer le trajet fistuleux. Quelle que soit la technique utilisée, deux conditions sont requises : la fistule doit être parfaitement drainée, non inflammatoire, sans collection résiduelle, l’atteinte rectale doit être contrôlée.
Le lambeau muqueux d’avancement, ou « flap » des Anglo-Saxons, consiste à confectionner avec la paroi rectale une sorte de volet de muqueuse plus ou moins épais secondairement abaissé comme un rideau et suturé sur l’orifice canalaire de la fistule. Dans la littérature, cette technique est efficace, parfois après plusieurs tentatives, dans 66 % des cas dans une revue de la littérature espagnole regroupant 135 patients dans des séries très hétérogènes [29]. La nécessité de réaliser au préalable une diversion fécale est discutée par certains auteurs sans consensus à ce sujet. L’existence d’une atteinte rectale est un facteur majeur d’échec de la méthode qui est techniquement impossible à réaliser en présence d’une sténose rectale. Des effets délétères sur la continence sont rapportés dans 8 à 35 % des cas, peut-être en rapport avec l’utilisation d’écarteurs anaux de type Parks ou des lésions du sphincter interne.
L’injection de colle de fibrine (une colle biologique préparée avec de la fibrine d’origine humaine et de la thrombine d’origine bovine) au niveau du trajet fistuleux est un geste simple sans risque pour la continence. Sous anesthésie générale ou locorégionale, le ou les séton(s) sont retirés, le ou les trajet(s) fistuleux sont curetés afin d’aviver leurs parois, puis la colle est injectée de façon rétrograde (de l’orifice primaire vers l’orifice secondaire) après cathétérisme du trajet fistuleux par un cathéter relié au dispositif à double seringue contenant la colle. Au contact des parois du trajet fistuleux, la colle de fibrine entraîne la formation d’un caillot qui stimule la migration, la prolifération et l’activation des fibroblastes et leur sert de matrice ainsi qu’aux cellules endothéliales pluripotentes. Le caillot se lyse en 7 à 14 jours et la synthèse de collagène induite par les fibroblastes permet la cicatrisation de la fistule.
L’efficacité de ce traitement est modeste, elle a été évaluée dans un essai contrôlé du GETAID [30] : à huit semaines, 38 % des malades traités par colle avaient une fistule fermée versus 16 % dans le groupe témoin avec une efficacité meilleure de la colle pour les fistules simples (50 % de fermeture versus 25 %). Cette efficacité apparente ne se maintenait pas dans le temps, puisqu’après un suivi de 16 semaines, 6 à 11 % des malades seulement gardaient un bon résultat.
Le plug est un bouchon conique de biocollagène proposé pour obturer les trajets fistuleux. L’obturateur est mis en place sous anesthésie générale ou locorégionale et suturé fermement au canal anal. Malheureusement l’efficacité de ce dispositif n’a pas été démontrée par un essai randomisé du GETAID avec 33 % de fermeture versus 23 % dans le groupe placebo [31].
L’injection autour du trajet fistuleux d’une suspension de cellules souches mésenchymateuses allogéniques a également fait l’objet d’un essai contrôlé randomisé. Tous les malades avaient également une fermeture chirurgicale simple de l’orifice primaire [32]. Malgré une réponse sous placebo élevée (plus d’un tiers des patients), il existait une différence significative en faveur des cellules souches avec un bénéfice supplémentaire de 20 %. Cette différence persistait que les malades aient été ou non sous combothérapie au moment du traitement. Le temps médian de rémission clinique était de sept semaines après injection de cellules souches contre quinze semaines sous placebo. Ce bon résultat se maintenait dans le temps (suivi à un et deux ans) mais les paramètres IRM n’étaient pas significativement modifiés.
D’autres types de réparations sont proposés : LIFT (Ligation of Intersphincteric Fistula Tract), laser, radiofréquence, aucune donnée de bon niveau de preuve les concernant n’est disponible.
Dans certains cas sévères, retentissant de façon importante sur la qualité de vie, une stomie temporaire visant à dériver les matières fécales pour permettre un assèchement et une cicatrisation des lésions est proposée. Ce traitement seul est le plus souvent inefficace à long terme : le rétablissement de continuité n’étant que rarement possible. Il s’agit souvent d’un prélude à la proctectomie avec iléostomie définitive, traitement de dernier recours indiqué en cas d’incontinence massive avec écoulements persistants et douleurs chroniques. Les données scientifiques concernant le recours à ce type de chirurgie sont malheureusement anciennes, datant d’avant l’ère des biothérapies. La fistulotomie doit être proscrite pour les fistules de la maladie de Crohn. Le drainage par séton est l’étape préalable à tout traitement conservateur d’obturation. Les stratégies d’épargne sphinctérienne sont décevantes : l’injection de cellules souches allogéniques paraît aujourd’hui être la méthode la plus prometteuse
Traitement chirurgical des fissures et ulcérations
Le traitement de ce type de LAP est en règle médical. Exceptionnellement, lorsque la maladie de Crohn est quiescente et associée à une fissure anale douloureuse banale résistant à tous les traitements médicaux, on peut être amené à proposer un traitement chirurgical. Il faut alors proscrire la réalisation d’une sphinctérotomie interne et proposer une fissurectomie simple, non délétère pour la continence mais pouvant se compliquer d’un retard de cicatrisation.
Traitement chirurgical des sténoses
De survenue tardive dans l’évolution de la maladie, elles restent longtemps peu ou pas symptomatiques en raison de la diarrhée dont souffrent les patients. Elles peuvent être associées à d’autres types de LAP. Elles ne nécessitent un traitement que lorsqu’elles ont des manifestations cliniques. Une dilatation au doigt, à la bougie ou à l’aide d’un ballonnet pneumatique est alors le traitement de première intention. Ce traitement nécessite le plus souvent une brève anesthésie. Les séances peuvent être répétées en cas de récidive. Des complications sont possibles notamment à type de suppuration. La survenue d’une sténose symptomatique paraît être un facteur péjoratif de la maladie, surtout s’il existe une rectite associée. L’existence d’une sténose doit toujours alerter et faire évoquer les complications néoplasiques de la maladie [5].
Conclusion
Les lésions anopérinéales sont fréquentes au cours de l’histoire naturelle de la maladie de Crohn puisque près d’un malade sur deux sera un jour ou l’autre concerné. Ces lésions peuvent constituer un réel handicap pour les patients et altérer leur qualité de vie. Le traitement des suppurations anopérinéales est souvent difficile, les récidives sont fréquentes en dépit des progrès thérapeutiques réalisés (immunosuppresseurs, bithérapies...). La collaboration entre le proctologue interventionnel ou le chirurgien et le gastroentérologue reste essentielle dans la prise en charge de ces patients.
Liens d’intérêts
l’auteur déclare n’avoir aucun lien d’intérêt en rapport avec l’article.Take home messages
![]() This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License
This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License