Hépato-Gastro & Oncologie Digestive
MENUImmune checkpoint inhibitors-induced hepatitis: Not so rare. Liver biopsy is useful to diagnostic and therapeutic management Volume 26, issue 2, Février 2019
Introduction
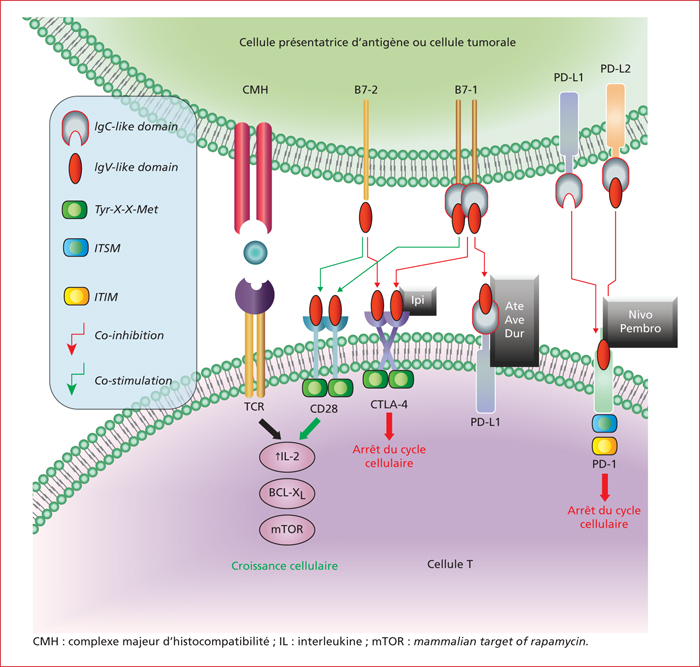
Après plus d’un demi-siècle de tâtonnements, la découverte des inhibiteurs de points de contrôle immunitaire (IPCI) a prouvé le concept d’immunothérapie anti-cancéreuse [1]. Parmi les anticorps monoclonaux actuellement disponibles, l’ipilumimab est un anticorps dirigé contre l’antigène 4 cytotoxique des lymphocytes T tueurs (CTLA-4) (récepteur découvert en France en 1987 par Pierre Golstein), les autres ciblent la molécule PD-1 (pour Programmed cell-Death 1 protein) ou le récepteur de PD-1 (PD-L1 ou PD-L2) (figure 1)[2]. Les ICPI sont diversement indiqués dans le traitement des mélanomes, des cancers bronchiques non à petites cellules, de la maladie de Hodgkin, des carcinomes épidermoïdes ORL, des carcinomes urothéliaux, des cancers du côlon avec instabilité microsatellite, et sont à l’étude dans de nombreuses tumeurs dont le carcinome hépatocellulaire. La stimulation de l’immunité antitumorale s’accompagne de l’apparition de maladies immuno-médiées
Si tous les ICPI augmentent la destruction lymphocytaire des cellules tumorales, leurs mécanismes d’action sont différents. CTLA-4 inhibe l’activation des cellules T à un stade précoce de la réponse immune, alors que PD-1 l’inhibe à des stades plus tardifs dans les tissus périphériques. Comme on pouvait s’y attendre, les ICPI ont des effets indésirables très variés d’ordre immunologique (tableau 1), atteignant le plus souvent le tube digestif, les glandes endocrines, la peau et le foie, et moins souvent le système nerveux, le cœur et les vaisseaux, les muscles et le squelette et le sang [3]. Le profil est différent selon qu’il s’agit d’anti-CTLA-4 ou d’anti- PD1/PD-L1 ; par exemple colites, hypophysites et éruptions sont plus fréquents avec les anti-CTLA-4, et pneumonies et thyroïdites avec les anti-PD1 [4]. Les complications sont différentes en fonction du mécanisme d’action
Quant aux souris génétiquement déficientes en CTRL4-A4, elles développent des lymphomes, alors que celles déficientes en PD-1 développent des maladies auto-immunes… [3].
Les atteintes hépatiques sont très fréquentes, mais le plus souvent minimes (grade I ou II de la classification CTACE habituellement utilisée en oncologie). Les hépatites de grade ≥ III sont en revanche plus rares et n’ont pas fait l’objet d’études systématiques. C’est tout l’intérêt de la série rapportée par l’équipe de Paul Brousse.
L’étude
Le recrutement des malades
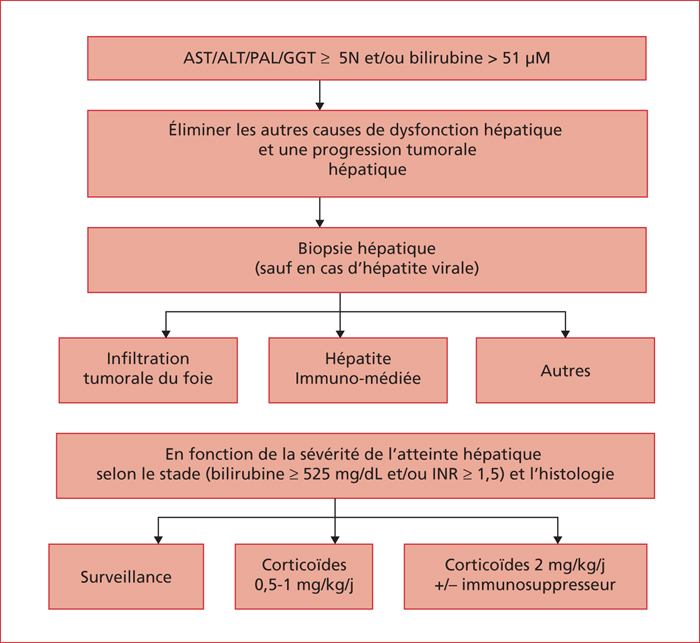
Parmi 536 malades traités entre août 2015 et avril 2017 à l’institut Gustave Roussy, où une pharmacovigilance prospective des IPCI avait été mise en place, 19 eurent des anomalies biologiques hépatiques de grade ≥ 3 (ALT et/ou AST > 5N, et/ou GGT et/ou PAL > 5N, bilirubine > 51 μM ; CTACE, NCI, v4.03). Trois patients furent exclus de cette étude (1 hépatite aiguë E, 1 pour infiltration tumorale du foie, 1 n’ayant pas eu de biopsie du fait de métastases hépatiques étendues).
Sur les 16 autres malades (3 %), 9 étaient traités par anti-PD-1/PD-L1, et 7 recevaient un anti-CTLA4 (3 en monothérapie, et 4 en association avec du nivolumab [anti-PD-1]).
Clinique
Il s’agissait de 9 femmes et 7 hommes, âgés de 33-84 ans (63 en moyenne) dont deux avaient des métastases hépatiques. La responsabilité des IPCI fut jugée très probable chez 14 patients, et probable chez 2 selon les critères RUCAM (Roussel-Uclaf Causality Assessment Method), les autres causes d’hépatite ayant été éliminées et aucun autre médicament hépatotoxique n’ayant été administré.
Cinq patients avaient déjà reçu des IPCI (3 ayant une hépatite sous anti-CTLA-4 avaient été traités 4 semaines plus tôt par anti-PD-1, et 2 traités par nivolumab ou pembrolizumab avaient préalablement reçu un anti-CTLA A4 (ipilumimab).
L’hépatite survint après un délai médian de 5 semaines (1-49), après l’administration médiane de 2 doses (1-36). Il y eut de la fièvre chez 6 (38 %) malades, une éruption chez 5 (31 %), seuls 5 patients restant cliniquement asymptomatiques. D’autres complications auto-immunes avaient été observées chez 6 (38 %) malades : une pneumonie granulomateuse, une hypophysite, deux hyperthyroïdies, deux pancréatites et une bronchite, mais pas d’hépatite.
Biologie
Le pic d’ALAT médian fut de 8,5 fois (5-57) la limite supérieure de la normale (N), le pic d’ASAT médian de 8N (8-42), celui des PAL de 3 N (0,5-8), celui de la GGT de 7N (0,7-28) et de 18 μM (6-324) pour la bilirubine ; le profil enzymatique était plutôt mixte au début, et hépatocellulaire à la phase d’état. Un seul malade eut un TP diminué sans abaissement du facteur V. Des anticorps antinucléaires d’aspect moucheté étaient présents chez 7 malades à un titre faible (1/80), des anticorps anti-muscle lisse chez 3 (1/80) sans spécificité anti-actine, les autres auto-anticorps étaient absents. Les IgG médianes étaient normales (9 g/L). Les sérologies virales A,B,C et E étaient négatives, de même que les recherches de virémie à CMV, HHV, VHE, HSV 1 et 2 ; la recherche d’ADN du virus EB était faiblement positive chez 2 patients.
La biopsie hépatique
Faite 2 à 5 jours après le début de l’augmentation des transaminases, elle montrait dans tous les cas un infiltrat inflammatoire fait de lymphocytes et d’histiocytes activés avec très peu ou pas de plasmocytes, à la fois portal, périportal et lobulaire chez tous les malades sauf un. Une fibrose portale minime était observée dans la moitié des cas. Des lésions canalaires biliaires étaient présentes chez plus de la moitié des malades.
Comparaison selon le traitement IPCI reçu
Les malades recevant des anti-PD-1/PD-L1 seuls ou associés à un anti-CTLA-4 eurent une hépatite plus tardive (délai médian 14 semaines) que ceux recevant un anti-CTLA-4 seul, ces derniers ayant presque toujours de la fièvre ; les profils biochimiques hépatiques étaient similaires. Histologiquement, 5 des 7 malades ayant reçu un anti-CTLA-4 seul avaient une hépatite granulomateuse avec des dépôts de fibrine (en anneau autour d’une vacuole lipidique chez 2 [fibrin-ring granuloma]) et une activité nécroticoinflammatoire lobulaire sévère (avec un infiltrat lymphoïde majoritairement fait de CD8+) ; tous avaient une endothélite des veines centrolobulaires. En revanche, les malades recevant un anti-PD-1/PD-L1 avaient des aspects plus divers, sans macrogranulome, avec une inflammation moins intense, et faite de CD4+ et de CD8+ à parts égales. Des hépatites granulomateuses et des endothélites sont notées sous anti-CTLA-A4
Prise en charge et évolution
Le traitement par IPCI fut arrêté chez tous les malades.
Six malades ne reçurent pas de corticothérapie et guérirent (1 après un anti-CTLA-A4, et 5 après anti-PD-1 ; trois d’entre eux furent retraités par un anti-PD-1 dont un mourut de progression tumorale, un eut une ré-élévation transitoire et minime des enzymes hépatiques, et le troisième aucun incident. La corticothérapie n’est pas nécessaire pour tous
Chez 2 malades qui recevaient un corticoïde (0,5 mg/kg/j) avant l’hépatite, ce traitement fut simplement continué avec une évolution favorable.
Chez 7 malades (dont 3 avaient une bilirubinémie ≥ 42 μM, et tous sauf un des lésions sévères), une corticothérapie fut instituée (0,5 mg/kg chez 2 et 1 mg/kg chez 5). Tous évoluèrent favorablement, mais aucun ne reçut de nouveau traitement par IPCI.
Enfin un malade qui avait des lésions sévères reçut une corticothérapie à forte dose en bolus intraveineux puis par 2,5 mg/kg/j associée à du mycophénolate mofétil ; la corticothérapie fut maintenue 1 an à faible dose, avec une rémission biologique complète ; il n’eut pas de nouveau traitement par IPCI.
Un des malades traités par corticothérapie eut une récidive des anomalies biologiques hépatiques après le sevrage, spontanément résolutives, et attribuées à un effet prolongé du traitement par ICPI.
Commentaires
Cette série est très utile : grâce au programme de pharmacovigilance prospective mis en place à l’Institut Gustave Roussy, et à l’homogénéité de la prise en charge de l’équipe de Paul Brousse, la qualité de la documentation atteint des sommets peu égalés en matière de pharmacovigilance hépatologique !
On voit donc qu’une hépatite aiguë de grade ≥ 3 selon la gradation du CTCAE complique 3,5 % des traitements par ICPI utilisés dans le traitement de cancers métastatiques. Des hépatites surviennent dans 3,5 % des traitements par IPCI
Aucun test diagnostique spécifique n’étant disponible, un bilan étiologique complet doit éliminer les autres causes (ici, 1 cas d’hépatite aiguë E s’était glissé dans le groupe).
Trois des malades de cette série avaient reçu un anti-PD1 avant un anti-CTLA-A4 ; il avait déjà été observé que la succession anti-PD-1-anti-CTLA-A4 provoquait plus d’accidents (et plus sévères) que l’ordre inverse, et aussi que l’association d’ipilumimab et de nivolumab comportait un risque plus élevé d’hépatites sévères. Attention à la succession anti-PD-1-anti-CTLA-A4
Enfin, les hépatites après anti-CTLA-A4 avaient souvent l’aspect histologique particulier d’une hépatite granulomateuse intense avec dépôts de fibrine et endothélite (des lésions granulomateuses pseudo-sarcoïdiennes ont été décrites dans divers organes sous traitement par ipilumimab).
Les lésions de ces hépatites et le profil biologique sont originales et clairement différentes de celles observées dans les hépatites auto-immunes (absence de plasmocytes, d’hépatite sévère d’interface, de nécrose parcellaire et de rosettes hépatocytaires, aspect granulomateux, absence d’auto-anticorps spécifiques et d’augmentation des IgG), invitant à garder pour ces seules dernières le qualificatif d’auto-immunes. Les hépatites immuno-médiées sont différentes des hépatites auto-immunes
Comme toutes les hépatites cytolytiques ou mixtes, elles comportent un risque (probablement compris entre 0,1 et 0,5 % des malades traités) d’hépatite fulminante potentiellement mortelle [5] sans recours possible à la transplantation hépatique en raison du contexte de cancer métastatique. Dans une revue systématique récente, l’atteinte hépatique était responsable de 20 % des décès par maladie immunitaire secondaire au traitement par IPCI, après l’atteinte intestinale (37 %) et pulmonaire (23 %), l’atteinte myocardique (rare) ayant la plus forte létalité [6]. Une hépatite fulminante mortelle est possible
Cette étude montre également que, contrairement aux recommandations du CTCAE, tous les malades ayant une hépatite de grade ≥ 3 n’ont pas besoin de corticothérapie pour guérir (seulement 62 % dans ce travail), à condition de suivre rigoureusement l’algorithme proposé par les auteurs (figure 2). À l’inverse, chez les malades ne répondant pas à une dose élevée de corticoïdes, il est nécessaire d’ajouter rapidement un immunosuppresseur, voire en cas d’échec des globulines anti-thymocytes. Des échanges plasmatiques (qui augmentent les lymphocytes T-régulateurs, et pourraient accélérer l’élimination de l’ipilumimab) ont été effectués avec succès chez une malade ayant développé une hépatite fulminante 5 semaines après le début d’un traitement par anti-CTLA-A4 succédant à l’échec d’un premier traitement par anti-PD-1 qui avait été responsable d’une hépatite de grade 2 résolutive) [7]. Une immunosuppression profonde est parfois nécessaire
Dans une lettre de réponse, les auteurs abordent également le sujet du traitement par IPCI (notamment pour carcinome hépatocellulaire) chez les malades atteints d’hépatopathies chroniques [8] ; l’incidence des hépatites de grade ≥ 3 pourrait y être plus élevée et l’effet d’une cytolyse en cas de cirrhose préexistante sans doute plus morbide ; des travaux ultérieurs sur ce sujet sont indispensables aux hépatologues et aux oncologues. Hépatologues, n’oubliez pas le tube !
C’est beau le progrès, et ça crée toujours de nouveaux problèmes ! Pour ceux d’entre nous qui restent (ou essaient de rester) d’indécrottables hépato-gastroentérologues, lisez aussi l’excellente revue française (un cocorico de plus) sur les atteintes intestinales observées après ICPI [9].
Remerciements
au Pr Didier Samuel pour sa relecture amicale.
Liens d’intérêts
l’auteur est consultant et orateur occasionnel pour les laboratoires Intercept et Mayoly-Spindler.
![]() This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License
This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License