Hépato-Gastro & Oncologie Digestive
MENUUseful management of the liver transplant recipient Volume 25, issue 4, Avril 2018
Introduction
Le nombre de greffes hépatiques réalisées en France augmente chaque année (1 322 en 2016) et l’activité cumulée de transplantation hépatique (TH) depuis 1998 est de 26 114 interventions. Au 31 décembre 2016, 13 194 patients avec un greffon hépatique fonctionnel ont été recensés. Le carcinome hépatocellulaire et la cirrhose alcoolique sont les 2 principales indications de TH (respectivement 31,5 % et 24,5 % des nouveaux inscrits) [1]. La survie du patient à court terme en post-transplantation hépatique est excellente : 93,5 % à 1 mois et 84,9 % à 1 an. Ces bons résultats sont liés à une amélioration des techniques chirurgicales d’une part et à une meilleure optimisation de l’immunosuppression d’autre part. Cependant, la survie du patient à moyen et long terme est moins satisfaisante, passant de 73,3 % à 5 ans et 62,4 % à 10 ans. Les complications en lien avec le greffon (récidive de la maladie initiale, thrombose de l’artère hépatique, rejet chronique), les complications cardiovasculaires (principalement liées au syndrome métabolique), les infections, l’insuffisance rénale chronique et la survenue de cancer de novo impactent la survie du greffon et du receveur après la première année [2]. La prévention, le dépistage et la prise en charge de ces complications médicales et chirurgicales sont primordiaux pour maintenir un greffon fonctionnel chez un patient bien portant. Un suivi régulier est indispensable et celui-ci doit être connu de tout praticien prenant en charge ces patients. Devant le nombre croissant de TH, rares seront les spécialistes libéraux ou travaillant en centre hospitalier non-greffeur qui n’auront pas à prendre en charge à un moment donné un patient transplanté du foie. L’objectif de cette mini-revue est de faire le point sur les complications pouvant survenir après TH et de proposer une prise en charge standardisée pour optimiser le suivi ou améliorer la survie. Le nombre de greffes hépatiques augmente et 13 194 patients avec un greffon hépatique fonctionnel sont recensés en France
Les complications les plus fréquentes après transplantation hépatique
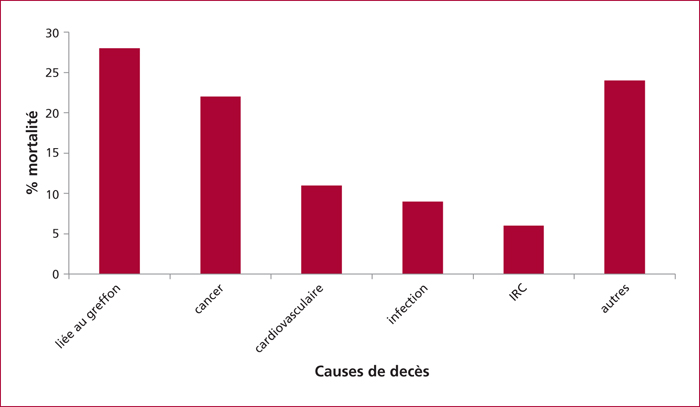
Les dysfonctions du greffon liées à un rejet chronique cellulaire ou humoral, une thrombose tardive de l’artère ou une récidive de la maladie initiale (hépatite auto-immune, cholangite sclérosante primitive, cholangite biliaire primitive, VHC, VHB), l’insuffisance rénale chronique, les complications tumorales (cancer de novo ou récidive), cardiovasculaires et infectieuses sont les causes majeures de décès post-TH dès la première année [2]. La figure 1 représente les causes de décès dès 1 an post-TH sur un suivi médian de 10 ans.
Le rejet
L’utilisation de la ciclosporine au début des années 1980, a permis le développement de la transplantation d’organe solide en réduisant l’incidence du rejet aigu, du rejet réfractaire et du rejet chronique. Le schéma d’immunosuppression le plus utilisé actuellement en transplantation hépatique est l’association d’une anticalcineurine (tacrolimus, ciclosporine) avec un agent antiprolifératif (mycophenolate mofetil, inhibiteur de mTOR) et des corticoïdes [3, 4]. Ces traitements sont utilisés en association pour potentialiser leur effet immunosuppresseur en inhibant simultanément plusieurs voies mais aussi pour pouvoir les utiliser à plus faible dose pour diminuer leur toxicité spécifique respective. L’association d’immunosuppresseurs permet une potentialisation des effets et une diminution de leurs posologies
Le rejet aigu cellulaire reste l’apanage des complications précoces (principalement dans les 3 premiers mois post-TH). Néanmoins, la minimisation de l’immunosuppression au long cours voir l’arrêt inopiné de tout traitement antirejet à distance de la TH peut induire un rejet aigu. Il faut donc l’évoquer devant toute perturbation du bilan hépatique, et ce d’autant que le niveau d’immunosuppression est bas. Le diagnostic de rejet aigu et l’évaluation de son intensité sont histologiques (score de BANFF : évaluation semi-quantitative des 3 lésions histologiques cibles pour grader la sévérité). Le traitement du rejet aigu n’est nécessaire qu’à partir du stade de rejet modéré (BANFF > 6) [5]. Les rejets minimes régressent en général spontanémenttandis que le renforcement des doses de tacrolimus ou l’administration de bolus de corticoïdes (500 mg à 1 g) sont nécessaires dès l’apparition d’un rejet modéré. La plupart des rejets aigus traités précocement évoluent favorablement. La récidive d’épisodes de rejet aigu et sa résistance aux traitements sont une cause rare de perte du greffon. Il faut évoquer la possibilité d’un rejet devant toute perturbation du bilan hépatique Le diagnostic de rejet aigu et l’évaluation de son intensité sont histologiques
Le rejet chronique quant à lui est une entité mal définie qui se traduit par la destruction à bas bruit du greffon après quelques mois ou années. La filiation rejet aigu-rejet chronique n’est pas constante. Le diagnostic est également histologique, la biopsie hépatique met en évidence une fibrose, une endartérite spumeuse des artérioles de moyen calibre et une raréfaction des canaux biliaires. Le traitement est alors la retransplantation. L’immunité humorale semble également impliquée dans des lésions plus tardives du greffon hépatique. Le rejet humoral chronique est défini par une dégradation progressive de la fonction du greffon, des signes histologiques caractéristiques, la positivité du C4d et l’apparition d’anticorps anti-HLA spécifiques du donneur (DSA) [6]. Les facteurs liés au développement d’un rejet humoral sont l’âge du receveur (< 50 ans), la non adhérence thérapeutique, la retransplantation, un épisode de rejet aigu cellulaire. La minimisation de l’immunosuppression favorise l’émergence de DSA.
La thrombose de l’artère hépatique
La thrombose de l’artère hépatique (AH) peut survenir dans les sept premiers jours post-transplantation hépatique et représente une indication de retransplantation en super-urgence (ischémie du greffon, complications infectieuses). Mais elle peut également apparaître plus tardivement et être révélée par les complications biliaires (sténose, cholangite ischémique avec angiocholite). La mortalité globale est alors évaluée à 40-50 %. Il existe alors une indication de retransplantation si la thrombose est symptomatique (angiocholite à répétition, septicémie) avec un délai d’accès à la re-TH entre 0 et 3 mois. Les facteurs de risques connus de thrombose de l’AH sont le poids du donneur ou du receveur < 10 kg, l’existence d’une artère hépatique accessoire, une artère grêle < 3 mm, une réfection peropératoire de l’anastomose artérielle, la présence d’un ligament arqué au niveau du tronc cœliaque et le rejet aigu cellulaire. Certaines équipes proposent un traitement par antiagrégant plaquettaire à vie après la TH [7]. Les sténoses de l’artère sont fréquentes, survenant sur l’artère du donneur. Elles sont détectées à l’échographie doppler hépatique par une baisse des index de résistivité artérielle et confirmées par angioscanner hépatique. Leur prise en charge reste radiologique (angioplastie ± stenting) ou chirurgicale en cas d’échec. Un traitement par antiagrégant plaquettaire est alors préconisé. La thrombose de l’artère hépatique précoce ou symptomatique est une complication sévère qui conduit à discuter une re-transplantation
L’insuffisance rénale chronique
L’insuffisance rénale chronique (IRC) est une complication fréquente après la transplantation hépatique. Le schéma d’immunosuppression associant une anti-calcineurine et un agent anti-prolifératif permet de diminuer significativement la survenue d’une insuffisance rénale post-TH [8]. Dix ans après TH, 75 % des patients ont une IRC et 10 % une insuffisance rénale évoluée ou terminale [9]. L’existence d’une insuffisance rénale avant TH (y compris le syndrome hépatorénal), et en postopératoire : un surdosage en anti-calcineurine, la survenue d’un diabète et/ou d’une hypertension artérielle (HTA) sont des facteurs indépendants de survenue d’une IRC. La présence de ces facteurs incite à minimiser les doses d’anti-calcineurines, voire en interrompre leur administration sous couvert de l’introduction d’inhibiteur de mTOR (évérolimus)[10]. Ce traitement est également utilisé après la TH pour son action antitumorale car le cancer représente la principale cause de décès non liée au foie après TH. Dix ans après greffe hépatique, 75 % des patients ont une insuffisance rénale chronique et 10 % une insuffisance rénale évoluée ou terminale
Les complications tumorales
Le risque de cancer de novo est 2 à 4 fois plus important chez les patients greffés par rapport à la population générale[11]. Le risque de cancer est évalué à 3,5 % à 1 an, 12 % à 5 ans et est supérieur à 20 % à 10 ans. L’utilisation au long cours d’agents immunosuppresseurs, l’âge, l’alcool, le tabac, la cholangite sclérosante primitive sont les principaux facteurs de risque. Il s’agit de cancers cutanés (6 % à 5 ans, 11 % à 10 ans), de syndromes lymphoprolifératifs (2 % à 5 ans, 3,2 % à 10 ans), de cancer des voies aérodigestives supérieures ou pulmonaires chez les patients greffés pour cirrhose alcoolique et de cancers colorectaux (risque relatif [RR] = 1,6), surtout chez les patients greffés pour une cholangite sclérosante primitive [12]. L’évolution est plus rapide et la mortalité plus élevée pour un même cancer par rapport à la population générale. Le risque de cancer de novo est 2 à 4 fois plus important chez les patients greffés par rapport à la population générale
Les complications cardiovasculaires
L’infarctus du myocarde et les accidents vasculaires cérébraux (AVC) sont la 2e cause de décès post-transplantation hépatique non liée au foie. Le risque relatif de cardiopathie ischémique est multiplié par 3 et le risque relatif du décès de cause cardiovasculaire est multiplié par 2,5 par rapport à une population non greffée du même âge [13]. Vingt-cinq pour cent des patients greffés développent un événement cardiovasculaire majeur dans les 10 ans post-TH. Egalement, 50 % des patients développent un syndrome métabolique après la TH [14]. Le tableau 1 résume les complications du syndrome métabolique, leur incidence et les facteurs de risque. La prévalence du diabète après TH est de 30 à 40 % mais persiste à distance chez 30 % des greffés hépatiques. L’apparition d’un diabète après la TH (NODAT : new onset diabetes after transplantation) est associée à une diminution de la survie du greffon et du patient (thrombose artérielle, rejet aigu et chronique, NAFLD notamment) [15]. 25 % des patients greffés développent un événement cardiovasculaire majeur dans les 10 ans après greffe hépatique 50 % des patients développent un syndrome métabolique
Les complications infectieuses
Environ 50 % des greffés présentent une infection au cours de la première année. On distingue trois périodes [16] : 1) postopératoire immédiate (moins d’un mois) : dominée par les infections nosocomiales bactériennes et fungiques ; conséquences des techniques invasives de réanimation et de l’acte chirurgical lui-même, 2) entre un et six mois post-TH : infections opportunistes le plus souvent virales, à CMV essentiellement, mais aussi : EBV, HSV, légionnelle, Aspergillus, Pneumocystis, 3) après six mois : il s’agit d’infections communautaires.
Les complications biliaires et veineuses
Les complications biliaires (7 à 30 %) sont d’origine le plus souvent ischémique, il s’agit de sténose (dans 80 % des cas de siège anastomotique) et de fistule (bilome) dans deux tiers des cas et surviennent dans les 3 mois post-TH. La thrombose de la veine porte est plus rare (0,3 à 2,2 %) et souvent diagnostiquée en postopératoire immédiat. La sténose porte est souvent révélée plus tardivement par une hypertension portale avec ascite et nécessite une prise en charge radiologique avec angioplastie portale si la sténose est supérieure à 90 % ou symptomatique.
Comment dépister et prévenir ces complications ?
L’équipe en charge de la transplantation hépatique doit fonctionner en étroite collaboration avec l’équipe d’hépatologie qui a adressé le patient à la TH (centre adresseur) et le médecin traitant. Ce réseau médical est indispensable pour le dépistage et la prévention des complications sus citées. Les consultations se font volontiers en alternance entre le centre greffeur, le centre adresseur et le médecin traitant. Le suivi du patient greffé doit être régulier selon un protocole défini par chaque équipe. Ces objectifs sont les suivants [17] : Un travail en réseau est indispensable pour dépister et prévenir les complications
Prévention/dépistage du rejet
Un dosage de la concentration sanguine en immunosuppresseur (tacrolémie ou évérolémie résiduelle, ciclosporinémie résiduelle ou 2 heures après la prise) couplé systématiquement à un dosage des enzymes hépatiques (ASAT, ALAT, GGt, PAL, bilirubine totale et conjuguée) est réalisé très régulièrement (> 3 fois par semaine) pendant l’hospitalisation post-TH puis une fois par semaine pendant 3 mois, puis selon le rythme prédéfini des consultations de suivi ou plus fréquemment si nécessaire.
Dépistage des complications vasculaires hépatiques (thrombose de l’artère)
Une surveillance étroite du greffon hépatique par écho-doppler hépatique systématique est nécessaire la première semaine (J1 et J7 voire quotidienne selon les équipes de TH) pour ne pas méconnaitre une thrombose de l’artère hépatique. Une imagerie en coupes est indispensable pour confirmer la complication. Au long cours, une surveillance annuelle du greffon hépatique par échographie et doppler est recommandée (dépistage de complication vasculaire et analyse du parenchyme hépatique).
Prévention/prise en charge de l’insuffisance rénale chronique
La gestion de l’HTA et du diabète prévient la dégradation de la fonction rénale. La surveillance régulière des taux résiduels des anticalcineurines (nephrotoxiques) est indispensable. Une minimisation des anticalcineurines associée à un agent antiprolifératif (inhibiteur de mTOR : évérolimus ou antimétabolite : mycophenolate mofetil) doit être proposée dès que le débit de filtration glomérulaire est < 60 mL/min. Une consultation avec un néphrologue est alors préconisée. La surveillance régulière des taux résiduels des anticalcineurines est indispensable
Un dépistage organisé des cancers
Un dépistage organisé des cancers permet de diagnostiquer un cancer de novo plus fréquemment (13 % vs. 5 % sans dépistage) et à un stade plus précoce [18, 19]. Il n’existe pas de recommandations consensuelles pour le dépistage des cancers spécifiquement chez le transplanté hépatique. Dans le cadre de notre pratique quotidienne de centre nous recommandons :
- –une consultation de dermatologie annuelle associée à des mesures protectrices d’expositions solaires et un traitement précoce de la kératose actinique ;
- –un dosage annuel de PSA dès 50 ans chez l’homme et un examen gynécologique annuel dès 20 ans chez la femme avec mammographie tous les 2 ans dès 40 ans ;
- –une coloscopie de dépistage dès 3 ans après la transplantation hépatique puis tous les 5 ans en l’absence d’anomalie. Chez les patients greffés pour une cholangite sclérosante primitive associée à une maladie inflammatoire de l’intestin : indication à une coloscopie annuelle avec coloration et biopsies à la recherche de dysplasie ;
- –un examen d’imagerie abdominale et pulmonaire annuelle ;
- –si le patient est greffé pour une maladie alcoolique du foie : examen ORL annuel, consultation d’addictologie et de tabacologie (si tabagisme actif) ;
- –en cas de transplantation hépatique pour CHC, un dosage AFP annuel peut être proposé.
Un dépistage organisé des cancers permet de diagnostiquer un cancer de novo plus fréquemment et à un stade plus précoce
Prise en charge du syndrome métabolique
L’encadré 1décrit la prise en charge des complications du syndrome métabolique. Il n’y a pas de recommandation dédiée au transplanté hépatique. Un suivi cardiologique doit être proposé devant des facteurs de risque cardiovasculaire. Une prise en charge diététique associée à une activité physique est indispensable. Une prise en charge diététique associée à une activité physique est indispensable
Prévention des complications infectieuses
Un traitement prophylactique pour le cytomégalovirus est recommandé en fonction du statut sérologique du receveur et du donneur (valganciclovir 900 mg/j pendant 3 à 6 mois si sérologies receveur CMV– et donneur CMV+). En cas de primo-infection CMV ou réactivation CMV symptomatique, un traitement par valganciclovir est préconisé ; il sera arrêté dès l’obtention de 2 PCR CMV négatives à 8 jours d’intervalle. Un traitement prophylactique de la pneumocystose est également recommandé (sulfaméthoxazole-triméthoprime adulte 1/j ou aérosols de pentamidine jusqu’à six mois post-transplantation hépatique). Une prophylaxie antifongique par échinocandine ou fluconazole pendant 3 à 6 semaines est proposée en fonction de la gravité du patient avant la TH (cirrhose grave ou hépatite fulminante, retransplantation hépatique ou traitement immunosuppressur antérieur, IRC), et per-opératoire (anastomose bilio-digestive, importants besoins transfusionnels per-opératoires, thrombose artérielle, reprise chirurgicale précoce). Un traitement prophylactique contre le cytomégalovirus est recommandé en fonction du statut sérologique du donneur et du receveur
Le calendrier vaccinal doit être à jour. Les vaccinations peuvent être réalisées six mois après la transplantation hépatique. Les vaccins vivants atténués sont formellement contre-indiqués. Les vaccinations antigrippale et antipneumococcique sont fortement recommandées. Les vaccinations antigrippale et antipneumococcique sont recommandées après transplantation hépatique
Ostéodensitométrie osseuse
Une ostéodensitométrie osseuse est recommandée tous les 2 à 3 ans, le traitement de l’ostéoporose est similaire à celui d’un patient non greffé.
Biopsie hépatique du greffon
Une biopsie hépatique du greffon est proposée dans certains centres systématiquement à 1 an, 5 ans et 10 ans pour ne pas méconnaître la récidive de la maladie initiale (maladie auto-immune, VHC notamment), une dysfonction de greffon (apparition de fibrose inexpliquée), un rejet humoral chronique [20]. Une recherche de DSA peut être réalisée annuellement.
Exemple de suivi au long cours du transplanté hépatique : l’expérience du centre de Rennes
Après une hospitalisation d’une quinzaine de jours en moyenne pour la greffe, le patient sera revu en consultation de « suite de greffe » selon un protocole défini. La figure 2 rapporte la fréquence de ces consultations ainsi que le suivi biologique et morphologique demandé préalablement à chacune de ces consultations. Avant sa sortie d’hospitalisation, le patient visite la consultation de suite de greffe. Cette visite correspond à une prise de contact avec l’équipe infirmière de suite de greffe qui prendra en charge le patient tout au long de son suivi. L’infirmière le reçoit seul, avec un proche ou avec d’autres greffés. C’est un temps d’information et d’échange sur la vie après la greffe, le déroulement du suivi, les complications potentielles et comment les prévenir. Un livret d’information leur est également remis reprenant ces différents points.
La consultation se déroule initialement « en séance ». Ceci signifie que le patient vient toute la journée. Il est pris en charge dès le matin par l’infirmière de suite de greffe qui réalise : a) un bilan initial clinique : pouls, tension artérielle, poids, température, SatO2, prise en compte des doléances depuis la dernière consultation, b) un bilan biologique avec dosage de l’antirejet, c) un temps d’information thérapeutique. L’infirmière prend contact avec le praticien si une anomalie clinique notable est détectée nécessitant une prise en charge médicale rapide (ex : désaturation, hyperthermie…). La consultation avec le médecin a lieu en début d’après-midi dès réception des résultats biologiques. Un examen morphologique peut également être programmé sur cette séance. Une prise en charge psychologique, diététicienne ou l’intervention de l’équipe mobile de nutrition ou de diabétologie peut également être proposée. Cette consultation hebdomadaire s’effectue dans le centre greffeur lors du suivi précoce (deux premiers mois après la greffe).
Secondairement, la consultation est dite « en externe ». Le patient arrive uniquement pour sa consultation avec un bilan biologique réalisé en ville, prescrit lors de sa dernière consultation. À six mois post-greffe puis une fois par an, il réalise le bilan morphologique complet sus-cité (échographie doppler hépatique, consultation en cardiologie, consultation en dermatologie, radiographie pulmonaire notamment). Les rendez-vous sont pris par le patient auprès de ses spécialistes. Les résultats de ces examens sont rapportés par le patient à la consultation. Il est rappelé lors de la consultation l’objectif de ce suivi (prévention, dépistage des complications). Une ponction biopsie hépatique est également proposée à titre systématique à 1 an, 5 ans et 10 ans post-TH associées à une élastométrie hépatique et un dosage de DSA.
Conclusion
Le suivi au long cours du patient transplanté hépatique est un travail d’équipe qui implique tous les acteurs de soins autour de la greffe. Une prise en charge standardisée permet d’optimiser ce suivi, de prévenir et dépister au mieux les complications médicales et chirurgicales post-TH impactant directement la survie dès la première année. Un dossier patient personnalisé et informatisé mis à disposition de tous les professionnels impliqués dans ce suivi permettrait une meilleure coordination des soins.Take home messages
Liens d’intérêts
les auteurs déclarent n’avoir aucun lien d’intérêt en rapport avec l’article.
![]() This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License
This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License