Hépato-Gastro & Oncologie Digestive
MENUEosinophilic colitis in adults Volume 25, issue 8, Octobre 2018
Introduction
La maladie digestive à éosinophiles est une affection rare, caractérisée par une infiltration anormale de la muqueuse du tube digestif par des polynucléaires éosinophiles (PNE). Elle peut être subdivisée en œsophagite, gastro-entérite et colite. La colite à éosinophiles (CE) peut être primitive, sans cause connue de l’infiltrat éosinophilique, ou secondaire à une cause identifiée. La colite à éosinophiles peut être primitive, sans cause connue de l’infiltrat éosinophilique, ou secondaire à une cause identifiée
La CE est une maladie relativement fréquente chez le nourrisson et l’enfant âgé de moins de deux ans, plus rare et moins étudiée chez l’adulte, seuls quelques cas isolés ou petites séries étant publiés. Dans une étude rétrospective épidémiologique de grande envergure menée aux États-Unis, l’incidence de la CE était de 3,7/100 000 habitants et celle de la CE primitive de 2,4/100 000 habitants [1]. La CE est certainement sous-estimée car mal connue malgré une incidence croissante probable au cours de ces dernières années.
Le diagnostic de CE pose actuellement deux problèmes majeurs que sont l’absence de consensus sur les taux physiologiques de polynucléaires éosinophiles (PNE) dans la muqueuse colique normale et sur les critères diagnostiques histologiques de la maladie.
De cause et de physiopathologie non encore complètement élucidées, le rôle des allergènes est indéniable, un contexte allergique pouvant être trouvé dans plus de trois quarts des cas.
Cet article détaille plus précisément les caractéristiques, la prise en charge diagnostique et thérapeutique de la CE chez l’adulte.
De la physiologie à la physiopathologie
Les PNE sont produits dans la moelle osseuse puis, après un bref passage dans la circulation sanguine, migrent dans les tissus, essentiellement au niveau des muqueuses. Ils jouent un rôle primordial dans la défense antiparasitaire, dans l’allergie et dans certaines maladies inflammatoires.Les PNE expriment de multiples granules cytoplasmiques contenant différents médiateurs dont certains sont cytotoxiques, tels que la protéine basique majeure, la protéine cationique de l’éosinophile, la neurotoxine de l’éosinophile, des enzymes hydrolytiques et la peroxydase.
L’origine du recrutement et de l’activation des PNE dans l’intestin était jusqu’à présent inconnue. Récemment, il a été montré une augmentation de la synthèse des interleukines 5 et 3 (IL-5, IL-3) et du granulocyte-macrophage colony-stimulating factor (GM-CSF) dans la muqueuse intestinale des patients avec gastro-entérite à éosinophiles, suggérant que ces cytokines contribuent à la chronicité de l’infiltrat tissulaire en PNE, leur migration vers le tube digestif étant contrôlée par l’éotaxine [2]. L’activation des PNE par des stimuli tissulaires non spécifiques, des allergènes ou des infections déclenche leur dégranulation avec action cytotoxique directe, sécrétion de cytokines inflammatoires et d’IgE, à l’origine des lésions digestives de la CE.
À l’état basal, les PNE se situent dans la lamina propria de l’ensemble du tube digestif, excepté au niveau de l’œsophage, et ne provoquent ni réaction inflammatoire ni dommage tissulaire. En dehors de toute condition pathologique, il n’y a pas de PNE dans l’œsophage normal. La présence des PNE s’observe au niveau de l’estomac et leur nombre augmente progressivement du jéjunum vers l’iléon, pour atteindre une valeur maximale au niveau de l’iléon terminal et du côlon droit. Dans la muqueuse colique normale, il est noté un gradient décroissant du taux de PNE du côlon droit vers le colon gauche. Cependant, il n’y a actuellement aucun consensus concernant les normes des taux physiologiques de PNE dans la muqueuse colique, ceux-ci variant d’un segment à l’autre, probablement en fonction de facteurs raciaux, individuels (âge), géographiques et environnementaux (variation saisonnière) [3, 4].Ainsi, les limites supérieures des taux physiologiques de PNE de la muqueuse colique droite varient suivant les auteurs de 20 à 55 PNE par champ à fort grossissement × 400 (HPF) [5-7], les auteurs s’accordant sur le taux moyen faible de PNE au niveau de la muqueuse rectale, de l’ordre de 8 à 10 PNE/HPF [5]. Dans la muqueuse colique normale, il est noté un gradient décroissant du taux de polynucléaires éosinophiles du côlon droit vers le côlon gauche. Il n’y a actuellement aucun consensus concernant les normes des taux physiologiques de polynucléaires éosinophiles dans la muqueuse colique
De nombreux arguments sont en faveur d’une origine allergique de la maladie, 75 % des malades avec une CE ayant un terrain allergique ou atopique [8] et les protéines de lait de vache et de soja étant les principaux aliments impliqués dans les CE de l’enfant.
L’hypersensibilité à un allergène alimentaire, plus fréquemment identifié chez l’enfant que chez l’adulte, peut être à l’origine d’une réaction allergique IgE-médiée, non IgE médiée ou intermédiaire. L’allergie IgE médiée peut être associée à une augmentation du taux des IgE totales et spécifiques dirigées contre certains aliments, se manifeste par des réactions allergiques apparaissant rapidement après l’ingestion de l’aliment responsable et pouvant toucher plusieurs organes (poumon, peau, tube digestif). Inversement, les réactions allergiques non IgE-médiées, plus fréquentes, sont à l’origine de réactions semi-retardées ou tardives touchant préférentiellement le tube digestif.
Classification des gastroentérites et des colites à éosinophiles
La symptomatologie clinique aspécifique dépend à la fois du segment du tube digestif atteint et de la profondeur de l’atteinte digestive. Ainsi, Klein et al.[9] ont proposé en 1970 une classification en fonction de l’infiltration éosinophilique de la paroi digestive permettant de distinguer les infiltrations à prédominance muqueuse, musculeuse et séreuse (tableau 1). Cette classification permet une bonne corrélation entre les symptômes et les constatations pathologiques ; ainsi, l’atteinte muqueuse peut se manifester par des douleurs abdominales, une diarrhée, des saignements voir une anémie, une malabsorption et une entéropathie exsudative. L’atteinte transmurale se traduit généralement par des tableaux occlusifs ou subocclusifs, peut être à l’origine de volvulus, d’invagination, de perforation. Enfin, l’atteinte séreuse peut se révéler par une ascite riche en éosinophiles.
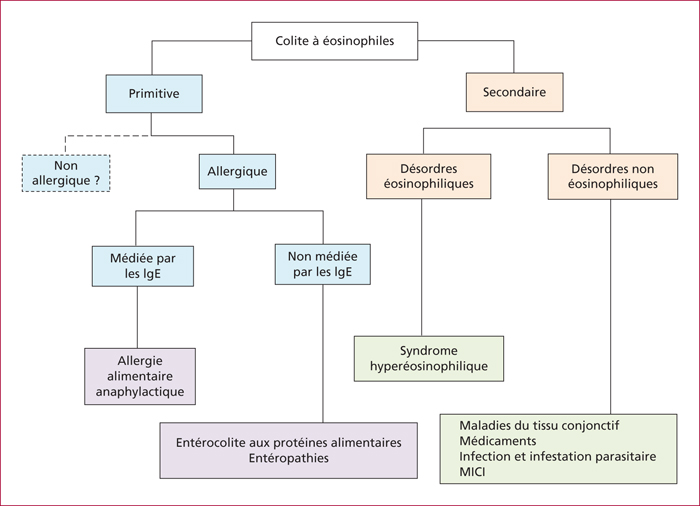
Les CE correspondent généralement à une infiltration de la muqueuse et peuvent être classées comme primitives ou secondaires (figure 1). Les CE primitives sont en rapport, dans la majorité des cas avec une réaction allergique, soit médiée par les IgE et à l’origine d’allergie alimentaire de type anaphylactique, soit non médiée par les IgE et à l’origine d’entéropathie alimentaire. Les CE secondaires peuvent résulter, soit d’un désordre éosinophilique tel que le syndrome hyperéosinophilique, soit de maladies non liées à un désordre éosinophilique telles que les maladies inflammatoires intestinales, les infections parasitaires, certains médicaments et maladies de système (tableau 2). Les colites à éosinophiles primitives sont liées dans la majorité des cas à une réaction allergique alors que les colites à éosinophiles secondaires peuvent résulter soit d’un désordre éosinophilique (syndrome hyperéosinophilique), soit de maladies non liées à un désordre éosinophilique
Diagnostic des colites à éosinophiles
En l’absence de méthode diagnostique de référence, le diagnostic de CE est évoqué devant un faisceau d’arguments cliniques, biologiques, endoscopiques et histologiques.
Clinique
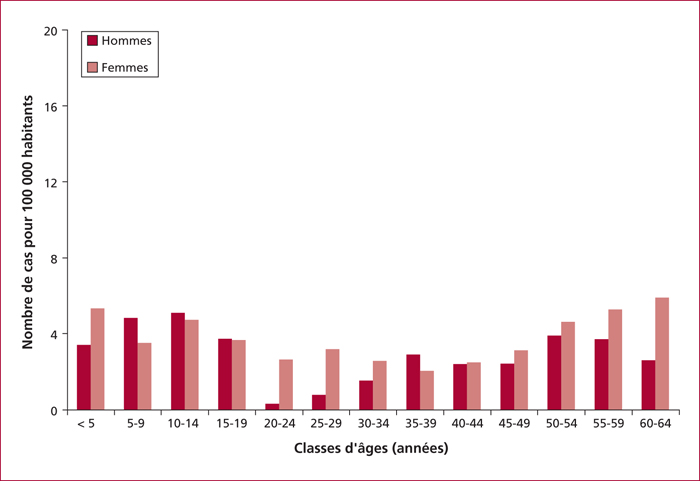
Bien qu’inconstante, une légère prédominance féminine est trouvée dans la plupart des études en cas de CE primitives et secondaires. Dans la population adulte, l’âge moyen au diagnostic est variable suivant les séries, variant de 33 ans dans une étude épidémiologique américaine [1] (figure 2) à près de 50 ans dans des travaux espagnol et maltais [10, 11]. Diaz del Arco et al.[10]ont montré dans une série rétrospective de 106 malades avec CE, que l’âge moyen au diagnostic était significativement plus bas en cas de CE primitive qu’en cas de CE secondaire, respectivement 22 et 84 ans.La prévalence de la CE en fonction de l’âge rapportée dans une étude épidémiologique nord-américaine est représentée dans la [1]figure 2.
La symptomatologie est variable et non spécifique, souvent intermittente et entrecoupée de périodes de rémission. La diarrhée est le signe le plus fréquent, présent dans plus de 60 % des cas, les rectorragies n’étant trouvées que dans 10 à 20 % des cas suivants les études. Les douleurs abdominales sont également fréquentes, notées dans 60 à plus de 80 % des cas. Les nausées et vomissements peuvent être notés dans près de 30 % des cas. Une perte de poids minime est possible, une véritable altération de l’état général étant exceptionnelle [1]. La symptomatologie est variable et non spécifique, souvent intermittente et entrecoupée de périodes de rémission
Aucune donnée de la littérature ne permet de comparer la symptomatologie des CE primitives et secondaires. Cependant, les résultats d’une série rétrospective personnelle non publiée ayant analysé 11 malades avec CE secondaire et 26 avec CE primitive ont montré une même prévalence de la diarrhée dans les 2 groupes (77 % en cas CE primitive versus 70 % en cas de CE secondaire), une plus grande fréquence des douleurs abdominales en cas de CE secondaire (80 % versus 54 %) et des douleurs abdominales isolées, sans diarrhée, significativement plus fréquentes en cas de CE secondaire (40 % versus 12 %).
Un contexte allergique personnel ou familial est noté chez 30 % à 75 % des adultes ayant une CE [8, 12], les antécédents allergiques étant significativement plus fréquents en cas de CE primitive (41 %) qu’en cas de CE secondaire (10 %) (série personnelle).
Les affections allergiques le plus souvent associées à la CE sont la rhinite, l’eczéma et l’asthme associés respectivement chez 30 à 39 %, 25 à 30 % et 15 à 20 % des malades avec CE [1, 11]. Bien que chez l’enfant, une allergie alimentaire soit identifiée dans plus de 60 % des cas [13], les protéines du lait de vache et de soja étant le plus souvent incriminées, les données de la littérature concernant les adultes sont moins claires, l’identification du ou des allergènes alimentaires responsables étant plus difficile. Un contexte allergique personnel ou familial est noté chez 30 % à 75 % des adultes ayant une colite à éosinophiles
Biologie
Les examens biologiques sont d’intérêt limité en raison de leur faible sensibilité et spécificité. L’hyperéosinophilie sanguine est un marqueur biologique permettant d’orienter le diagnostic en association avec d’autres facteurs. L’hyperéosinophile sanguine n’est pas constante, parfois transitoire, présente chez 27 % à 75 % des malades avec CE, plus fréquente et plus intense en cas de CE primitive [10]. Une augmentation du taux de PNE fécaux, rarement cherchée, peut également être notée. Les examens biologiques sont d’intérêt limité en raison de leur faible sensibilité et spécificité
Chez l’adulte, l’augmentation du taux sérique d’IgE totales est également inconstante et la recherche d’anticorps spécifiques de l’allergène mis en cause est presque toujours négative, de même que celle des IgE spécifiques de certains aliments.
Il existe deux types de tests cutanés à différents allergènes : le prick-test qui consiste en l’injection intradermique de l’allergène qui, en cas de positivité, est en faveur d’une réaction allergique semi-retardée ou tardive et l’atopy patch-test qui permet le diagnostic d’allergie alimentaire non IgE-médiée. Le prick-test a une bonne valeur prédictive négative, un test négatif permettant d’écarter raisonnablement le diagnostic d’allergie alimentaire IgE médiée mais sa positivité à un allergène ne permet pas d’affirmer son implication dans l’allergie digestive en raison d’une faible spécificité [14]. L’intérêt diagnostique limité et la faible reproductibilité des atopy patch-tests ont fait qu’ils ne sont plus recommandés dans le diagnostic de l’allergie alimentaire dans la plupart des pays européens.
Endoscopie
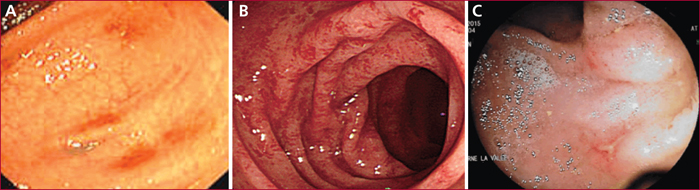
La muqueuse colique est endoscopiquement normale dans environ 70 % des cas [10]. Dans une série personnelle rétrospective ayant étudié 37 malades avec une CE, une atteinte muqueuse était notée dans 33 % des cas, dans la majorité des cas segmentaire, une pancolite dans seulement 11 % des cas ; les colons droit et gauche étaient le plus souvent atteints, dans 44 % des cas. Les lésions muqueuses étaient non spécifiques : un érythème dans 88 % des cas, un œdème avec une diminution de la vascularisation muqueuse dans 50 % des cas, des érosions voire ulcérations dans respectivement 63 % et 50 % des cas (figure 3). Dans notre série de CE primitive, aucune lésion muqueuse iléale et rectale n’était notée.
Histologie
Contrairement aux œsophagites à éosinophiles, les atteintes du côlon ont été très peu étudiées. Le diagnostic histologique de CE est rendu difficile par l’absence de consensus concernant les taux physiologiques de PNE dans la muqueuse colique, l’absence de définition histologique et par la mauvaise reproductibilité des critères diagnostiques en rapport avec leur grande variabilité intra- et inter-observateurs. Le diagnostic de colite à éosinophiles est rendu difficile par l’absence de consensus concernant sa définition histologique
L’absence de consensus pour le diagnostic de CE a été à l’origine de nombreuses définitions retenues en fonction de différents critères variant selon les études et les auteurs [15]. Récemment, Diaz del Arco et al.[10] ont suggéré qu’une limite supérieure de 40 PNE par HPF permettait d’obtenir une sensibilité de 60 % et une spécificité de 50 % pour le diagnostic de CE. Actuellement, un taux de PNE supérieur à 40 PNE par HPF dans au moins deux segments coliques différents pourrait être retenu pour le diagnostic histologique de CE. Cette définition impose de réaliser des biopsies coliques étagées dans chaque segment et de les recueillir dans des pots séparés.
L’atteinte étant hétérogène dans plus de 40 % des cas [10], des prélèvements multiples sont nécessaires afin d’augmenter la probabilité de mettre en évidence l’éosinophilie tissulaire. En cas d’atteinte musculeuse ou sous-séreuse, les biopsies muqueuses peuvent être non diagnostiques.
La variabilité inter-observateur est en grande partie liée au fait que l’analyse histologique dépend d’un calcul semi quantitatif de la densité des PNE en retenant généralement la moyenne obtenue à partir d’au moins trois HPF, tout en sachant que ce calcul dépend des variations de taille du champ en fonction du matériel utilisé, de la densité des éosinophiles en fonction des champs choisis (PNE plus nombreux près des follicules lymphoïdes) et des critères retenus pour comptabiliser les PNE (tous ou seulement ceux avec noyau visible).
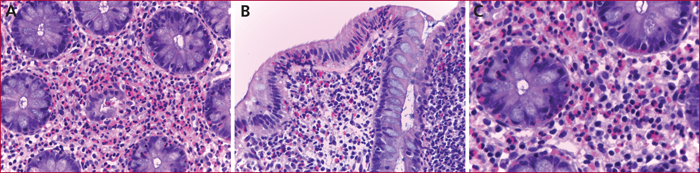
Les principaux signes histologiques rencontrés dans les CE sont rapportés dans le tableau 3. L’infiltrat inflammatoire à PNE de la lamina propria est constant, principalement au niveau du chorion ; l’infiltration à PNE intra-épithéliale est notée dans 76 % des cas, plus rarement au niveau de la sous-muqueuse (6,6 %), les biopsies coliques ne permettant pas toujours de la visualiser ; les micro-abcès à PNE et la dégranulation sont moins souvent notés, respectivement dans 21 et 51 % des cas [10] (figure 4).
Les mêmes auteurs recommandent l’élaboration d’un protocole regroupant les critères histologiques nécessaires pour le diagnostic de CE comprenant le taux moyen et le nombre maximum de PNE par HPF, la localisation et distribution des PNE, les signes d’activité des PNE (abcès éosinophiles, éosinophiles intraépithéliaux et dégranulation extensive), l’existence d’une distorsion architecturale, d’une atrophie muqueuse, d’une fibrose, d’une perte de mucine épithéliale, la présence d’inflammation aiguë, d’une infiltration lympho-plasmocytaire et hyperplasie folliculaire lymphoïde. Un taux de polynucléaires éosinophiles supérieur à 40 par champ à fort grossissement dans au moins deux segments coliques différents pourrait être retenu pour le diagnostic histologique de colite à éosinophiles
Diagnostics différentiels : colite à éosinophiles primitive versus secondaire
Le diagnostic de CE primitive repose sur l’existence de trois critères : une symptomatologie gastro-intestinale, un infiltrat à PNE de la muqueuse colique et l’élimination des autres causes d’hyperéosinophilie colique. Une éosinophilie colique peut résulter d’un certain nombre d’affections (tableau 2), la CE primitive étant un diagnostic d’élimination. Le diagnostic de colite à éosinophiles primitive est un diagnostic d’élimination et impose d’éliminer les autres causes d’hyperéosinophilie colique
Ainsi, une origine parasitaire est trouvée dans 5 à 10 % des cas, une maladie inflammatoire chronique intestinale (MICI) dans environ 10 % des cas, une cause médicamenteuse dans 3 % des cas et un syndrome hyperéosinophilique dans 1 % des cas [10].
Une parasitose peut entraîner une infiltration à PNE, les parasitoses le plus souvent incriminées étant l’ascaridiose, la toxocarose, la trichinose, la bilharziose, le taeniasis, l’ankylostomiose, la trichocéphalose, l’anguillulose et l’oxyurose. Des analyses parasitologiques des selles répétées ou des tests sérologiques sont souvent nécessaires pour révéler l’infection. Néanmoins, la fréquence de ces infections et la mauvaise sensibilité́ des recherches parasitaires peuvent justifier un traitement d’épreuve anti-parasitaire chez tous les patients avec infiltrat à PNE de la paroi colique.
Bien que les PNE aient été impliqués dans la pathogénie des MICI, leur rôle exact n’est pas connu. L’infiltrat à PNE de la muqueuse colique peut être au premier plan et faire évoquer, à tort, une CE. Certains auteurs ont même suggéré que la CE pouvait précéder la survenue d’une colite inflammatoire et qu’en cas de résistance aux traitements la réalisation de nouvelles coloscopies avec biopsies pouvait être utile pour rétablir le diagnostic. Ainsi, dans une première étude rétrospective maltaise [11], 25 % des malades ayant eu initialement un diagnostic de CE développaient au cours du suivi, une maladie de Crohn dans 28 % des cas, une rectocolite hémorragique dans 47 % des cas et une colite indéterminée dans 5 % des cas. Dans une autre série rétrospective [10], le diagnostic de MICI était finalement retenu chez 11 % des malades ayant initialement une CE. D’éventuelles implications cliniques de l’infiltrat à PNE en cas de MICI ont été évoquées, son intensité chez les malades ayant une rectocolite hémorragique pouvant être un facteur prédictif de réponse au traitement [16] et son effet protecteur dans les colites de MICI ayant été évoqué. Enfin, certains critères histologiques pourraient permettre d’orienter le diagnostic initial et de différentier CE et colite de MICI, tels qu’un infiltrat inflammatoire moins intense, une augmentation de la dégranulation des mastocytes, la présence de dépôts de tryptase et une augmentation des IgE dans les zones muqueuses péri-neurales, éléments plutôt en faveur du diagnostic de CE [17].
Tous les médicaments peuvent entraîner des manifestations allergiques avec hyperéosinophilie sanguine, l’infiltration du tube digestif par les éosinophiles étant inconstante. Les médicaments le plus souvent incriminés sont les sels d’or, la clozapine, la carbamazepine, la rifampicine, la gabapentine et prégabaline, les AINS, le tacrolimus et la sulphasalazine. Certaines éosinophilies digestives iatrogènes peuvent également être secondaires à une radiothérapie abdominale ou à la manipulation de produits industriels (benzène, mercure).
La CE a également été associée à des vascularites et à des maladies auto-immunes du tissu conjonctif, notamment la sclérodermie, la dermatomyosite et la polymyosite, à la greffe allogénique de moelle osseuse et au rare syndrome de Tolosa-Hunt correspondant à un syndrome d’ophtalmoplégie douloureuse, généralement secondaire à un processus inflammatoire non spécifique du sinus caverneux ou de la fissure orbitaire supérieure.
Enfin, il est indispensable d’éliminer un syndrome hyperéosinophilique (SHE) qui se définit par la présence d’une éosinophilie sanguine supérieure à 1 500/mm3 pendant plus de 6 mois associée à au moins une atteinte viscérale. Le SHE est quatre fois plus fréquent chez l’homme que chez la femme. Il n’existe pas de critères histologiques permettant de différencier une entéro-colite à PNE d’un SHE avec atteinte intestinale, présente dans plus de 10 % des cas. L’hyperéosinophilie sanguine constante et souvent majeure, l’atteinte multiviscérale qui peut être symptomatique ou silencieuse, sont deux critères pouvant aider à distinguer les deux entités pathologiques.
Évolution et pronostic de la colite à éosinophiles
L’évolution de la CE primitive est mal connue car peu étudiée. Chez le grand enfant et l’adulte, bien que le pronostic soit bon, l’évolution vers la chronicité est fréquente avec une alternance de périodes symptomatiques et de rémission plus ou moins longues [14]. Quelques cas de tableau sévère avec diarrhée sanglante ou rectorragies massives ont été publiés [18]. En cas d’atteinte transmurale de la paroi colique, des complications telles que sténose et occlusion, invagination [19], perforation [20] et volvulus [21] ont été rapportées.
Traitement
Contrairement aux œsophagites à éosinophiles dont les critères de prise en charge sont bien établis, il n’existe aucun consensus sur le traitement de la CE. En effet, le traitement de la CE est mal défini en raison de sa rareté, de sa physiopathologie mal connue, de l’absence d’étude contrôlée et d’une possible régression spontanée des symptômes et de la colite.
Prise en charge de l’allergie avec détection et éviction de l’allergène
Chez l’adulte avec une CE primitive, comme chez le grand enfant et l’adolescent, les réactions allergiques IgE ou non IgE-médiées sont rarement identifiées, nécessitant le plus souvent un traitement médicamenteux. De même, il est démontré que les tests cutanés sont plus performants et la réponse aux régimes alimentaires d’éviction meilleure chez le jeune enfant que chez l’adolescent et l’adulte [14].
Dans les formes allergiques, l’exclusion antigénique est parfois suffisante, mais son efficacité́ est souvent transitoire. Ainsi, chez les patients symptomatiques, un régime d’exclusion peut être tenté pour une durée maximale de six semaines. Les allergènes les plus fréquemment impliqués dans les CE sont le lait, le blé, le soja, les œufs, les crustacés et poissons, les noisettes. Après cette phase d’induction, une réintroduction sélective des différents aliments peut permettre d’identifier les allergènes potentiellement responsables [22].Une éviction ciblée sur les aliments réagissant aux tests cutanés allergologiques s’est avérée moins efficace. L’efficacité de ces régimes est principalement limitée par la compliance des patients. Chez les patients symptomatiques avec une forme allergique de colite à éosinophiles, l’exclusion antigénique est parfois suffisante et un régime d’exclusion peut être tenté
Traitements médicamenteux
Corticoïdes
L’efficacité des corticoïdes dans le traitement des CE est en grande partie liée à l’inhibition des facteurs de croissance des PNE tels que l’IL-3 et l’IL-5, le granulocyte-macrophage colony-stimulating factor (GM-CSF). À ce jour, il n’y a pas d’étude randomisée ayant évalué l’efficacité des corticoïdes dans la CE. Les données de la littérature, reposant sur les résultats de cas cliniques et de petites séries, suggèrent qu’une corticothérapie orale à la dose quotidienne de 20 mg à 1 mg par kilo pour une durée de 2 à 8 semaines, suivie d’une décroissance progressive, améliorerait les symptômes et les lésions histologiques dans la très grande majorité des cas (plus de 90 % pour certains auteurs), le taux de rechute élevé avec cortico-dépendance représentant le principal problème [23].
Le budésonide est une alternative thérapeutique qui s’est également avéré efficace avec l’obtention de rémissions prolongées [24, 25], au bénéfice d’effets secondaires moindres que la corticothérapie classique. Une corticothérapie orale améliorerait les symptômes et les lésions histologiques dans la très grande majorité des cas
Anti-histaminiques et stabilisateur des mastocytes
Le kétotifène est un antagoniste des récepteurs H1 de l’histamine qui inhibe la migration des PNE vers leur cible tissulaire. Son efficacité et innocuité ont été rapportées dans quelques cas publiés, en alternative à la corticothérapie en cas de contre-indication, de cortico-résistance ou dépendance [26].
Le cromoglycate de sodium inhibe la libération d’histamine, leucotriènes et autres médiateurs sécrétés par les mastocytes activés et, comme le kétotifène, inhibe la migration des PNE vers les tissus. Bien que discutée, son efficacité potentielle a également été rapportée dans quelques cas et petites séries [27, 28].
Inhibiteur des leucotriènes
Le montelukast, antagoniste sélectif des récepteurs aux leucotriènes D4, permet de bloquer le chimiotactisme et la migration des PNE vers les tissus. Bien que son efficacité dans la CE soit débattue, les résultats de quelques cas rapportés dans la littérature sont en faveur d’une possible efficacité. Le montelukast pourrait être indiqué dans certaines situations de cortico-dépendance permettant d’obtenir des rémissions cliniques prolongées avec sevrage en corticoïdes [29-31].
Immunosuppresseurs
L’azathioprine et la 6-mercaptopurine inhibent les facteurs de croissance des PNE et réduisent l’infiltrat digestif en PNE. Malheureusement, il n’existe actuellement aucune étude contrôlée publiée sur un immunomodulateur conventionnel dans le traitement des entéro-colites à PNE. Bien que la place de ces immunosuppresseurs soit bien définie dans l’arsenal thérapeutique des MICI, leur utilisation dans les entéro-colites à PNE est limitée à quelques cas ou petites séries [32]. Le peu de données concernant leur efficacité dans cette indication ne permet pas de recommander les immunosuppresseurs conventionnels dans le traitement des CE. Cependant, dans certains cas sévères de CE cortico-dépendantes, un traitement immunosuppresseur tel que l’azathioprine pourrait être discuté.
Anticorps monoclonaux anti-IL5 et anti-IgE
De nombreuses autres options thérapeutiques sont encore à considérer comme expérimentales dans l’entéro-colite à PNE. Le mépolizumab est un anticorps monoclonal humanisé dirigé contre l’IL-5, dont l’efficacité dans l’entéro-colite à PNE a été suggérée dans une série pédiatrique pilote de 4 enfants ayant reçu une dose unique à l’origine d’une diminution de l’éosinophilie sanguine, de l’infiltrat digestif à PNE et d’une amélioration clinique minime [33]. L’omalizumab est un anticorps monoclonal recombinant ciblé sur les IgE et les empêchant d’activer les mastocytes et les basophiles en diminuant la concentration de récepteurs d’IgE de haute affinité sur ces cellules. L’efficacité potentielle de l’omalizumab a été montré dans une étude ouverte menée sur 9 sujets allergiques atteints de gastro-entérite à PNE. L’omalizumab était associé à une diminution de 35 à 45 % de l’éosinophilie sanguine et à une diminution plus importante de 60 à 70 % des PNE duodénaux et antraux, les taux de PNE coliques n’étant pas précisés ; il était également noté une amélioration significative des signes cliniques [34].
Des études contrôlées et randomisées de plus grande envergure seront nécessaires afin de préciser leur efficacité et innocuité et de positionner ces traitements dans la prise en charge des entéro-colites à PNE.
Anti-TNF alpha
Il n’existe pas de donnée chez l’adulte concernant l’efficacité des anti-TNF alpha dans le traitement de la CE. Une série de trois patients avec œsophagite à éosinophiles cortico-dépendante ne montrait pas d’efficacité d’un traitement par infliximab. Turner et al.[35] rapporte dans une série pédiatrique de huit enfants porteurs d’une gastro-entérite à PNE sans allergie identifiée, l’efficacité durable d’un traitement par infliximab avec l’obtention d’une rémission clinique complète chez 75 % des enfants et une amélioration endoscopique chez 25 % d’entre eux. Un taux de rechute sous traitement était noté dans 50 % des cas, le recours à l’adalimumab à forte dose s’accompagnant d’une rémission prolongée.
Conclusion
La CE est certainement sous-estimée car mal connue, malgré une incidence croissante probable au cours de ces dernières années. Son diagnostic pose actuellement deux problèmes majeurs que sont l’absence de consensus sur les taux physiologiques de PNE dans la muqueuse colique normale et sur les critères diagnostiques histologiques. La CE primitive, très souvent associée à un contexte allergique, est un diagnostic d’élimination après avoir écarté une CE secondaire. Le traitement est mal défini mais les corticoïdes semblent être au premier plan, les résultats du régime d’éviction alimentaire étant décevants chez l’adulte. Des études prospectives seront nécessaires pour améliorer la prise en charge de la CE de l’adulte, notamment afin de préciser la place des anticorps monoclonaux anti-IL5 et anti-IgE et des anti-TNF alpha dans les stratégies thérapeutiques.Take home messages
Remerciements
aux docteurs Mathieu Yver et Dorian Dikov pour les photos d’histologie.
Liens d’intérêts
l’auteur déclare n’avoir aucun lien d’intérêt en rapport avec l’article.
![]() This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License
This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License