Hépato-Gastro & Oncologie Digestive
MENUInflammatory Bowel Disease and cancer Volume 25, issue 8, Octobre 2018
Le cancer est devenu la première cause de mortalité de France. La plupart des cancers qui surviennent chez les personnes atteintes de maladie inflammatoire chronique intestinale (MICI) ne sont liés ni aux MICI ni à leur traitement. Au même titre que tous les individus de la population générale, les personnes vivant avec une MICI ne doivent pas fumer, et les femmes doivent se prêter au dépistage organisé du cancer du sein et à la surveillance gynécologique du col utérin. La prévention des cancers au cours des MICI ne se limite pas à la prévention des cancers minoritaires liés aux MICI ou à leur traitement
Cancers liés au traitement des MICI
Le risque global de cancer est modérément mais significativement augmenté chez les patients traités par thiopurines, du fait essentiellement des lymphomes, des cancers des voies urinaires des hommes (surtout âgés et fumeurs), et des cancers cutanés non mélanocytaires qui ne menacent pas pour la plupart le pronostic vital [1, 2]. Un tel sur-risque n’est pas établi pour les anti-TNF utilisés en monothérapie, et n’est pas encore connu pour le méthotrexate, le védolizumab et l’ustékinumab.
Hémopathies malignes
Les lymphomes non hodgkiniens sont devenus fréquents dans la population générale. Leur incidence augmente linéairement avec l’âge, et les hommes sont deux fois plus touchés que les femmes. Le risque de lymphome est multiplié par 2 à 3 en cas d’exposition aux thiopurines [3], de façon réversible, et essentiellement du fait de lymphomes liés au virus d’Epstein-Barr Virus (EBV) chez les patients déjà infectés par EBV (plus de 90 % des individus après 30 ans). Le risque absolu résultant est important chez les hommes de plus de 60 ans. Il l’est également chez les patients séronégatifs pour EBV, du fait du risque spécifique de lymphoprolifération post mononucléose infectieuse (tableau 1). Le lymphome T hépato-splénique survient surtout chez les garçons traités par thiopurines associées ou non aux anti-TNF, mais reste exceptionnel. Le risque de lymphome lié aux monothérapies par anti-TNF n’est pas encore établi : une étude danoise suggère l’absence de sur-risque [4] alors qu’une étude nationale française suggère un sur-risque similaire à celui des thiopurines, venant s’ajouter à lui en cas de combothérapie [5]. De rares lymphomes ont été décrits avec le méthotrexate. Le risque de lymphome n’est pas encore connu chez les patients atteints de MICI traités par védolizumab, ustékinumab et tofacitinib.
L’étude CESAME a été la seule à suggérer un sur-risque de leucémies aiguës myéloïdes et de myélodysplasies sévères en cas d’exposition passée aux thiopurines, mais il n’y a aucun moyen de prévention ni de démonstration du rôle des thiopurines pour ce type de cancer. Il est discutable d’en parler aux patients dans ces conditions. L’utilisation prolongée des thiopurines est discutable si elle peut être évitée chez les hommes de plus de 60 ans et chez les patients séronégatifs pour Epstein-Barr Virus
Autres cancers
Le risque de cancers de la peau, mélanocytaires (mélanomes) et non mélanocytaires (baso-cellulaires et épidermoïdes) semble intrinsèquement un peu augmenté au cours des MICI [6]. Il est donc recommandé à tous les patients, dès le diagnostic, de respecter les mesures universelles de protection solaire et d’entamer une surveillance cutanée auprès d’un dermatologue qui fixera les intervalles entre deux examens en fonction des niveaux individuels de risque qui prennent en compte bien d’autres facteurs que les MICI ou leur traitement.
Les thiopurines augmentent de 2 à 5 fois le risque de cancers non mélanocytaires de la peau [7]. La réversibilité de ce risque est controversée. Les anti-TNF augmentent de 1,5 à 2 fois le risque de mélanome malin, et peut-être aussi légèrement le risque de cancers non mélanocytaires.
Les thiopurines favorisent les infections à Human Papilloma Virus (HPV), notamment les verrues vulgaires. Même si l’excès de cancers du col utérin sous thiopurines n’est pas certain, il est préférable de ne plus utiliser cette classe thérapeutique chez les femmes qui ont des lésions dysplasiques avancées récidivantes. L’impact des autres immunosuppresseurs n’est pas connu.
Les thiopurines augmentent significativement le risque de cancers du rein et de la vessie, mais seulement chez les hommes de plus de 60 ans, et surtout chez ceux qui fument [8]. Protection solaire et suivi dermatologique sont indiqués dès le diagnostic de MICI, quel que soit le traitement
Cancers liés à l’inflammation intestinale
Cancer colorectal
Les personnes vivant avec une MICI comportant une atteinte colorectale sont à risque de développer un cancer sporadique ou un cancer lié à l’inflammation, selon des séquences carcinogènes complètement différentes [1]. Il y a donc addition des facteurs de risque des cancers sporadiques (âge, sexe masculin, antécédent familial de cancer colorectal, tabagisme, alcoolisme, sédentarité, obésité, consommation élevée de viande) et des cancers liés à l’inflammation (cholangite sclérosante primitive (CSP), étendue de l’inflammation muqueuse colorectale, durée d’évolution supérieure à 7-10 ans, marqueurs endoscopiques et histologiques d’inflammation chronique) [1]. Les patients qui n’ont ni colite ni antécédent familial au premier degré de cancer colorectal sont à risque moyen de cancer colorectal, mais doivent être surveillés par coloscopies itératives (tous les 5 à 10 ans en l’absence de lésions néoplasiques détectées), à partir de 50 ans, car les tests immunologiques fécaux ne sont pas utilisables. Tous les autres doivent se soumettre à une surveillance par coloscopies itératives, dont les modalités sont régulièrement mises à jour dans les recommandations internationales [9, 10]. Cette politique est justifiée, car le risque de cancer colorectal reste environ multiplié par 5 chez les patients ayant une colite ancienne étendue par rapport aux individus appariés sur le sexe et l’âge de la population générale. Les patients qui n’ont pas de colite doivent être surveillés par coloscopies itératives à partir de 50 ans, car ils ne sont pas éligibles aux tests fécaux
Pour réduire la mortalité par cancer colorectal au cours des MICI, la détection endoscopique des lésions néoplasiques est donc de mise chez tous les malades. L’optimisation du mode de vie pourrait réduire de 20 à 30 % le risque de cancer colorectal sporadique. En théorie, les traitements qui réduisent précocement, substantiellement et durablement l’inflammation colorectale devraient faire baisser l’incidence des cancers liés à l’inflammation. Ceci est maintenant à peu près établi pour la prise régulière de dérivés 5-aminosalicylés (au moins 1,2 g/jour) au cours de la rectocolite hémorragique, avec une réduction de moitié du risque de dysplasie et de cancer [11], et des arguments mécanistiques moléculaires anti-carcinogènes. Pour les immunosuppresseurs, aucun effet chimiopréventif n’est à ce jour clairement démontré. Seules certaines études suggèrent une réduction du risque de cancer colorectal chez les patients traités par thiopurines qui ont une colite ancienne étendue [12]. L’exposition régulière aux dérivés 5-aminosalicylés réduit de moitié le risque de néoplasie colorectale dans la rectocolite hémorragique
Adénocarcinome de l’intestin grêle et maladie de Crohn
La cancérisation possible des lésions inflammatoires de l’intestin grêle au cours de la maladie de Crohn est de connaissance assez récente, avec une séquence inflammation-dysplasie-cancer identique à celle des colites. Chez les patients qui ont une iléite isolée, le risque d’adénocarcinome iléal est du même ordre que le risque de cancer colorectal sporadique. Le diagnostic est porté à l’âge moyen de 50 ans après une durée moyenne d’évolution de 15 ans [13]. La douleur abdominale est quasi constante. Des signes cliniques obstructifs nouveaux ou aggravés, et une altération générale sont observés une fois sur deux. Il n’y a aucun signe spécifique en imagerie, mais un syndrome de masse annulaire, une nodularité des marges de la masse, et une perforation circonscrite sur un phénotype jusque-là inflammatoire ou sténosant, sont suspects [14]. Malgré cela, le diagnostic est de plus en plus souvent une mauvaise surprise lors de l’examen histologique de pièces de résection pour indication non carcinologique. Aucun programme de surveillance endoscopique n’est recommandé, mais si une iléoscopie est faite, des biopsies systématiques ou dirigées sont indiquées, lorsque les lésions sont accessibles. Il n’y a pas de chimioprévention validée, même si un signal avec les dérivés 5-aminosaliylés a été suggéré dans une étude cas-témoin. Le pronostic des adénocarcinomes iléaux est médiocre, même après résection carcinologique, et sans chimiothérapie adjuvante validée. La possibilité d’une cancérisation des lésions iléales non décelable par endoscopie et imagerie doit être prise en compte lors des décisions thérapeutiques de fond en cas d’atteinte ancienne de l’intestin grêle. La possibilité d’une cancérisation des lésions inflammatoires doit maintenant être prise en compte dans les décisions thérapeutiques de fond d’une iléite ancienne
Cancer ano-rectal au cours de la maladie de Crohn ano-périnéale
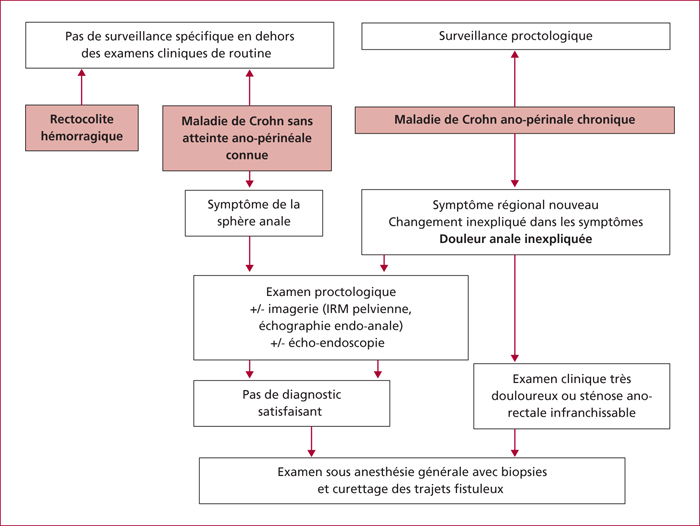
Les patients qui ont des lésons ano-périnales chroniques de maladie de Crohn sont à risque élevé de cancer rectal, siège quasi constant d’une inflammation chronique associée [15]. Ils sont aussi à risque accru de cancer épidermoïde de l’anus (associé à HPV dans 90 % des cas). Ils sont enfin spécifiquement à risque de de cancérisation des trajets fistuleux (plus souvent adénocarcinome que cancer épidermoïde) [16] et d’adénocarcinome développé au sein de sténoses ano-rectales chroniques. L’impact aggravant ou chimiopréventif des traitements immunosuppresseurs n’est pas connu. Toute douleur anale nouvelle et inexpliquée doit faire suspecter une cancérisation des lésions ano-périnéales (figure 1). La preuve histologique du cancer est souvent difficile à obtenir en cas de sténoses et/ou de cancers développés au sein des fistules. Un examen sous anesthésie générale et un curettage des trajets fistuleux sont parfois nécessaires, mais n’évitent pas toujours une proctectomie indiquée au moins en partie pour une suspicion de cancer.
Le risque cumulé des différents types de cancers ano-rectaux qui peuvent survenir au cours d’une maladie de Crohn ano-périnéale excède de dix fois le risque de cancer colique [15]. Ceci doit nous inciter à engager dès à présent chez ces malades chez une surveillance proctologique, dont les modalités seront progressivement définies. Les cancers ano-rectaux sont fréquents en cas de lésions ano-périnales chroniques de maladie de Crohn et justifient une surveillance proctologique
Cholangiocarcinome
Le risque de cancérisation (adénocarcinome de la vésicule biliaire ou des voies biliaires) des lésions inflammatoires de CSP est de l’ordre de 1 % par an. Il justifie une surveillance par imagerie itérative et peu faire discuter une transplantation hépatique en cas de cancer avéré ou suspecté.
Traitement des MICI après un cancer
Par rapport à des individus de même sexe et de même âge, les personnes qui ont guéri d’un premier cancer sont à risque accru de développer un deuxième cancer dans un autre organe, ce d’autant qu’ils ont eu le premier cancer à un âge jeune. Ce sur-risque ne paraît pas clairement modifié par la prise ou non d’un traitement immunosuppresseur.
La question clinique centrale est en fait d’éviter au maximum qu’une récidive locorégionale ou métastatique du cancer index (souvent fatale pour certains organes) ne soit favorisée par le maintien ou la reprise trop précoce d’un traitement immunosuppresseur. Les données publiées à ce jour ne sont pas pleinement rassurantes car elles manquent de puissance. De plus, elles ne sont pas stratifiées en fonction des types de cancer, et sont biaisées par la propension qu’il y a à maintenir ou reprendre rapidement les immunosuppresseurs chez des patients dont le cancer a un faible risque intrinsèque de récidive [17].
L’immunosurveillance est un processus biologique assuré principalement par certains lymphocytes qui permet la clairance des cellules cancéreuses résiduelles. La restauration de l’immunosurveillance est maintenant un axe thérapeutique majeur et efficace en oncologie. Dans certains types de cancers, comme le cancer colorectal, dont la récidive est rare après cinq ans, l’immunosurveillance est surtout importante pendant les premières années. Pour d’autres cancers (certains cancers du sein et mélanomes) à risque de récidive très tardive, l’immunosurveillance doit être préservée le plus longtemps possible. Après une transplantation rénale, dans les années 1980, sous un régime immunosuppresseur comportant des thiopurines, il y avait jusqu’à 20 % de récidives des cancers [18], surtout dans les deux premières années et pour les cancers à fort risque de récidive (tableau 2).
En tenant compte de l’ensemble de ces éléments factuels et théoriques, il est recommandé par prudence de respecter une pause de 2 à 5 ans (pour les cancers à haut risque de récidive) avant de reprendre un traitement immunosuppresseur, sauf en cas de MICI sévère non contrôlée par les traitements alternatifs [18]. Dans cette dernière situation en effet, les risques vitaux avérés liés aux MICI (dénutrition, sepsis, accidents cardiovasculaires) deviennent supérieurs au risque de récidive du cancer. Après un cancer, il est prudent de respecter une pause de 2 à 5 ans avant de reprendre un traitement immunosuppresseur, sauf en cas de MICI sévère non contrôlée
Les thiopurines ne doivent pas être réutilisées après un lymphome associé à EBV, un cancer du col utérin ou des cancers cutanés multiples non mélanocytaires. Les anti-TNF sont contre-indiqués après un mélanome malin. Sur des arguments purement théoriques, il est tentant d’utiliser le védolizumab après un cancer extradigestif, et de l’éviter après un cancer digestif. Il n’y a pas encore de données sur les liens entre cancer et ustékinumab au cours des MICI, en sachant qu’aucun signal inquiétant n’a été mis en évidence depuis 2009 en dermatologie, à des doses globalement plus faibles.Take home messages
Liens d’intérêts
l’auteur déclare les liens d’intérêts suivants : conférences rémunérées (Abbvie, Ferring, MSD, Takeda, Tillots), participation à des advisory boards (Allergan, Biogen, Janssen, Pfizer). Soutien inconditionnel à la recherche par AbbVie, Ferring, MSD, Janssen, Biogen, Takeda, Tillots.
![]() This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License
This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License