Hématologie
MENU14 Myélome Volume 26, supplement 4, Septembre 2020
14-01
Daratumumab plus lénalidomide et dexaméthasone par rapport au lénalidomide et à la dexaméthasone chez des patients atteints d’un myélome multiple nouvellement diagnostiqué non éligibles à une greffe Analyse mise à jour de MAIA
T. Facon*1, NJ. Bahlis2, SZ. Usmani3, SK. Kumar4, T. Plesner5, R. Orlowski6, C. Touzeau7, S. Basu8, H. Nahi9, C. Hulin10, H. Quach11, H. Goldschmidt12, M. O’ Dwyer13, CP. Venner14, K. Weisel15, M. Krevvata16, H. Pei17, J. Wang18, R. Van Rampelbergh19, J. Ukropec20, CM. Uhlar21, R. Kobos22, A. Perrot23
1 Maladies du sang, Hôpital Claude Huriez, Lille ; 2 Hematology, Tom Baker Cancer Centre, Calgary, Canada ; 3 Institut du cancer Levine/Atrium Health, Charlotte, NC, États-Unis ; 4 Hematology, Mayo Clinic, Rochester, États-Unis ; 5 Vejle Hospital and University of Southern Denmark, Vejle, Danemark ; 6 Hématologie, M D Anderson Hospital & Tumor, Houston, États-Unis ; 7 Hématologie clinique, CHU Nantes, CRCINA, Inserm, CNRS, Université d’Angers, Université de Nantes, Nantes ; 8 The Royal Wolverhampton NHS Trust, Wolverhampton, Royaume Uni ; 9 Center for Hematology and Regenerative Medicine, Karolinska Institutet, Stockholm, Suède ; 10 Hématologie, Hôpital Haut-Lévêque, Pessac ; 11 Hématologie, St Vincent's Private Hospital, Melbourne, East Melbourne, East Melbourne, Australie ; 12 Hématologie, Université de médecine de Heidelberg, Heidelberg, Allemagne ; 13 Dépt. de médecine/hématologie, NUI, Galway, Irlande ; 14 Division d’oncologie médicale de l’Université de l’Alberta, Edmonton, Alberta, Canada ; 15 Oncologie, Tübingen University Hospital, Tübingen, Allemagne ; 16 Janssen Research & Development, LLC, Spring House, PA, États-Unis ; 17 Janssen Research & Development, Llc, Raritan, États-Unis ; 18 Research & development, Janssen, Raritan, NJ, États-Unis ; 19 Janssen Research & Development, Beerse, Belgique ; 20 Janssen Global Medical Affairs, LLC, Horsham, PA, États-Unis ; 21 Janssen Research & Development, Spring House, PA, États-Unis ; 22 Janssen Research & Development, Raritan, NJ, États-Unis ; 23 Service d’hématologie, Oncopole, Toulouse
Introduction. Le daratumumab (DARA) est approuvé en association avec les schémas recommandés pour les patients atteints de myélome multiple nouvellement diagnostiqué (MMND) et de myélome multiple en rechute/réfractaire (MMRR). L’addition de DARA aux schémas recommandés a augmenté les taux de réponse complète (RC) et de maladie résiduelle minimale (MRD) négative, et réduit le risque de progression de la maladie/décès. Dans les résultats initiaux de l’étude MAIA de phase 3 (suivi médian : 28,0 mois [m.]), D-Rd a significativement prolongé la survie sans progression (SSP) et le taux MRD négative par rapport à Rd chez des patients atteints de MMND non éligibles à une greffe (NG). Ici, nous communiquons les résultats mis à jour après 9 m. supplémentaires de suivi.
Patients et méthodes. Les patients atteints de MMND non éligibles à une chimiothérapie à forte dose et à une greffe (âge/comorbidités) ont été randomisés 1:1 pour recevoir lénalidomide et dexaméthasone (Rd)/daratumumab et Rd (D-Rd). Les pts ont été stratifiés (système international de stadification [ISS], région, âge) et ont suivi des cycles de 28 jours de Rd (R : 25 mg par voie orale, Jours un à 21 ; d : 40 mg par voie orale, Jours 1, 8, 15, 22). Le DARA (16 mg/kg IV) a été administré chaque semaine (Cycles un et 2), deux fois par semaine (Cycles 3 à 6), et toutes les quatre semaines dans D-Rd. Les critères d’évaluation principal (SSP) et secondaires ont été mesurés.
Résultats. 737 pts ont été randomisés (D-Rd, n = 368/Rd, n = 369) ; âge médian : 73 ans (43,6 % ≥ 75 ans). Respectivement 27 %, 43 %, et 29 % des pts étaient stade ISS I, II, et III ; les pts évaluables présentaient un risque cytogénétique standard (86 %) ou élevé (14 %). À 36,4 m. de suivi médian, la SSP médiane était non atteinte (NA) avec D-Rd vs 33,8 m. avec Rd (hazard ratio [HR], 0,56 ; IC95 %, 0,44-0,71 ; P < 0,0001) ; les taux de SSP estimés à 36 m étaient de 68 % vs 46 %. Le DARA a approfondi les taux de réponse. Le taux de MRD négative était supérieur avec D-Rd vs Rd (29 % vs 9 %, P < 0,0001). Pour D-Rd vs Rd, la durée de réponse médiane était NA vs 40,7 m. Chez les patients à haut risque cytogénétique, le taux de MRD négative était 10 fois supérieur avec D-Rd vs Rd (23 % vs 2 %). La MRD négative maintenue dans le temps était de 15 % vs 4 % (seuil ≥ 6 mois) et de 11 % vs 2 % (seuil ≥ 12 mois). La SSP à la ligne suivante de traitement (SSP2) médiane était NA contre 47,3 m. (HR, 0,69 ; IC 95 %, 0,53-0,91 ; P = 0,0079), 39% vs 64 % ont arrêté le traitement, et 85 (23 %) vs 103 (28 %) ont arrêté pour cause de décès. Les événements indésirables apparus sous traitement de grade 3/4 (EIST ; D-Rd/Rd) chez les pts (≥ 10 %) étaient : neutropénie (51 %/35%), lymphopénie (15 %/11%), pneumonie (15 %/9%), anémie (14 %/21%), leucopénie (11 %/6%), hypokaliémie (10 %/10%), infections (36 %/27%). 9%/18% ont arrêté en raison d’EIST.
Conclusion. Ces résultats confirment l’amélioration significative en SSP et les réponses plus profondes incluant la MRD négative avec D-Rd vs Rd chez des pts atteints de MMND NG, sans nouveau signal de tolérance. Ces données soutiennent une utilisation en première ligne de D-Rd pour le MMND NG.
14-02
Concordance des taux de maladie résiduelle minimale post-consolidation par cytométrie en flux multiparamétrique et séquençage de nouvelle génération dans CASSIOPEIA
J. Corre*1, MC. Bene2, S. Wuillème3, H. Avet-Loiseau1, M. Attal4, B. Arnulf5, L. Garderet6, M. Macro7, AM. Stoppa8, M. Delforge9, A. Broijl10, S. Zweegman11, KS. Jie12, N. Van De Donk13, L. Pei14, C. De Boer15, C. Chiu16, V. Vanquickelberghe17, T. Kampfenkel18, J. Vermeulen19, P. Moreau20, P. Sonneveld21
1 Hématologie, IUCT Oncopole, Toulouse ; 2 Laboratoire d’hématologie biologique, CHU de Nantes, Nantes ; 3 Laboratoire hématologie biologique, Hôtel-Dieu, Nantes ; 4 Hématologie, IUCT Oncopole, Toulouse ; 5 Hématologie, Assistance Publique Hôpitaux de Paris, Paris ; 6 Hématologie, Centre Hospitalier Universitaire de Saint-Antoine, Paris ; 7 Service d’hématologie clinique, CHU Caen, Caen ; 8 Hématologie, Institut Paoli-Calmettes, Marseille ; 9 Hematology, University Hospital Leuven, Leuven, Belgique ; 10 Hematology, Erasmus MC cancer Institute, Rotterdam, Pays-Bas ; 11 Department of Hematology, Amsterdam University Medical Center, VU University Amsterdam, Cancer Center Amsterdam, Amsterdam, Pays-Bas ; 12 Hematology, Zuyderland UMC, Sittard, Pays-Bas ; 13 Hematology, VU University Medical Center, Amsterdam, Pays-Bas ; 14 Janssen research & development, Janssen Pharmaceuticals, Raritan, États-Unis ; 15 Janssen research & development, Janssen, Leiden, Pays-Bas ; 16 Oncology Heme Translational Research Group, Janssen Research & Development, LLC, Spring House, États-Unis ; 17 Janssen Research & Development, Janssen Pharmaceutica, Beerse, Belgique ; 18 Janssen Research & Development, Janssen Biologics BV, Leiden, Pays-Bas ; 19 Janssen Research & Development, Janssen, Leyde, Pays-Bas ; 20 Service d’hématologie clinique, Hôtel-Dieu, Nantes ; 21 Service d’hématologie, Erasmus MC Cancer Institute, Rotterdam, Pays-Bas
Introduction. L’association bortézomib-thalidomide-dexaméthasone (VTd) constitue un schéma recommandé en Europe pour les patients atteints de myélome multiple nouvellement diagnostiqué (MMND) qui sont candidats à une greffe de cellules souches autologues (GCSA). La première partie de l’étude de phase 3 CASSIOPEIA montre que l’ajout du daratumumab (D) à VTd réduit significativement le risque de progression ou de décès et améliore la réponse complète stringente (RCs), la RC ou mieux (≥ RC), et le taux de négativité de la maladie résiduelle minimale (MRD) par rapport à VTd seul.
L’évaluation de la MRD est en passe de devenir un outil pronostique majeur pour évaluer l’efficacité d’un traitement dans le MM. Le développement de la cytométrie en flux multiparamétrique (CMF) et du séquençage de nouvelle génération (NGS) a permis une détection à haut débit et plus sensible. Ici, nous avons évalué la concordance des résultats de MRD post-consolidation dans un sous-groupe de patients pour lesquels les deux méthodologies CMF et NGS ont été réalisées, avec une sensibilité de 10-5.
Patients et méthodes. Les patients présentant un MMND éligibles à la GCSA ont été randomisés pour recevoir quatre cycles d’induction pré-GCSA et deux cycles de consolidation post-GCSA avec D-VTd ou VTd. Les analyses de la MRD ont été réalisées sur des ponctions de moelle osseuse post-induction et post-consolidation (au Jour 100 post-GCSA) chez tous les patients, indépendamment de la réponse. Pour la population en intention de traitement (ITT), les résultats de MRD manquants ou indéterminés ont été considérés positifs. La MRD a été évaluée en premier lieu par CMF selon EuroFlow et en second lieu par NGS (Technique ClonoSEQ® de chez Adaptive).
Résultats. 1085 patients ont été randomisés pour recevoir D-VTd (n = 543) ou VTd (n = 542). Par CMF, (population en ITT), respectivement 63,7 % et 43,5 % des patients des bras D-VTd et VTd, ont obtenu la négativité de la MRD post-consolidation (P < 0,0001). Par NGS (population évaluable), respectivement 56,6 % et 36,8 %, ont obtenu la négativité de la MRD post-consolidation.
733 pts ont été évaluables par les deux techniques CMF et NGS en post-consolidation. L’évaluation de la concordance des résultats de MRD a montré un bon niveau de corrélation (83,5 %) et particulièrement dans le sous-groupe de patients avec ≥ RC (94,4 %). La concordance entre la CMF et le NGS était similaire entre les cohortes (82,7 % pour D-VTd contre 84,3 % pour VTd).
Conclusion. La bonne concordance des résultats de MRD par CMF et NGS, dans la population globale et dans le sous-groupe des patients avec ≥ RC indique que les deux techniques sont équivalentes dans l’évaluation de la MRD au seuil de 10-5. La concordance était similaire entre les cohortes D-VTd et VTd, ce qui suggère que la présence de daratumumab n’a pas interféré avec l’évaluation de la MRD par la technique de CMF utilisée.
14-03
Carfilzomib, dexaméthasone et daratumumab (KDd) versus carfilzomib et dexaméthasone (Kd) pour le traitement (ttt) du myélome multiple en rechute ou réfractaire (MMRR) : résultats de l’analyse principale de CANDOR, étude de phase III randomisée, en ouvert
X. Leleu*1, SZ. Usmani2, H. Quach3, MV. Mateos4, O. Landgren5, D. Siegel6, K. Weisel7, H. Yang8, S. Klippel9, A. Zahlten-Kuemeli10, MA. Dimopoulos11
1 Service d’hématologie et de thérapie cellulaire, CHU de Poitiers, Poitiers ; 2 -, Institut du cancer Levine/Atrium Health, Charlotte, NC, États-Unis ; 3 Hématologie, St Vincent's Private Hospital, Melbourne, East Melbourne, East Melbourne, Australie ; 4 Département d’hématologie, Hôpital Universitaire de Salamanca-IBSAL, Salamanque, Espagne ; 5 Hematology, Memorial Sloan-Kettering Cancer Center, New York, États-Unis ; 6 Hématologie, Centre de lutte contre le cancer John Theurer de l’Université de Hackensack, Hackensack, États-Unis ; 7 Oncologie, Tübingen University Hospital, Tübingen, Allemagne ; 8 Biostatistics, Amgen, Thousand Oaks, États-Unis ; 9 Global development, Amgen, Thousand Oaks, États-Unis ; 10 Médical, Amgen, Thousand Oaks, États-Unis ; 11 Clinical Therapeutics, Université d’Athènes, Athens, Grèce
Introduction. Le lénalidomide (LEN) et le bortézomib (BTZ) sont les nouveaux standards du traitement (ttt) du myélome multiple (MM) nouvellement diagnostiqué qui améliorent la survie des patients (pts). Ces ttt sont donnés jusqu’à la progression ou la toxicité, et ne sont plus disponibles à la rechute de ce fait. Il faut de nouveaux ttt efficaces, de tolérance acceptable, pour pts exposés ou réfractaires au LEN ou au BTZ dès la première rechute. Cfz (inhibiteur du protéasome) et daratumumab (anticorps monoclonal anti-CD8) sont autorisés en monothérapie ou en association pour ttt du MM en rechute ou réfractaire (MMRR). Efficacité et tolérance de carfilzomib-dexaméthasone (Kd) et daratumumab (D) démontrées par étude de phase un MMY1001. Les résultats de l’analyse principale de CANDOR, étude de phase III multicentrique, randomisée comparant KdD et Kd chez des pts avec MMRR sont présentés ici.
Patients et méthodes. Pts avec MMRR dont maladie est mesurable, ayant reçu 1-3 lignes de ttt avec une ≥ réponse partielle à ≥ 1 ligne de ttt éligibles et randomisés 2:1 pour recevoir KdD ou Kd. Cfz : perfusion IV 30 min J1, 2, 8, 9, 15 et 16 de chaque cycle de 28 jrs (20 mg/m2 J1,2 C1 puis 56 mg/m2). Daratumumab (8 mg/kg) : perfusion IV J1, 2 C1 et 16 mg/kg 1×/semaine pour autres doses du C1 C2, puis toutes les deux semaines du C3 au C6 puis toutes les quatre semaines. Pts ont reçu 40 mg de dexaméthasone par voie orale ou IV 1×/semaine (20 mg pour pts > 75 ans). Critère évaluation principal : survie sans progression (PFS). Critères secondaires : taux (tx) de réponse globale (ORR), réponse complète (RC) avec maladie résiduelle négative (MRDneg) à 12 mois (seuil 10-5), survie globale (OS), délai avant réponse et tolérance.
Résultats. Randomisation de 466 pts (KdD : 312 ; Kd : 154 ; âge médian : 64 ans). Caractéristiques des pts à l’inclusion équilibrées entre les deux bras. 42,3 % (KDd) et 90,3 % (Kd) avaient reçu du LEN ou du BTZ, 33 % des pts réfractaires au LEN. PFS évaluée après un suivi médian de 16,9 et 16,3 mois pour KdD et Kd. PFS médiane : non atteinte (NE) pour KdD et 15,8 mois pour Kd (HR, 0,63 ; IC95 %, 0,46-0,85 ; P = 0,0014). HR PFS en faveur de KdD vs Kd pour sous-groupes (gps) prédéfinis. PFS médiane KdD vs Kd : NE vs 12,1 mois dans gp exposé au LEN (HR, 0,52 ; IC95 %, 0,34-0,80) et NE vs 11,1 mois dans gp réfractaire au LEN (HR, 0,45 ; IC95 %, 0,28-0,74). ORR : 84,3 % vs 74,7 % (P = 0,0040) et tx de ≥ RC : 28,5 % vs 10,4 %. Tx de RC avec MRDneg à 12 mois : 12,5 % avec KdD vs 1,3 % avec Kd (P < 0,0001). OS médiane NE après un suivi médian de 17 mois (HR, 0,75 ; IC95 %, 0,49-1,13 ; P = 0,08). Incidence EI de grade ≥ 3 : 82,1 % (KDd) vs 73,9 % (Kd). EI graves : 56,2 % (KdD) et 45,8 % (Kd). Tx d’arrêt de ttt pour EI comparable entre les deux bras (KdD, 22,4 % ; Kd, 24,8 %). Insuffisance cardiaque de grade ≥ 3 : 3,9 % (KdD) et 8,5 % (Kd) ; tx insuffisance cardiaque entraînant arrêt du cfz comparable entre les deux bras (3,9 % et 4,6 %). Cinq décès liés au ttt avec KdD (pneumonie, sepsis, choc septique, infection à Acitenobacter et arrêt cardio-respiratoire). Autres critères d’efficacité, dont analyses des sous-gps clés seront présentés ultérieurement.
Conclusion. KdD : bénéfice de PFS significatif vs Kd avec réduction de 37 % du risque de progression ou de décès. Réponses plus profondes avec KdD : tx de RC avec MRD négative presque 10 fois > Kd. Bénéfice de PFS de KdD maintenu dans sous-gps prédéfinis et cliniquement importants, dont pts exposés et réfractaires au LEN. EI généralement contrôlés et tx EI entraînant arrêt du ttt similaire entre les deux bras. KdD associé à un profil bénéfice-risque favorable et représente un nouveau ttt efficace du MMRR, y compris pour pts exposés et/ou réfractaires au LEN.
14-04
Étude de non inférorité de phase 3, comparant l’administration du daratumumab par voie sous-cutanée et par voie intraveineuse chez des patients atteints de myélome multiple en rechute ou réfractaire : mise à jour de COLUMBA
P. Moreau*1, SZ. Usmani2, MV. Mateos3, H. Nahi4, S. Grosicki5, V. Vorobyev6, I. Spicka7, VTM. Hungria8, S. Korenkova9, M. Flogegard10, J. Blade11, M. Kaiser12, S. Iida13, J. Laubach14, T. Masterson15, K. Lantz16, L. O’rourke16, C. Heuck16, X. Qin17, D. Parasrampuria15, M. Qi17, NJ. Bahlis18
1 Service d’hématologie clinique, Hôtel-Dieu, Nantes ; 2 Institut du cancer Levine/Atrium Health, Charlotte, NC, États-Unis ; 3 Département d’hématologie, Hôpital Universitaire de Salamanca-IBSAL, Salamanque, Espagne ; 4 Center for Hematology and Regenerative Medicine, Karolinska Institutet, Stockholm, Suède ; 5 Haematology, Department of Cancer Prevention, School of Public Health, Medical University of Silesia, Katowice, Pologne ; 6 Hematology, S.P. Botkin City Clinical Hospital, Moscou, Fédération de Russie ; 7 Département de médecine interne, Hôpital universitaire Charles, Prague, République Tchèque ; 8 Department of Hematology, Clinica São Germano and Santa Casa Medical School, São Paulo, Brésil ; 9 Hematology, Kiev Center for Bone Marrow Transplantation, Kiev, Ukraine ; 10 Department of Internal Medicine, Falun General Hospital, Falun, Suède ; 11 Idibaps, Hospital Clinic de Barcelona, Barcelona, Espagne ; 12 Hématologie, The Institute of Cancer Research, Londres, Royaume-Uni ; 13 Nagoya City University Graduate School of Medical Sciences, Nagoya, Japon ; 14 Medical Oncology, Dana-Farber Cancer Institute, Boston, États-Unis ; 15 Janssen Research & Development, Spring House, PA, États-Unis ; 16 Janssen Research & Development, Janssen, Spring House, PA, États-Unis ; 17 Janssen Research & Development, LLC, Spring House, États-Unis ; 18 Hematology, Tom Baker Cancer Centre, Calgary, Canada
Introduction. Le daratumumab (DARA ; 16 mg/kg) par voie intraveineuse (IV) est approuvé en monothérapie ou en association avec les schémas recommandés pour le traitement du myélome multiple (MM). Pour améliorer la tolérance et réduire le fardeau des soins de santé pour le patient et les équipes soignantes, une formulation de DARA par voie sous-cutanée (SC) a été développée. Les premiers résultats provenant de l’étude de phase 3 COLUMBA (NCT03277105) chez les patients (pts) atteints d’un MM en rechute ou réfractaire (MMRR) ont démontré la non-infériorité du DARA SC comparé au DARA IV avec un suivi médian de 7,5 mois. Ici, nous présentons le suivi médian à 13,8 mois.
Patients et méthodes. Le DARA SC (1 800 mg de DARA + hyaluronidase PH20 humaine recombinante [technologie de distribution du médicament Enhanze®, Halozyme, Inc] ; 2 000 U/mL ; 15 mL) a été administré par pression manuelle pendant 3 à 5 minutes en alternant les sites abdominaux gauche/droite. Les pts atteints de MMRR éligibles (≥ 18 ans) avaient reçu ≥ 3 lignes de traitement (LDT) antérieures, dont un inhibiteur du protéasome (IP) et un médicament immunomodulateur (IMiD), ou étaient double réfractaires. Les co-critères principaux étaient le taux de réponse globale (TRG) et la Crésiduelle maximale (concentration pré-administration le jour 1 du cycle 3 [J1C3]) de DARA. Les critères d’évaluation secondaires comprenaient les taux de réaction liée à la perfusion (RLP), la survie sans progression (SSP), la très bonne réponse partielle ou mieux (≥ TBRP) et la réponse complète ou mieux (≥ RC).
Résultats. 522 pts ont été randomisés pour recevoir DARA SC (n = 263) ou DARA IV (n = 259). Âge médian : 67 ans ; poids corporel initial médian : 73 kg. Les pts ont reçu une médiane de quatre LDT et 100 % avaient déjà été traités par IP et IMiD. 82,2 % étaient réfractaires à la dernière ligne de traitement antérieure, et 49,4 % l’étaient aux IP et aux IMiD. 26,3 % et 17,3 % des pts présentaient un risque cytogénétique élevé dans les bras DARA SC et DARA IV, respectivement. Le TRG s’est amélioré entre les suivis à 7,5 mois et 13,8 mois pour DARA SC (41,1 % à 43,7 %) et DARA IV (37,1 % à 39,4 %). Les TRG étaient comparables dans tous les sous-groupes, y compris le poids corporel. La durée médiane de traitement (environ 5,5 mois) et le taux de réponse profonde (≥ TBRP, ≥ RC) étaient similaires entre DARA SC et DARA IV. Les taux de RLP étaient significativement plus bas avec DARA SC qu’avec DARA IV. Au moment de la clôture des données, 118 pts (répartis de manière équilibrée entre les deux bras) ont continué le traitement dans l’étude.
Conclusion. Avec un suivi plus long, les profils d’efficacité et de sécurité d’emploi de DARA SC et DARA IV sont restés similaires, mais avec une baisse significative des taux de RLP, un allégement du fardeau thérapeutique, et une plus grande satisfaction du traitement avec DARA SC. Ces données démontrent un profil bénéfice/risque favorable pour DARA SC 1 800 mg à dose fixe.
14-05
Étude EmmY : caractéristiques des patients atteints de myélome multiple et prise en charge thérapeutique en première ligne en vie réelle en France
O. Decaux1, L. Frenzel2, R. Garlantezec3, M. Macro4, K. Belhadj5, A. Perrot6, R. Germain*7, N. Texier8, M. Willaime9, C. Nobili Escriva10, C. Boccaccio11, C. Hulin12
1 Médecine interne, CHU de Rennes, Rennes ; 2 Hématologie/centre de référence de l’hémophilie, AP-HP, Paris ; 3 Santé publique et épidémiologie, CHU de Rennes, Rennes ; 4 Hématologie, CHU de Caen, Caen ; 5 Hématologie, Hôpital Henri Mondor, Créteil ; 6 Service d’hématologie, Oncopole, Toulouse ; 7 Épidémiologie, Kappa Santé, Paris ; 8 Épidémiologie, Kappa Santé, Paris ; 9 Statistiques, Kappa Santé, Paris ; 10 Gestion de projets, Intergroupe Francophone du myélome, Paris ; 11 Directrice générale, Intergroupe Francophone du myélome, Paris ; 12 Hématologie, Hôpital Haut-Lévêque, Pessac
Introduction. La prise en charge du myélome multiple (MM) repose sur des séquences thérapeutiques associant diverses classes de médicaments avec ou sans intensification thérapeutique avec autogreffe de cellules souches hématopoïétiques. Depuis dix ans, l’arsenal thérapeutique dans le MM est en constante évolution et s’est enrichi de plusieurs molécules. L’étude EMMY a été conçue afin de documenter la place de ces innovations thérapeutiques en pratique courante, en France, sur une population moins sélectionnée que dans les essais cliniques et leur impact sur les stratégies thérapeutiques au cours des prochaines années, selon le profil des patients et les caractéristiques de leur MM.
Patients et méthodes. Il s’agit d’une étude non interventionnelle descriptive en vie réelle, multicentrique et nationale, menée auprès de 70 des 110 centres de l’IFM (Intergroupe Francophone du myélome, Promoteur). Les patients [CB1] initiant un traitement pour un MM, quelle que soit la ligne, sont inclus sur une période d’observation définie chaque année, pendant quatre ans (1 000 patients attendus/an). Les données sont actualisées annuellement à partir des dossiers hospitaliers (données cliniques et schémas thérapeutiques) ; elles seront chaînées aux données d’hospitalisation et de consommation de soins du Système National des Données de Santé (SNDS) à partir de 2020. Le recueil des données de la cohorte un (C1) s’est déroulé en 2018, pour des patients ayant initié une chimiothérapie entre août et décembre 2017 et couvrait la période de l’initiation de la ligne jusqu’à la date de recueil (11 mois de suivi médian). Les caractéristiques des patients sont décrites à leur inclusion, l’analyse porte ensuite sur les traitements en première ligne (L1).
Résultats. La C1 est constituée de 1032 patients, 53 % d’hommes, âge médian de 70 ans (33 % < 65 ans, 17 % > 80 ans) diagnostiqué avec un MM à IgG (57 %), IgA (22 %), sans chaîne lourde (12 %), non déterminé (6 %), autres (2 %). Un antécédent de MGUS est renseigné pour 16 % des patients. Lorsque disponible à l’initiation de la ligne, l’ECOG est à 0 (33 %), un (46 %) ou 2+ (21%) et l’ISS à I (28 %), II (29 %), III (43 %). Parmi les patients, 472 (46 %) initient une L1, en médiane un mois après le diagnostic : 189 (40 %) patients sont greffés (L1G) et 283 (60 %) non greffés (L1NG). Les patients L1NG reçoivent principalement MPV (33 %), RD (18 %), VTD (10 %), VRD (9 %) ou VD (9 %). Ils sont considérés réfractaires primaires pour 21 % (< 6 mois du début de L1 à L2) et réfractaires secondaires pour 6 % (< 2 mois de la fin de L1 à L2). Au recueil, 50 % sont en cours de L1NG. Les 189 patients L1G ont reçu un traitement d’induction par VTD (61 %), VRD (22 %), VCD (7 %), VD (3 %) sur quatre cycles en médiane avant l’autogreffe. Une consolidation est réalisée pour 81 % des patients et un entretien pour 38 %. La L1G est toujours en cours dans 73 % des cas au recueil.
Conclusion. Les patients d’EMMY sont plus âgés et plus fragiles que ceux des essais cliniques. Ainsi, alors qu’environ 60 % des patients des essais sont autogreffés en L1, seulement 40 % des patients d’EMMY y sont éligibles. Les données d’EMMY sont donc plus représentatives des patients MM en vraie vie. Les modalités de prise en charge du MM en L1 sont homogènes et reposent majoritairement sur quatre à cinq protocoles conventionnels en cohorte 1. Les prochaines cohortes incluses dans EMMY permettront d’identifier les évolutions de pratique en vie réelle en fonction des résultats publiés et des AMM.
14-06
Mise à jour des résultats de MIROIR : une étude française multicentrique, non- interventionnelle évaluant le pomalidomide chez des patients atteints de myélome multiple en rechute/réfractaire
M. Macro*1, O. Decaux2, S. Gourgou3, F. Lachenal4, C. Bureau5, B. Arnulf6, D. Caillot7, AM. Stoppa8, L. Vincent9, A. Jaccard10, P. Moreau11, A. Perrot12, M. Mohty13, L. Karlin14, C. Sonntag15, JR. Eveillard16, S. Choquet17, J. Fontan18, X. Leleu19, C. Hulin20
1 Service d’hématologie clinique, IHBN - Hôpital Côte de Nacre, Caen ; 2 Médecine interne, CHU de Rennes, Rennes ; 3 Direction, CLCC Montpellier, Montpellier ; 4 Oncohématologie, CH Pierre Oudot, Bourgoin ; 5 Hématologie, Polyclinique Bordeaux Nord Aquitaine, Bordeaux ; 6 Hématologie, Assistance Publique Hôpitaux de Paris, Paris ; 7 Service d’hématologie, CHU de Dijon, Dijon ; 8 Hématologie, Institut Paoli-Calmettes, Marseille ; 9 Département d’hématologie clinique, Saint Eloi, Montpellier ; 10 Hématologie clinique, CHU Limoges, Limoges ; 11 Service d’hématologie clinique, Hôtel-Dieu, Nantes ; 12 Service d’hématologie, Oncopole, Toulouse ; 13 Service d’hématologie et de thérapie cellulaire, Hôpital Saint-Antoine, Paris ; 14 Hématologie clinique, Hospices Civils de Lyon, Lyon ; 15 Hématologie, ICANS - Institut de cancérologie Strasbourg Europe, Strasbourg ; 16 Hématologie clinique, CHRU de Brest, hôpital Morvan, Brest ; 17 Hématologie clinique, Hôpital Pitié Salpêtrière, Paris ; 18 Hématologie, Hôpital Jean Minjos, Besançon ; 19 Service d’hématologie et de thérapie cellulaire, CHU de Poitiers, Poitiers ; 20 Hématologie, Hôpital Haut-Lévêque, Pessac
Introduction. Les données de vraie vie sur l’utilisation du pomalidomide (POM) dans le myélome multiple en rechute/réfractaire (RRMM) sont limitées. MIROIR, une étude multicentrique, non interventionnelle a pour objectif de décrire l’efficacité et la tolérance du POM en pratique courante en France. Nous présentons ici les résultats d’une analyse intermédiaire préspécifiée à quatre ans.
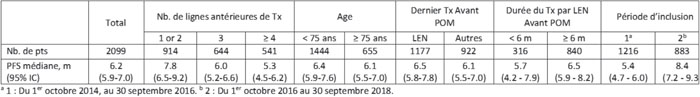
Matériels et méthodes. Cette analyse présente les résultats des patients (pts) inclus entre le 1er octobre 2014 et le 30 septembre 2018 et inclus dans le registre IMNOVID®, recevant pour la 1re fois POM. Les données sont collectées à partir des dossiers médicaux. Le critère principal est la survie sans progression (PFS) à six mois (m). Les critères secondaires principaux incluent le temps jusqu’au nouveau Tx (TTNT), la survie globale (OS) et la tolérance.
Résultats (tableau 1). Cette analyse a inclus 2 099 pts (suivi médian : 23,3 m, date de point : 1er février 2019). L’âge médian était de 70,0 ans et 655 pts (31,2 %) étaient âgés de ≥ 75 ans ; 1 134 pts (54,0 %) étaient des hommes. Le délai médian depuis l’initiation de la 1re ligne (L) de Tx à l’initiation du POM était de 51,4 m. Les pts ont reçu en médiane 3 L antérieures (min-max : 0-9), avec 914 (43,5 %), 644 (30,7 %), 312 (14,9 %) et 229 pts (10,9 %) recevant ≤ 2, 3, 4, et ≥ 5 L antérieures, respectivement. Presque tous les pts ont reçu préalablement lénalidomide (97,0 %) et bortézomib (96,7 %). POM a été initié à 4 mg/j chez 1 635 pts (77,9 %), chez 1 216 pts (84,2 %) âgés < 75 ans et 419 pts (64,0 %) âgés ≥ 75 ans. Dans la population globale, le taux de PFS à 6 m était de 51,7 % (95 % IC, 49,4 %-54,1 %). D’autres données de PFS chez des sous-groupes de pts sont rapportées dans le tableau. Le TTNT médian, le taux d’OS à 12 m, et l’OS médiane étaient de 10,4 m (95 % IC, 9,7-11,2), 70,6 % (95 % IC, 68,5-72,6), et 24,6 m (95 % IC, 22,9-NR), respectivement. Parmi les 1 164 pts (55,5 %) avec ≥ un événement indésirable (EI), les EI les plus fréquents étaient les neutropénies (290 pts ; 24,9 %), infections (263 pts ; 22,6 %), thrombopénies (99 pts ; 8,5 %), et l’asthénie (87 pts ; 7,5 %). La dose de POM a été réduite en raison d’un EI chez 20,7 % des pts. Le Tx par POM a été interrompu temporairement ou définitivement chez respectivement 36,2 % et 15,2 % des pts pour EI.
Conclusion. Cette analyse intermédiaire de l’étude MIROIR confirme l’efficacité de POM rapportée dans les essais cliniques et souligne son rôle en tant que Tx du RRMM. La PFS médiane chez les pts avec ≤ 2 L antérieures de Tx était plus longue que celle des pts qui ont eu davantage de L antérieures de Tx, plaidant pour une utilisation plus précoce du POM. Les bénéfices en PFS étaient similaires quelle que soit la durée de Tx par LEN (< ou ≥ 6 m) avant l’initiation du POM et quel que soit le dernier Tx reçu (LEN ou un autre Tx). Ces derniers résultats suggèrent que POM peut être utilisé après une rechute ou en cas de résistance au LEN et qu’il n’est pas nécessaire de remplacer un agent de la classe IMiD® par une autre classe thérapeutique. Les résultats de l’analyse à cinq ans seront présentés au congrès.
14-07
Pomalidomide + bortézomib + dexaméthasone après une ligne antérieure de traitement chez des patients atteints de myélome multiple prétraités par bortézomib : sous-analyse d’OPTIMISMM
T. Facon*1, MA. Dimopoulos2, K. Weisel3, P. Moreau4, L. Anderson5, D. White6, J. San-Miguel7, P. Sonneveld8, M. Engelhardt9, M. Jenner10, A. Corso11, J. Durig12, M. Pavic13, M. Salomo14, E. Casal15, R. Jiang16, S. Srinivasan16, T. Vi Nguyen17, A. Bensmaine18, T. Peluso19, P. Richardson20
1 Hématologie, CHU de Lille, Lille ; 2 Clinical therapeutics, Université d’Athènes, Athens, Grèce ; 3 Oncologie, University Medical Center Hamburg-Eppendorf, Hamburg, Allemagne ; 4 Service d’hématologie clinique, Hôtel-Dieu, Nantes ; 5 Médecine interne, hématologie/oncologie, UT Southwestern Medical Center, Dallas, États-Unis ; 6 Division of Hematology, Department of Medicine, Queen Elizabeth II Health Sciences Centre, Halifax, Canada ; 7 Médecine clinique et translationnelle, Clinique Universitaire de Navarra - CIMA - IdiSNA, Pamplona, Espagne ; 8 Service d’hématologie, Erasmus MC Cancer Institute, Rotterdam, Pays-Bas ; 9 Hématologie, Universitätsklinikum Freiburg, Freiburg im Breisgau, Allemagne ; 10 Hematology, Southampton General Hospital, Southampton, Royaume Uni ; 11 Hematology, Fondazione IRCCS - Policlinico San Matteo, Pavia, Italie ; 12 Hematology, University Hospital Essen, Essen, Allemagne ; 13 Centre de recherche clinique Etienne-le Bel (CRCELB), Faculté de médecine et des sciences de la santé, Sherbrooke, Canada ; 14 Hematology, Copenhagen University Hospital, Rigshospitalet, København, Danemark ; 15 Medical Affairs, Bristol-Myers Squibb, Summit, États-Unis ; 16 Bristol-Myers Squibb, Summit, États-Unis ; 17 Clinical R&D, Bristol-Myers Squibb, Summit, États-Unis ; 18 Clinical R&D, Celgene Internationnal, Boudry, Suisse ; 19 Clinical r&d, Celgene International, Boudry, États-Unis ; 20 The Lebow Institute for Myeloma Therapeutics and Jerome Lipper Myeloma Center, Institut du Cancer Dana-Farber, Faculté de Médecine d’Harvard, Boston, États-Unis
Introduction. Dans l’essai de phase 3 OPTIMISMM (NCT01734928), l’association pomalidomide (POM), bortézomib (BORT), et dexaméthasone (DEX ; PVd) a amélioré de manière significative la survie sans progression (PFS) vs BORT et DEX (Vd) chez des patients (pts) atteints de myélome multiple en rechute/réfractaire (RRMM) (100 % prétraités par lénalidomide [LEN] ; 70 % LEN- réfractaires ; 1-3 lignes antérieures de traitement [LdTx]). Ici, nous présentons l’efficacité et la tolérance d’une deuxième ligne avec PVd ou Vd après une 1re ligne LEN ± BORT, LEN et BORT étant souvent utilisés en 1re ligne dans le MM.
Matériels et méthodes. Les patients ont reçu (1:1) PVd ou Vd par cycles (C) de 21 jours (j) : POM 4 mg/j, J 1-14 (bras PVd uniquement), BORT 1,3 mg/m2, J1, 4, 8, et 11 des C1-8 et les J1 et 8 des C9+, et DEX 20 mg/j (10 mg/j si > 75 ans), le J de et celui d’après l’administration du BORT. Le Tx était poursuivi jusqu’à progression. Le critère principal était la PFS. Les pts BORT-réfractaires (définis comme réfractaires à une dose ≤ 1,3 mg/m2 de BORT 1×/semaine) étaient inclus.
Résultats. Au 26 octobre 2017, 226 (111 PVd ; 115 Vd) des 559 pts inclus ont reçu une LdTx antérieure ; 59,3 % ont reçu préalablement du BORT (67 PVd ; 67 Vd) et 40,7 % n’avaient pas reçu de Tx antérieur par BORT (44 PVd ; 48 Vd). Chez les pts ayant reçu un Tx antérieur par BORT, l’âge médian était de 63 ans dans le bras PVd vs 64 dans le bras Vd, 16,4 % vs 10,4 % étaient BORT-réfractaires, et 53,7 % vs 46,3 % étaient LEN-réfractaires, respectivement. Chez les pts sans Tx antérieur par BORT, l’âge médian était de 74 vs 70 ans et 63,6 % vs 70,8 % étaient LEN-réfractaires pour PVd vs Vd respectivement. Parmi les pts avec Tx antérieur par BORT, PVd a amélioré significativement la PFS (17,8 vs 12,0 mois [m] en médiane ; HR 0,47 [95 % IC, 0,26-0,82] ; P = 0,0068) vs Vd. Par ailleurs, les valeurs médianes des PFS n’ont pas changé après l’exclusion des pts BORT-réfractaires. Chez les pts sans Tx antérieur par BORT, la PFS médiane était de 20,7 m avec PVd vs 9,5 m avec Vd (HR 0,62 [95 % IC, 0,35-1,11] ; P = 0,1055). PVd a amélioré de manière significative l’ORR vs Vd : 89,6 % vs 49,3 %, P < 0,001 avec Tx antérieur par BORT et 90,9 % vs 62,5 %, P = 0,002 sans Tx antérieur par BORT. Les taux ≥ TBRP étaient 62,7 % vs 16,4 % et 59,1 % vs 31,3 %, respectivement. Le profil de tolérance a été évalué chez 131 pts avec Tx antérieur par BORT (67 PVd ; 64 Vd) et 90 pts sans Tx antérieur par BORT (44 PVd ; 46 Vd). Les neutropénies (44,8 % vs 10,9 % Tx antérieur par BORT ; 22,7 % vs 8,7 % sans BORT) et les thrombopénies (23,9 % vs 26,6 % Tx antérieur par BORT ; 13,6 % vs 13,0 % sans BORT) étaient les EI de grade 3/4 d’origine hématologique les plus fréquents avec PVd vs Vd, respectivement. Les infections de grade 3/4 sont survenues chez 26,9 % vs 15,6 % (pneumonies 7,5 % vs 4,7 %) des pts avec Tx antérieur par BORT et chez 31,8 % vs 15,2 % (pneumonies 11,4 % vs 6,5 %) des pts sans Tx antérieur par BORT. Les neuropathies périphériques sensitives de grade 3/4 survenaient chez 10,4 % vs 0 % et 6,8 % vs 8,7 % des pts, respectivement.
Conclusion. Après une LdTx antérieure, PVd a réduit de manière significative le risque de progression ou de décès de 53 % vs Vd chez des pts préalablement traités par BORT. Indépendamment d’un Tx antérieur par BORT, PVd a aussi amélioré l’ORR et a induit des réponses plus profondes vs Vd. En résumé, PVd est un Tx efficace de deuxième ligne chez des pts prétraités par BORT et LEN. La tolérance de PVd était conforme avec le profil de tolérance déjà connu de chaque molécule.
14-08
Données de vie réelle sur l’utilisation du carfilzomib (cfz) et de la dexaméthasone (dex) (Kd) selon le statut réfractaire au lénalidomide (len) : analyse intermédiaire d’une étude observationnelle prospective
X. Leleu*1, J. Caers2, B. Gamberi3, M. Söhne4, S. Heibl5, F. Suzan6, A. Mohammad7, S. Wetten8, E. Terpos9
1 Service d’hématologie et de thérapie cellulaire, CHU de Poitiers, Poitiers ; 2 Hématologie, CHU de Liège, Liège, Belgique ; 3 Hematology, Azienda USL IRCCS di Reggio Emilia, Reggio d’Émilie, Italie ; 4 Oncology, Hôpital Saint-Antoine, Nieuwegein, Pays-Bas ; 5 Médecine interne, Klinikum Wels-Grieskirchen, Standort Wels, Wels, Autriche ; 6 Clinical research, AMGEN, Boulogne-Billancourt ; 7 Biostatistics, Amgen, Denham, Royaume Uni ; 8 Observational research, Amgen, Denham, Royaume Uni ; 9 Department of Clinical therapeutics, Université d’Athènes, Athens, Grèce
Introduction. La prescription de schémas à base de lénalidomide (len) étant élargie au traitement (ttt) de 1re ligne du myélome multiple (MM), la fréquence des rechutes de MM réfractaires au len est préoccupante et requiert des ttt l’évitant. Données sur les associations sans len limitées en rechute précoce. Les résultats d’une cohorte en vie réelle de patients (pts) atteints de MM ayant reçu ≥ 1 ligne de ttt dont carfilzomib (cfz)-dexaméthasone (dex) (Kd) selon statut réfractaire au len (RL) sont décrits ici.
Patients et méthodes. Étude de cohorte prospective sur pts adultes avec MM en rechute ou réfractaire ayant reçu ≥ 1 dose d’un ttt avec cfz en pratique clinique courante. Administration de 56 mg/m2 2×/semaine : seul schéma Kd autorisé dans les pays participant. Pts classés RL si lors d’un ttt antérieur avec Len la meilleure réponse est la stabilisation ou la progression de la maladie ou si ttt arrêté pour progression ou/et la rechute/progression est survenue après la date d’instauration et dans les 60 jrs après la dernière dose de Len. Pts suivis pendant 18 mois après début ttt par cfz ou 30 jrs après dernière dose, selon la 1re occurrence.
Résultats. 69 % (n = 64) des 93 pts traités par Kd entre 14 mars 2017 et 22 octobre 2018 (date gel des données prévu pour analyse intermédiaire) RL à l’instauration de Kd. À l’instauration du cfz, âge médian de 70 ans pour population Kd globale et pts RL. Caractéristiques des pts, quand disponibles, similaires pour stade ISS ou score ECOG à l’instauration de Kd. Mais, selon données connues (18/93 pts), 8/9 pts à haut risque cytogénétique sont RL. Pts RL ont reçu 3,5 lignes de ttt en médiane vs 2 pour pts non-RL (NRL). Seuls trois pts RL sont en 1re rechute vs 10 patients NRL. 41 % des pts NRL exposés au Len. Délai depuis arrêt du ttt le plus récent plus court pour RL vs NRL : 0,8 vs 3,3 mois. Comorbidités comparables quel que soit le statut RL : 1/3 de pts hypertendus, 20 % d’affections cardiaques (arythmies cardiaques essentiellement) au diagnostic de MM. Taux (tx) de réponse globale (TRG) : 65 % RL vs 55 % NRL. Réponse minimale chez un pt RL et deux NRL, tx de bénéfice clinique comparable entre pts RL et NRL (67 % vs 65 %). Quel que soit le statut RL : très bonne réponse partielle ou mieux (TBRP+) chez 1/3 des pts. Administration Kd bihebdomadaire chez 92 % RL vs 93 % NRL. Pourcentage moyen de dose de cfz autorisée reçue légèrement inférieur chez RL vs NRL (71 % vs 79 %). Estimation de Kaplan-Meier de la durée médiane du ttt (IC95 %) plus courte RL vs NRL : 7,1 mois (5,1, 9,6) vs 9,5 mois (5,5, 19,0). Au moment de cette analyse, 39 % pts RL et 52 % pts NRL toujours traités. Pourcentage de pts ayant arrêté le cfz, pour maladie en progression/réfractaire, plus important chez RL vs NRL (51 % vs 29 %). Fréquence EI de grade 3 ou plus (Gr3+) comparable entre pts RL (38 %) et NRL (41 %). EI le plus souvent : infections (15 %) et affections hématologiques (10 %). Quatre des cinq événements cardiaques de Gr3+ rapportés chez pts RL, dont deux cas d’insuffisance cardiaque ayant motivé l’arrêt du cfz. Quatre des cinq événements fatals sont survenus chez pts RL.
Conclusion. Comparativement aux pts de l’étude ENDEAVOR sur Kd, cette cohorte Kd en vie réelle est plus âgée (médiane 70 vs 64 ans), a reçu Kd plus tard (nombre médian de lignes de ttt : 3 vs 2) et comprend plus de pts RL (69 % vs 24 %). Tx élevés d’arrêt pour événements fatals et cardiaques de Gr3+ observés chez pts RL qui ont reçu les ttts les plus lourds. Réponse au ttt similaire, quel que soit le statut RL et TRG (65 %) similaire à celui des pts Kd exposés au Len de ENDEAVOR ayant reçu 2-3 lignes de ttt. Kd : profil bénéfice/risque favorable pour cette cohorte en vie réelle et peut être une option thérapeutique permettant d’éviter le Len.
14-09
Comparaison entre la maladie résiduelle détectable par spectrométrie de masse dans le sang périphérique avec celle mesurée dans la moelle osseuse par cytométrie en flux chez les patients atteints de myélome multiple
M. Eveillard*1, E. Rustad2, M. Roshal3, Y. Zhang4, N. Korde2, M. Hultcrantz2, H. Hassoun2, E. Smith2, A. Lesokhin2, S. Mailankody2, O. Landgren2, K. Thoren1
1 Department of laboratory Medicine, Memorial Sloan-Kettering Cancer Center, New York, États-Unis ; 2 Myeloma service, Memorial Sloan-Kettering Cancer Center, New York, États-Unis ; 3 Department of Pathology, Memorial Sloan-Kettering Cancer Center, New York, États-Unis ; 4 Département of pathology, Memorial Sloan-Kettering Cancer Center, New York, États-Unis
Introduction. L’absence de maladie résiduelle détectable (MRD) dans le myélome multiple (MM) est associée à une survie sans progression plus longue. Différentes techniques sont disponibles pour détecter la MRD dans la moelle osseuse (MO), soit par cytométrie en flux (CMF) ou par séquençage de nouvelle génération. Mais ces techniques sont limitées car elles nécessitent un échantillon de MO adéquat obtenu par une procédure invasive. Ainsi, la détection de faibles niveaux de MRD dans le sang serait idéale et pourrait permettre la détection d’une maladie extramédullaire. Il a été démontré que les méthodes basées sur la spectrométrie de masse sont plus sensibles à la détection de protéines monoclonales (protéine M) dans le sérum. Dans cette étude, nous avons évalué la MRD par spectrométrie de masse (MALDI-TOF MS) dans le sang en parallèle avec celle issue de la MO en CMF.
Patients et méthodes. Cette cohorte a inclus 71 patients (26 femmes et 45 hommes) ayant des sérums congelés à deux temps, lors de la maladie active et dans les 60 jours proches des résultats de la MRD. Le délai médian entre le diagnostic et le point de MRD était de 13,4 mois (3,4-91 mois). L’analyse MALDI-TOF MS a été réalisée selon la méthode publiée par Mills et al. Les échantillons purifiés ont été mélangés à une matrice puis analysés à l’aide d’un spectromètre de masse Microflex LT MALDI-TOF (Bruker). Les points au diagnostic ont permis d’identifier le rapport masse/charge (m/z) de la protéine M et ont servi de marqueurs dans l’analyse des échantillons suivants. Les résultats de MALDI-TOF MS ont été comparés à ceux de CMF, utilisant un tube dix couleurs.
Résultats. MALDI-TOF MS a détecté une protéine M dans les 71 échantillons au diagnostic et dans 25 échantillons de MRD. Les résultats de MALDI-TOF-MS au moment de la MRD étaient concordants avec ceux de CMF pour 44/71 patients (p = 0,342). Huit patients étaient positifs et 36 négatifs par les deux techniques. Vingt-sept patients étaient discordants, dont 10 patients détectables uniquement par CMF et 17 détectables uniquement par MALDI-TOF MS. Parmi les 10 patients uniquement détectables par CMF, le niveau médian de MRD était de 0,00092 % (+ < 0,0001%-0,011 %). En ce qui concerne les 17 patients positifs uniquement par MALDI-TOF-MS, l’échantillon de MO n’était pas optimal pour trois patients en raison de l’hémodilution. Alternativement, le résultat de MALDI-TOF pourrait être un faux positif en termes de détection de la maladie. En effet, l’immunofixation était également positive pour 11/17 de ces échantillons. Cependant, de faibles niveaux de protéine M peuvent ne pas indiquer la présence d’une maladie active mais être liés à la demi-vie.
Quarante-huit des 71 patients étaient nouvellement diagnostiqués et en rémission complète (RC) au moment de la MRD avec un suivi médian de 11 mois. Parmi ces 48 patients, deux des trois qui étaient positifs par les deux techniques ont rechuté pendant le suivi. Un patient sur 27 qui était négatif par les deux techniques a rechuté. Aucun des 10 patients positifs uniquement par MALDI-TOF n’a rechuté et un des huit patients positifs uniquement par CMF a rechuté.
Conclusion. Cette étude est une première étape pour comprendre comment utiliser un test sanguin plus sensible pour le suivi des patients atteints de MM. La spectrométrie de masse peut fournir des résultats complémentaires à ceux obtenu dans la MO, en particulier pour le suivi des patients en RC et pendant le traitement d’entretien pour détecter les mauvais répondeurs qui seraient positifs par les deux techniques.
14-10
Le vénétoclax induit des réponses maintenues et profondes chez des patients atteints d’amylose AL réfractaires ou en rechutes
H. Pasquer*1, F. Lemonnier1, J. Dupuis1, S. Oghina2, D. Bodez2, A. Ladaique3, A. Maarek1, L. Roulin1, A. Beldi-Ferchiou4, F. Valérie4, C. Haioun1, T. Damy2, K. Belhadj1, F. Le Bras1
1 Hémopathies lymphoïdes, Hôpital Henri-Mondor AP-HP, Créteil ; 2 Cardiologie, Hôpital Henri-Mondor AP-HP, Créteil ; 3 Pharmacie, Hôpital Henri-Mondor AP-HP, Créteil ; 4 Laboratoire d’immunologie et d’hématologie, Hôpital Henri-Mondor AP-HP, Créteil
Introduction. Le vénétoclax (VEN) est un inhibiteur de la protéine antiapoptotique BCL-2 biodisponible par voie orale. Il a une efficacité dans le myélome multiple (MM), principalement chez les patients porteurs d’une translocation t(11;14). Environ 50 % des patients atteints d’amylose AL présentent une t(11;14), faisant du VEN une option thérapeutique intéressante dans cette maladie.
Patients et méthodes. Nous rapportons ici les résultats d’une analyse rétrospective d’une série monocentrique de patients (pts) avec une amylose AL réfractaires/en rechute (R/R), multitraités. VEN a été administré quotidiennement seul ou en association avec de la dexaméthasone (DEX), avec ou sans bortézomib (BTZ). Le traitement devait être administré jusqu’à progression.
Résultats. Entre février 2017 et janvier 2020, 10 pts R/R consécutifs ont été traités. Leur âge médian était 71 ans (extrêmes 40-84). Le nombre médian d’atteinte d’organes était deux (1-4), 9/10 patients ayant une atteinte cardiaque. Celle-ci était, selon la classification de la Mayo Clinic modifiée, de stade un pour deux pts, de stade IIIA pour 2, de stade IIIB pour quatre et de stade IIIC pour deux pts. Trois patients avaient un MM concomitant au diagnostic, et une translocation t(11;14) était présente chez sept pts, absente chez deux et indéterminée pour un pt (échec). Les patients avaient reçu en médiane trois (2-4) lignes antérieures, et avaient tous reçu du BTZ et du DARA. La meilleure réponse au DARA était une progression pour un pt, une maladie stable pour trois pts, une réponse partielle pour cinq pts et une très bonne réponse partielle pour un pt. Sept patients ont reçu une association de VEN-BTZ-DEX comme décrit dans le MM (PMID : 28847998), deux ont reçu une association de VEN et DEX et un en monothérapie. Cinq pts ont reçu 400 mg/jour, quatre 200 mg/jour et 1 100 mg/jour. La durée médiane du traitement était de 189 jours (31-1 028). Quatre patients sont encore sous traitement et les six autres l’ont arrêté (trois pour progression, un pour intolérance et un décédé après un cycle d’une infection grippale). Huit patients ont reçu au moins deux cycles et étaient évaluables pour la réponse. Deux patients ont reçu un seul cycle de traitement. Une très bonne réponse hématologique (VGPR) est survenue chez 5/8 (62,5 %) des pts, avec un délai médian de réponse de 40 jours (18-63). 4/6 pts répondeurs sont encore sous traitement avec une médiane de 241 jours de réponse. Sur les six patients répondeurs, cinq d’entre eux présentaient une translocation t(11;14). Un pt (12,5 %) a présenté une réponse partielle, un pt (12,5 %) une maladie stable et un pt (12,5 %) une maladie progressive. Le principal effet secondaire survenu sous traitement était une diarrhée de grade 2 chez quatre pts.
Conclusion. Le VEN utilisé en monothérapie ou en association peut induire une réponse de bonne qualité et prolongée chez des patients atteints d’amylose réfractaire ou en rechute après BTZ et DARA, avec un profil de sécurité acceptable.
14-11
Caractéristiques et prise en charge thérapeutique des patients atteints d’un myélome multiple en rechute ou réfractaire en France Une étude de cohorte avec les données du système national des données de santé
C. Touzeau1, G. Désaméricq2, V. Taieb3, JV. Chauny2, J. Meng4, H. Jiang5, N. Quignot*5, A. Khachatryan6
1 Hématologie clinique, CHU Nantes, Crcina, Inserm, CNRS, Université d’Angers, Université de Nantes, Nantes ; 2 Accès au marché et affaires publiques, Amgen SAS, Boulogne-Billancourt ; 3 Global Health Economics, Amgen Ltd, Londres, Royaume Uni ; 4 Data analytics, Certara Evidence & Access, Lorrach, Allemagne ; 5 Data analytics, Certara Evidence & Access, Paris ; 6 Pharmacoépidémiologie, Certara Evidence & Access, Londres, Royaume Uni
Introduction. Au cours des 15 dernières années, plusieurs médicaments ont été mis sur le marché pour le traitement du myélome multiple en rechute ou réfractaire (MMRR), avec plusieurs combinaisons très efficaces approuvées ces trois dernières années. Cette étude décrit les caractéristiques et la prise en charge thérapeutique des patients atteints d’un MMRR bénéficiant de ces nouvelles associations en pratique réelle en France.
Patients et méthodes. Cette étude de cohorte rétrospective a été conduite à partir des données du système national des données de santé (SNDS). Les patients adultes atteints de MM (code CIM-10 [C90]), ayant été traités par au moins un des médicaments d’intérêt (bortézomib BOR, carfilzomib CAR, daratumumab DAR, ixazomib IXA, Lénalidomide LEN, pomalidomide POM, élotuzumab ELO) entre 2014 et 2018 et ayant reçu au moins deux lignes de traitement, ont été suivis jusqu’à leur décès ou la fin de l’étude, le 31 décembre 2018. Les lignes de traitement étaient définies en fonction des remboursements, en considérant que les médicaments d’une combinaison doivent être initiés dans un intervalle de 90 jours ou moins.
Résultats. Entre 2014 et 2018, 17 552 patients (âge moyen 65 ± 11 ans, 54 % d’hommes) atteints d’un MMRR et traités par au moins un médicament d’intérêt ont été identifiés, parmi lesquels 74 %, 55 % et 33 % ont été traités par une deuxième ligne (2L), une troisième ligne (3L) ou une quatrième ligne ou plus (4L+) de traitement, respectivement. 4 642 patients (26 %) ont reçu une autogreffe de cellules souches hématopoïétiques en première ligne de traitement (1L). Ces patients autogreffés étaient globalement plus jeunes (âge moyen 57 ± 8 ans vs 68 ± 10 ans pour les patients n’ayant pas reçu d’autogreffe en 1L).
Les traitements de 2L majoritairement utilisés étaient le LEN (54 % des patients, dont 91 % avaient reçu le BOR en 1L) puis le BOR (19 % des patients, dont 34 % avaient reçu le BOR + LEN en 1L). Les traitements de 3L les plus fréquemment utilisés étaient le POM (25 %) et le BOR (24 %). Chez les patients ayant été autogreffés en 1L, le traitement de 2L le plus fréquemment utilisé était le même que pour les non autogreffés (LEN, 55 % des patients autogreffés vs 53 % des patients non autogreffés) ; le second plus fréquent était la combinaison BOR + LEN (22 %) vs le BOR pour 24 % des patients non autogreffés. Le BOR était le traitement le plus couramment utilisé en 3L chez les patients autogreffés (25 %), suivi du POM (19 %), alors que chez les patients non autogreffés le POM était le plus couramment utilisé (28 %), suivi du BOR (24 %).
Au cours du suivi (durée moyenne 1,6 ± 1,3 ans), 44 % des patients sont décédés (taux de mortalité de 15/100, 27/100 et 51/100 personnes-années pour les patients recevant un traitement de 2L, 3L ou 4L+, respectivement). La mortalité était plus élevée pour les patients non autogreffés (N = 9 533) (taux de 30/100 personnes-années vs 17/100 personnes-années pour les patients autogreffés (N = 3 454)).
Conclusion. Les résultats illustrent les stratégies de traitement utilisées pour les patients atteints d’un MMRR entre 2014 et 2018, reposant essentiellement sur le LEN, le BOR et le POM. Il est nécessaire de souligner que les médicaments les plus récents pour cette indication n’ont été mis sur le marché français que depuis peu. Ainsi, seulement un nombre limité de patients en avaient l’accès durant la période d’étude. L’amélioration de la prise en charge médicamenteuse du MMRR devrait permettre de diminuer la mortalité associée.
14-12
Efficacité et tolérance de carfilzomib-lénalidomide-dexaméthasone dans le traitement du myélome multiple nouvellement diagnostiqué : analyse poolée de quatre études monobras
M. Roussel*1, O. Landgren2, M. Attal3, D. Kazandjian4, J. Jasielec5, D. Dytfeld6, A. Anderson7, T. Kervin7, K. Iskander8, K. Mezzi9, T. Welliver9, A. Yusuf8, A. Jakubowiak10
1 Hématologie, IUCT Oncopole, Toulouse ; 2 Hematology, Memorial Sloan-Kettering Cancer Center, New York, États-Unis ; 3 Hématologie, IUCT Oncopole, Toulouse ; 4 Oncology, National Cancer Institute, NIH, Bethesda, États-Unis ; 5 Hematology, UChicago Medicine, Chicago, États-Unis ; 6 Oncology, Université de médecine Karol Marcinkowski, Poznań, Pologne ; 7 Statistics, Statistics Collaborative, Washington, États-Unis ; 8 Medical, Amgen, Thousand Oaks, États-Unis ; 9 Biostatistics, Amgen, Thousand Oaks, États-Unis ; 10 Faculté de médecine de chicago, The University of Chicago, Chicago, États-Unis
Introduction. Carfilzomib (K) est un inhibiteur du protéasome de deuxième génération autorisé en monothérapie et en association au lénalidomide (len) et à la dexaméthasone (dex) (KRd) ou à la dexaméthasone seule pour le ttt du myélome multiple en rechute et/ou réfractaire. KRd n’est pas autorisé pour le ttt du myélome multiple nouvellement diagnostiqué (MMND), mais son efficacité et sa tolérance ont été montrées dans quatre études de phase un et deux indépendantes initiées par leur investigateur. Mais, ce sont des études mono-bras avec très peu de patients (pts). L’analyse combinée des données de ces pts permet d’évaluer globalement les résultats cliniques obtenus sous KRd, et de poursuivre l’étude de l’efficacité et la tolérance de KRd dans le MMND.
Patients et méthodes. Données des pts de trois études mono-bras de phase un et deux sur le ttt du MMND par KRd combinées (trois aux États-Unis et un en France) ; trois des quatre études sont multicentriques. Pts traités par cycles de 28 jrs : K (20/36 mg/m2 J1, 2, 8, 9, 15 et 16), len (25 mg/j, J1-21) et dex (20-40 mg/semaine). Critère évaluation principal : estimation du taux (tx) de très bonne réponse partielle ou mieux (≥ TBRP). Critères secondaires : tx de réponse globale (TRG), tx de réponse complète ou mieux (≥ RC), survie sans progression médiane (SSP), SSP à différents temps de référence et tolérance. L’analyse des tx de réponse sur la meilleure réponse globale pour les RC strictes, RC, TBRP ou RP est rapportée dans chaque étude. Pts répartis dans deux cohortes : ceux ayant reçu une greffe de cellules souches (CS) et ceux non greffés.
Résultats. Cohorte un : 122 pts (âge moyen de 57,1 ans, 63 % d’hommes, ISS I : 46 %, ISS II : 37 %, ISS III : 11 %, pts à haut risque cytogénétique : 25 %). 93 % des pts avec ≥ TBRP (IC95 % : 89 %, 98 %), 79 % des pts avec ≥ RC (IC95 % : 72 %, 86 %). Tous les pts ont obtenu au moins une ≥ RP. SSP à un et deux ans de 95 % (IC95 % : 89 %, 98 %) et 88 % (IC95 % : 80 %, 93 %). Le suivi limité des pts après deux ans n’a pas permis d’estimer la SSP. 109 pts (89 %) ont rapporté au moins un événement indésirable apparu au cours du traitement (EIAT) de grade 3 ou 4. EIAT d’intérêt de grade 3 ou 4 : insuffisance rénale aiguë (2 %), insuffisance cardiaque (2 %) et hypertension (2 %). Cohorte 2 : 99 pts (âge moyen de 60,9 ans, 67 % d’hommes, ISS I : 44 %, ISS II : 39 %, ISS III : 19 %, pts à haut risque cytogénétique : 35 %). 90 % des pts avec ≥ TBRP (IC95 % : 84 %, 96 %). TRG de 98 % (IC95 : 95 %, > 99 %), tx de ≥ RC de 71 % (IC95 % : 62 %, 80 %). SSP à un et deux ans de 95 % (IC95 % : 90 %, 98 %) et 85 % (IC95 % : 76 %, 90 %). Le suivi limité des pts après deux ans n’a pas permis d’estimer la SSP. 91 pts (92 %) ont rapporté au moins un EIAT de grade 3 ou 4. EIAT d’intérêt de grade 3 ou 4 : neuropathie périphérique (1 %), insuffisance rénale aiguë (4 %), insuffisance cardiaque (3 %) et hypertension (5 %). Les résultats concernant l’efficacité et la tolérance concordent entre les différentes études.
Conclusion. Les résultats de cette étude montrent des réponses profondes et durables. KRd peut être une option thérapeutique efficace, de tolérance acceptable pour les pts avec un MMND, qu’ils aient ou non été greffés. Ces résultats prometteurs doivent être confrontés à ceux des schémas conventionnels.
14-13
Dosage des chaînes légères libres sériques : comparaison et évaluation de la technique ELISA de Sebia® versus FreeLite® de The Binding Site
B. Thomas*, A. Gentilhomme, K. Jérémy, C. Franczak
Laboratoire, Hôpital Robert Schuman - HPMetz, Vantoux
Introduction. L’IMGW a intégré en 2014 dans sa définition de myélome multiple le ratio de chaînes légères libres impliquées (CLLi)/ chaînes légères libres non impliquées (CLLni) avec un seuil de 100. Dans ces recommandations, les dosages des chaînes légères libres doivent être établis en utilisant le réactif FreeLite® de The Binding Site®. Récemment, le fournisseur SEBIA® a commercialisé une technique de dosage basé sur la méthode ELISA. Les variabilités intrinsèques de l’analyte (polymérisation notamment) engendrent une forte influence de la technique utilisée pour le dosage. Les valeurs normales de ces deux techniques sont similaires (ratio Kappa/Lambda 0,37-1,44) pour l’ELISA et 0,26-1,65 pour FreeLite®) mais une étude récente propose un seuil d’équivalence du ratio CLLi/CLLni à 100 en Freelite à 16 en ELISA 2019 (Caillon et al).
Nous avons réalisé une étude prospective au laboratoire des hôpitaux privés de Metz, comparant, pendant six mois, pour tous les dosages de chaînes légères libres, les résultats obtenus avec les deux techniques afin d’évaluer la pertinence de la mise en place de la technique ELISA au laboratoire.
Matériels et méthodes. Durant six mois, plus de 220 patients ont été inclus avec la réalisation de plus de 350 dosages. Les dosages Freelite® ont été réalisés dans un laboratoire sous-traitant (automate Optilite®), les dosages ELISA au sein du laboratoire (automate DAS®). Les résultats ont été exprimés en ratio CLLi/CLLni et étudiés à deux valeurs seuils : valeur de référence et valeurs de l’IMWG et de l’équivalence proposée. En cas de discordance, les données ont été confrontées au contexte clinicobiologique.
Résultats :Répartition des résultats du ratio CLLi/CLLni sur les deux techniques en fonction de la valeur de référence de chaque technique Ratio CLLi/CLLni Résultat en FreeLite® < 1,65 Résultat en FreeLite® ≥ 1,65 Résultat en ELISA : < 1,44 37 % 13 % Résultat en ELISA : ≥ 1,44 4 % 46 % Répartition des résultats du ratio CLLi/CLLni sur les deux techniques en fonction de la valeur de l’IMWG et du seuil d’équivalence proposé Ratio CLLi/CLLni Résultat en FreeLite® < 100 Résultat en FreeLite® ≥ 100 Résultat en ELISA : < 16 83 % <1% Résultat en ELISA : ≥ 16 6 % 10 %
Discussion. La comparaison avec les seuils de références donne une concordance à 83 %. Les discordances restent très modérées. La comparaison avec pour seuil la valeur de l’IMWG et du seuil d’équivalence proposé montre une cohérence à 93 % mais fait apparaître quelques discordances significatives (> 16 en ELISA mais < 100 en FreeLite).
Conclusion. Bien que les dosages ne soient pas directement comparables entre les deux techniques, les résultats montrent une très bonne cohérence. Après concertation clinicobiologique, la technique ELISA Sebia® a été implantée au sein du laboratoire mais un recours au dosage Freelite® pourra être effectué en cas de besoin.
14-14
Intérêt de la consolidation sur la survie au cours du myélome multiple : Expérience de l’EHU Oran
B. Mansour1, H. Ouldjeriouat1, B. Entasoltan1, S. Bouchama1, L. Charef1, K. Amani1, N. Hakiki2, F. Serradj2, F. Bouamama2, N. Yafour1, S. Osmani1, A. Arabi1, M. Brahimi1, R. Bouhass1, A. Bekadja*1
1 Hématologie et thérapie cellulaire, établissement hospitalier universitaire 1er-Novembre, Oran, Algérie ; 2 Hématologie et thérapie cellulaire, EHU 1er-Novembre, Oran, Algérie
Introduction. Le concept de la consolidation postinduction a été appliqué initialement dans les leucémies aiguës afin d’améliorer la survie sans rechute et la survie globale.
Ce concept a été élargi par la suite aux autres hémopathies malignes et en particulier le myélome multiple (MM) afin d’en augmenter les taux de réponse et la profondeur de la maladie résiduelle.
Cependant, la consolidation a longtemps fait l’objet de controverses, jusqu’à ce quelle soit admise de façon définitive, actuellement dans la stratégie thérapeutique du MM.
L’objectif de ce travail est d’évaluer dans la vraie vie, l’apport de la consolidation, sur la rechute, la survie sans événement (SSE) et la survie globale (SG) dans le MM au niveau de l’EHU Oran.
Patients et méthodes. Il s’agit d’un travail rétrospectif sur une période de 10 ans (2009-2018). Deux périodes ont été identifiées, la 1re de 2009 à 2013 au cours de laquelle, les patients n’ont pas reçu de consolidation et la seconde de fin 2013 à 2018 et où les patients ont reçu une consolidation. Le traitement d’induction a comporté les associations suivantes : VD (n = 52), VCD (n = 21), VTD (= 30) et VRD (n = 2) suivi d’une autogreffe de CSH, au cours de la 1re période, et VD (n = 14), VCD (n = 68), VTD (n = 95) et VRD (n = 4), autogreffe VD ou VCD ou VTD, deux cycles, au cours de la deuxième période. L’évaluation a porté sur les taux de rechute, la SSE et la SG aux cours de ces deux périodes.
Résultats. Aux cours de cette période (2009-2018), 286 patients sont évaluables pour l’étude. Le taux global de rechute pour la cohorte entière est de 28 % (n = 81) avec une médiane de SSE de 61 mois et une SG de 79 % à 71 mois. La 1re période (n = 105 patients), sans consolidation, est caractérisée par un taux de rechute de 51 % (n = 54), une médiane de SSE de 36 mois (24,9-47,03) et une SG de 66 % à 117 mois. La deuxième période (n = 181 patients) est caractérisée par un taux de rechute de 15 % (n = 27) (p < 0,0001), une SSE de 72 % à 61 mois (p = 0,0001) et une SG de 94 % à 90 mois (p = 0,0001).
Discussion. La valeur de ce travail, bien que rétrospectif, non contrôlé et non randomisé, montre un taux de rechute significativement faible après un traitement de consolidation (p < 0,0001), ainsi que des durées de SSE et de SG plus importantes (p = 0,0001). Par ailleurs, les résultats, du groupe de consolidation, sont obtenus malgré l’hétérogénéité du traitement d’induction (VD, VCD, VTD) et du traitement de consolidation (VD, VCD, VTD), ce qui dénote que la consolidation en elle-même est bénéfique sur la SSE et la SG. Nos résultats sont similaires à ceux des études académiques portant sur la consolidation avec respectivement des taux de rechutes de 45 % (pas de consolidation) versus 21 % (avec consolidation) (p = 0,0001) (1) ainsi qu’un taux de rechute de 53 % et une médiane de PFS de 26 mois dans une étude sans consolidation.
Conclusion. Ainsi, nos résultats obtenus dans la vraie vie, montrent un intérêt indiscutable de la consolidation aussi bien en termes de rechute qu’en termes de survies, en postautogreffe au cours du MM.
14-15
Impact pronostic de la rechute précoce à l’ère des nouveaux agents, sur la survie en postautogreffe au cours du myélome multiple dans la vraie vie : expérience de l’EHU 1er-Novembre Oran
B. Mansour1, H. Ouldjeriouat1, B. Entasoltan1, S. Bouchama1, L. Charef1, K. Amani1, N. Hakiki2, F. Serradj2, F. Bouamama2, N. YAFOUR1, S. Osmani1, M. Brahimi1, A. Arabi1, R. Bouhass1, A. Bekadja*1
1 Hématologie et thérapie cellulaire, Établissement Hospitalier Universitaire 1er-Novembre, Oran, Algérie ; 2 Hématologie et thérapie cellulaire, EHU 1er-Novembre, Oran, Algérie
Introduction. Des progrès notables ont été réalisés en termes de réponse et de survie au cours du myélome multiple (MM) à l’ère des nouveaux agents associés à l’autogreffe, mais malheureusement, à ce jour, la rechute demeure inéluctable. Cependant, peu de travaux ont porté sur les rechutes et en particulier les rechutes précoces. L’objectif de ce travail est d’analyser la rechute précoce dans la vraie vie et d’évaluer son impact sur la survie globale (SG).
Patients et méthodes. Il s’agit d’une étude rétrospective, portant sur une période de 10 ans (2009-2018), chez des patients atteints de MM et ayant fait l’objet d’une rechute. Tous les patients ont reçu un traitement d’induction (VD = 61 ; VCD = 95 ; VTD = 135 ; VRD = 7, CTD = 09) suivi d’une autogreffe de CSH (Melphalan 200 mg/m2) et un traitement d’entretien (thalidomide 50 mg/j pendant 12 mois) variable. Deux groupes de patients ont été identifiés selon la durée de la rechute, ≤ 24 mois (précoce, G1) ou > 24 mois (tardive, G2) dans lesquels ont été calculées leurs SG respectives. Par ailleurs, des facteurs prédictifs de rechute précoce ont été recherchés pouvant être utilisés comme facteurs pronostics.
Résultats. Sur une période de 10 ans, 307 patients évaluables ont été colligés dont 93 (30 %) ont présenté une rechute, parmi lesquels, 56 précoces (18 %) (G1) et 37 tardives (12 %) (G2). Les durées médianes de rechute sont respectivement de 12 mois (6-24) et 36 mois (25-116) dans G1 et G2. Dans G1, la médiane de suivi est de 30 mois (4-93 mois) et de 70 mois (29-117 mois) dans G2. La médiane de SG est de 31 mois dans G1 et n’est pas atteinte dans G2 avec une probabilité de survie de 82 % à 117 mois (p = 0,001). En analyse univariée, l’âge (p = 0,003), le PS > 1 (p = 0,036), le taux de LDH > normale (p = 0,002), l’ISS3 et l’entretien sont retrouvés comme facteurs prédictifs de rechute précoce. En analyse multivariée, seuls, le délai de greffe ≤ 12 mois (p = 0,02) et l’absence de traitement d’entretien (p = 0,002) sont retrouvés comme prédictif de rechute précoce.
Discussion. Notre travail, bien que rétrospectif, montre un taux de rechute précoce similaire à celui retrouvé dans les essais cliniques, 18 % versus 16 % ainsi qu’une même durée médiane de rechute 12 mois versus huit mois (1) et des médianes de SG, également semblables, 31 mois versus 21 mois (1). Le facteur prédictif de rechute précoce commun, retrouvé en analyse multivariée, est l’absence de traitement d’entretien (p = 0,002). Dans notre étude, la del(17p) et la t(4;14) n’ont pas été recherchées de façon systématique, et donc n’ont pas été inclus dans les analyses.
Conclusion. Dans la vraie vie, comme dans les essais cliniques académiques, la rechute précoce impacte négativement la SG dans le MM. Les facteurs prédictifs retrouvés vont permettre d’adapter la stratégie thérapeutique.
14-16
Facteurs prédictifs de thrombose au cours de la prise en charge du myélome multiple : expérience de l’EHU Oran
B. Mansour1, H. Ouldjeriouat1, B. Benzineb2, B. Entasoltan1, S. Bouchama1, L. Charef1, K. Amani1, N. Hakiki3, F. Serradj3, F. Bouamama3, N. YAFOUR1, S. Osmani1, A. Arabi1, R. Bouhass1, M. Brahimi1, A. Bekadja*1
1 Hématologie et thérapie cellulaire, Établissement Hospitalier Universitaire 1er-Novembre, Oran, Algérie ; 2 Hématologie, chutlemcen faculte de médecine Tlemcen, Tlemcen, Algérie ; 3 Hématologie et thérapie cellulaire, EHU 1er-Novembre, Oran, Algérie
Introduction. Le risque de thromboses veineuses profondes (TVP) ou artérielles au cours des cancers est estimé à plus de 7 %. Ce risque est plus élevé au cours des hémopathies malignes, en particulier au cours du myélome multiple (MM) (1).
L’objectif de notre travail est d’évaluer d’une part l’incidence de la thrombose et en particulier de la TVP au cours du MM dans notre service, mais également d’en rechercher les facteurs prédictifs au cours de la procédure d’autogreffe de CSH.
Patients et méthodes. Il s’agit d’une étude mono centrique, rétrospective, portant sur une période de 10 années (mai 2009-30 novembre 2019). Les données ont été recueillies à partir des dossiers des patients. Le diagnostic de thrombose est posé devant des signes et des symptômes cliniques de thrombose et confirmé par un écho doppler du site de localisation concerné ou un angioscanner, en cas de suspicion d’une embolie artérielle ainsi que l’élévation des D-Dimères. L’évaluation a porté sur l’incidence globale des TVP et la détermination des facteurs prédictifs de TVP au cours de l’induction et de la procédure d’autogreffe. L’analyse statistique en uni variable et en multivariable a porté sur les facteurs suivants : âge, les comorbidités, l’utilisation des IMiDS, l’utilisation du G-CSF en mobilisation et en phase d’aplasie, le site d’insertion du KT central, le nombre de cytaphérèse, le taux de CD34+ perfusé et enfin, la prophylaxie de la TVP par une HBPM, à l’aide du logiciel SPSS version 20.
Résultats. 411 patients atteints de MM ont subi une autogreffe durant la période d’étude de 10 années dont 238 hommes et 173 femmes avec un sex-ratio de 1,37. L’incidence globale de la thrombose pour l’ensemble des patients est estimée à 18,49 % (76 pts). Les facteurs étudiés tels l’âge, les comorbidités, l’utilisation des IMiDS, le site d’insertion du KTC ou le nombre de cytaphérèses, ne présentent pas de caractère prédictif de thrombose, par contre, les facteurs retrouvés en analyse uni variable sont la prophylaxie antithrombotique (p = 0,002), le nombre de CD34+ perfusées ≤ ou > 5 × 106/kg (p = 0,012), l’utilisation du G-CSF en phase d’aplasie (p = 0,011) ainsi que la durée d’insertion du KTC (p = 0,026).
En analyse multivariée, les facteurs retrouvés sont le nombre de CD34+ perfusées ≤ ou > 5 × 106/kg (p = 0,026) et la prophylaxie avec les HBPM (p = 0,029).
Discussion. L’incidence globale de thrombose dans notre pratique courante et dans la vraie vie au cours du MM est semblable à celle rapportée dans la littérature (1-4). La prophylaxie par HBPM est indispensable dans sa prévention comme l’atteste l’analyse multivariée.
Conclusion. La thrombose au cours du MM est une complication relativement fréquente au vu des nombreux facteurs la prédisposant, tels que les médicaments (dexaméthasone, bortézomide, IMiDS ou G-CSF), l’alitement, ou les dispositifs intraveineux ou artériels. Tout cela justifie une prophylaxie par les HBPM.
14-17
Modes de présentation et évolution du myélome multiple compliqué d’une insuffisance rénale Analyse d’une série de 57 cas
Z. El Hazaz, W. Ammouri*, H. Khibri, N. Mouatassim, M. Bouaouad, M. Maamar, H. Harmouche, Z. Tazi Mezalek, M. Adnaoui
Service de médecine interne/hématologie clinique, CHU Ibn Sina, Faculté de médecine et de pharmacie, Université Mohammed V, Rabat, Maroc
Introduction. Le myélome multiple est caractérisé par la prolifération clonale de plasmocyte envahissant la moelle hématopoïétique et responsable de la sécrétion d’une immunoglobuline monoclonale. La présentation clinique est variable et l’atteinte rénale est présente dans 50 % des cas. Le but de ce travail est d’étudier les caractéristiques épidémiologiques, cliniques, thérapeutiques et évolutives des patients présentant un myélome multiple avec atteinte rénale.
Patients et méthodes. Il s’agit d’une étude rétrospective étalée entre janvier 2012 et décembre 2018 dans le service de médecine interne et hématologie clinique du CHU Ibn Sina, Rabat, portant sur 146 patients présentant un myélome multiple. Les critères d’inclusion étaient : tous les patients âgés de plus de 18 ans chez qui le diagnostic de myélome multiple a été retenu selon les critères de l’IMWG et ayant une clairance de créatinine < 60 mL/min, calculée selon la formule de Cockroft.
Résultats. Au total, 57 cas de myélome multiple avec atteinte rénale ont été colligés. Le taux de la prévalence de l’insuffisance rénale dans le myélome multiple était de 40 %. L’âge moyen des patients était de 61,4 ans [48-82] avec une nette prédominance masculine (sex-ratio 8,5). Le délai de consultation était de 6,4 mois devant une symptomatologie dominée par les douleurs osseuses (75 %). Une symptomatologie rénale était révélatrice dans 10 (18 %) cas. Il s’agissait d’une insuffisance rénale sévère avec une clairance de créatinine < 30 mL/min dans 16 (28 %) cas et d’une insuffisance rénale terminale avec une clairance de créatinine < 15 mL/min dans 15 (26 %) cas. Cinq (11 %) patients bénéficiaient de séances d’hémodialyse au moment du diagnostic. Une ponction biopsie rénale a été réalisée chez trois (5 %) patients objectivant une tubulopathie myélomateuse dans trois cas (amylose AL associée dans un cas). Concernant le profil de l’immunoglobuline monoclonale, il s’agissait d’un myélome multiple à IgG dans 33 % des cas, à IgA dans 21 % et un myélome à chaînes légères dans 33 % des cas. 87 % des patients étaient classés stade III selon la classification ISS, 15 % étaient en stade II et 2 % étaient en stade I. La recherche de facteurs cytogénétiques de mauvais pronostic par FISH a été réalisée chez 12 (21 %) % des cas. Ella a objectivé une t(4;14) dans deux cas et un caryotype complexe dans un cas. Sur le plan thérapeutique, 43 (77 %) patients ont reçu une chimiothérapie : CTD chez 20 (45 %) cas, RD dans un cas, VCD dans un cas et VTD dans 10 (23 %) cas. Cinq (11 %) patients ont bénéficié d’une autogreffe de cellules souches hématopoïétiques. Selon les critères de réponse rénale de l’IMWG, huit (18 %) patients étaient en réponse rénale complète et 3 (7 %) patients étaient en réponse rénale minime. Au total, 11 (23 %) patients étaient en VGPR pour le myélome multiple avec médiane de survie de 36 mois et 41 (72 %) décès étaient notés, dont 11 (20 %) avant le début du traitement.
Conclusion. L’atteinte rénale au cours du myélome multiple est une complication souvent associée à une morbimortalité importante. Notre série se caractérise par la survenue du myélome chez une population jeune. Le caractère inaugural de l’insuffisance rénale chez nos patients reflète la sévérité de la présentation clinique initiale ainsi qu’un retard diagnostic important. Les patients ayant récupéré leur fonction rénale présentaient une insuffisance rénale modérée avec une clairance de créatinine entre 30 et 60 mL/min ainsi qu’une hypercalcémie importante. Les résultats de l’étude confirment le pronostic sombre de ce profil de patients.
14-18
Autogreffe de cellules souches hématopoïétiques non cryopréservées dans le myélome multiple
S. Oukid*1, C. Guezlane1, F. Lamraoui1, S. Taoussi1, Y. Bouchakor Moussa1, N. Rekab1, KM. Benlabiod1, M. Mezroud.2, A. Rebouh.2, A. Ziani.2, MT. Abad1, M. Bradai1
1 Service hématologie, EHS ELCC CAC. Université Blida 1, laboratoire de recherche sur les hémopathies malignes et les hémoglobinopathies, faculté de médecine, b.p 270, route, Soumaa, Blida, Algérie ; 2 Service hématologie, EHS ELCC CAC, Blida, Algérie
Introduction. Classiquement l’autogreffe à partir des cellules souches hématopoïétiques (ACSH) cryopréservées est le standard du traitement du myélome multiple (MM). Cette procédure reste complexe et onéreuse dans les pays à ressources limitées. C’est pourquoi le recours aux greffons non cryopréservés est fréquent dans ces pays. Nous rapportons les résultats de cette procédure chez une cohorte de patients (pts) atteints de MM éligibles à une autogreffe.
Patients et méthodes. Étude prospective sur une année portant sur 20 pts atteints de MM, d’âge moyen de 53 ans (33-67), 11 hommes et neuf femmes avec un sex-ratio de 1,2. Initialement, tous les pts étaient classés en stade III (dont trois IIIB). Les protocoles d’induction sont VTD (16), VCD (3) et VRD (1). Une RC : cinq cas, VGPR : 10 et RP : cinq selon les critères IMWG. La durée minimale entre la fin de l’induction et le début de la mobilisation est de trois mois (1-8) par le G-CSF (15 μg/kg/j pendant quatre à cinq jours). Le greffon est conservé à 4 ̊C. Le conditionnement classique par le melphalan à 200 mg/m2 à J-1, réduit à 140 mg/m2 en cas d’insuffisance rénale. Le dénombrement des CSH CD34+ a été fait sur un cytomètre quatre couleurs BD Calibur (avec un marquage du CD45, CD34 et détermination de la viabilité cellulaire par le 7-AAD). Une consolidation postautogreffe est assurée à J60 avec une évaluation à J100.
Résultats. La durée de mobilisation est de quatre jours chez 70 % des pts, et de cinq jours chez 30 % ; quatorze pts ont bénéficié d’une seule aphérèse, six pts ont bénéficié de 2. La masse sanguine traitée est en moyenne 2,3 (1,8-3). La richesse médiane du greffon en CSH est de 6,26 × 106 CD34+/kg (1,53-18,3). La récupération de la fonction médullaire est faite après un intervalle médian pour les neutrophiles est de 9,5 jours (8-14). Le nadir moyen des globules blancs est de 71 ets/μL (30-190), celui des plaquettes de 10 600 ets/μl (2 000-21 000), et celui de l’hémoglobine de 8,3 g/dL (6,3-10).
Le nombre moyen de concentrés plaquettaires unitaires transfusés est de 2,6 (1-7) ; la transfusion de concentrés de globules rouges faite chez huit pts avec une moyenne de 0,8 (1-3). La durée moyenne d’hospitalisation est de 20 jours (13-27).
Nous ne signalons aucun décès ou échec de greffe ni de réaction au cours de la réinjection du greffon. La mucite tous grades confondus a été observée chez 65 % des pts et 80 % des pts ont présenté un épisode fébrile. À J100 d’autogreffe, les cinq pts préalablement en RC ont maintenu cette RC ; pour les 10 VGPR (RC : quatre cas, VGPR : deux cas et en cours : quatre cas) et en RP (RC : un cas, VGPR : deux cas et en cours : deux cas). Tous les patients sont vivants à ce jour sous traitement de maintenance.
Discussion. Nos résultats rejoignent les résultats rapportés par plusieurs équipes en termes d’efficacité de cette procédure et en temps de récupération hématologique comparés à l’utilisation de CSH cryopréservées.
Conclusion. La cryopréservation, processus complexe, n’est pas une procédure incontournable pour la réussite de l’autogreffe dans les MM. La réinjection d’un greffon frais est aussi sure, efficace, et évite l’utilisation de cryoconservateurs dont la toxicité est réelle.
14-19
Daratumumab par voie sous-cutanée associé aux standards à différentes lignes de traitement chez des patients atteints d’un myélome multiple : mise à jour de l’étude de phase 2 PLEIADES
C. Hulin*1, J. San-Miguel2, H. Mccarthy3, K. Suzuki4, VTM. Hungria5, A. Sureda6, A. Perrot7, A. Chari8, H. Magen9, S. Iida10, V. Maisnar11, L. Karlin12, L. Pour13, D. Parasrampuria14, T. Masterson14, M. Kosh14, S. Yang14, M. Delioukina14, M. Qi15, R. Carson16, C. Touzeau17
1 Hématologie, Hôpital Haut-Lévêque, Pessac ; 2 Clínica Universidad de Navarra-Cima, Idisna, Ciberonc, Pamplona, Espagne ; 3 Haematology, Royal Bournemouth Hospital, Bournemouth, Royaume Uni ; 4 Department of Hematology, Japanese Red Cross Medical Center, Tokyo, Japon ; 5 Department of Hematology, Clinica São Germano and Santa Casa Medical School, São Paulo, Brésil ; 6 Institut català d’oncologia hospitalet, ICO Institut Català d’Oncologia, L’Hospitalet de Llobregat, Espagne ; 7 Service d’hématologie, Oncopole, Toulouse ; 8 Mount Sinai School of Medicine, New York, NY, États-Unis ; 9 Institute of Hematology, davidoff cancer Center, beilinson Hospital, rabin Medical Center, Petah-Tikva and Sackler School of Medicine, Tel-Aviv University, Tel-Aviv, Petah Tikva, Israël ; 10 Nagoya City University Graduate School of Medical Sciences, Nagoya, Japon ; 11 Médecine interne hématologie, Hôpital Universitaire Charles et Faculté de médecine, Hradec Králové, République Tchèque ; 12 Hématologie clinique, Hospices Civils de Lyon, Lyon ; 13 Oncologie hématologie, Hôpital Universitaire de Brno, Brno, République Tchèque ; 14 Janssen Research & Development, Spring House, PA, États-Unis ; 15 Janssen Research & Development, LLC, Spring House, États-Unis ; 16 Research & Development, Janssen, Spring House, PA, États-Unis ; 17 Hématologie clinique, CHU Nantes, CRCINA, Inserm, CNRS, Université d’Angers, Université de Nantes, Nantes
Introduction. Le daratumumab (DARA) par voie intraveineuse (IV) est approuvé en monothérapie ou en association avec les schémas recommandés pour le traitement du myélome multiple. Dans COLUMBA, une formulation sous-cutanée de DARA (DARA SC) s’est montrée non inférieure au DARA IV avec une efficacité et une pharmacocinétique similaires, a apporté une diminution significative du taux de réaction liée à la perfusion (RLP) et a réduit la durée d’administration. Cette étude de phase 2 PLEIADES a évalué l’efficacité et la tolérance du DARA SC en association avec le bortézomib, le lénalidomide, et la dexaméthasone (D-VRd) chez les patients atteints de myélome multiple nouvellement diagnostiqué (MMND) éligibles à la greffe (G) et le bortézomib, le melphalan, et la prednisone (D-VMP) chez les patients atteints de MMND non éligibles à la greffe (NG), et en association avec le lénalidomide et la dexaméthasone (D-Rd) dans le myélome multiple en rechute ou réfractaire (MMRR). Ici, nous présentons les résultats de PLEIADES avec un suivi plus long.
Patients et méthodes. Les patients (pts) atteints d’un MMND NG ont reçu du DARA SC (1 800 mg + hyaluronidase humaine recombinante PH20 [rHuPH20 ; technologie de distribution du médicament ENHANZE®, Halozyme Inc.]) plus VMP pour neuf cycles. Les pts atteints de MMRR avec ≥ 1 ligne de traitement antérieure ont reçu du DARA SC plus Rd. Les pts atteints d’un MMND G ont reçu quatre cycles de DARA SC plus VRd en traitement d’induction. Les critères principaux d’évaluation de l’efficacité étaient le taux de réponse globale (TRG) pour D-VMP et D-Rd et le taux de très bonne réponse partielle ou mieux (≥ TBRP) pour D-VRd. Les critères d’évaluation secondaires incluaient le taux de réponse ≥ TBRP pour les cohortes D-VMP et D-Rd et le TRG pour la cohorte D-VRd. Les données de tolérance comprenaient les taux des événements indésirables apparus sous traitement, et les RLP.
Résultats. 199 pts ont été inclus (D-VMP, n = 67 ; D-Rd, n = 65 ; D-VRd, n = 67) et ont eu un suivi médian de 11,0, 11,2 et 7,1 mois respectivement. Les TRG pour D-VMP et D-Rd étaient respectivement de 89,6 % et 93,8 %, et étaient comparables aux études publiées avec le DARA IV. Le taux de réponse ≥ TBRP pour D-VRd était de 70,1 %. Dans toutes les cohortes, la durée médiane d’administration de DARA SC était de 5 minutes. Les profils de tolérance correspondaient à ceux du DARA IV en association avec les schémas recommandés. Les taux de RLP et les réactions au site d’injection étaient cohérents avec ceux observés avec le DARA SC en monothérapie dans l’étude COLUMBA. La pharmacocinétique du DARA SC dans chaque schéma et l’immunogénicité du DARA et de rHuPH20 étaient comparables aux précédentes analyses.
Conclusion. Avec un suivi plus long, le DARA SC associé aux schémas recommandés a montré une activité clinique et une tolérance comparables à celles des schémas avec le DARA IV, avec des taux de RLP considérablement plus faibles et une administration plus courte.
14-20
Étude de phase 3, en ouvert, comparant le daratumumab par voie sous-cutanée et par voie intraveineuse chez des patients atteints de myélome multiple en rechute ou réfractaire : analyse de COLUMBA par sous-groupes de poids corporel
P. Moreau*1, MV. Mateos2, SZ. Usmani3, S. Grosicki4, V. Vorobyev5, I. Spicka6, VTM. Hungria7, S. Korenkova8, NJ. Bahlis9, M. Flogegard10, J. Blade11, M. Kaiser12, S. Iida13, J. Laubach14, T. Masterson15, K. Lantz16, L. O’rourke16, X. Qin17, D. Parasrampuria15, C. Heuck16, M. Qi17, H. Nahi18
1 Service d’hématologie clinique, Hôtel-Dieu, Nantes ; 2 Département d’hématologie, Hôpital Universitaire de Salamanca-IBSAL, Salamanque, Espagne ; 3 Institut du cancer Levine/Atrium Health, Charlotte, NC, États-Unis ; 4 Haematology, Department of Cancer Prevention, School of Public Health, Medical University of Silesia, Katowice, Pologne ; 5 Hematology, S.P. Botkin City Clinical Hospital, Moscou, Fédération de Russie ; 6 Département de médecine interne, Hôpital universitaire Charles, Prague, République Tchèque ; 7 Department of Hematology, Clinica São Germano and Santa Casa Medical School, São Paulo, Brésil ; 8 Hematology, Kiev Center for Bone Marrow Transplantation, Kiev, Ukraine ; 9 Hematology, Tom Baker Cancer Centre, Calgary, Canada ; 10 Department of Internal Medicine, Falun General Hospital, Falun, Suède ; 11 Idibaps, Hospital Clinic de Barcelona, Barcelona, Espagne ; 12 Hématologie, The Institute of Cancer Research, Londres, Royaume Uni ; 13 Nagoya City University Graduate School of Medical Sciences, Nagoya, Japon ; 14 Medical Oncology, Dana-Farber Cancer Institute, Boston, États-Unis ; 15 Janssen Research & Development, Spring House, PA, États-Unis ; 16 Janssen research & development, Janssen, Spring House, PA, États-Unis ; 17 Janssen Research & Development, LLC, Spring House, États-Unis ; 18 Center for Hematology and Regenerative Medicine, Karolinska Institutet, Stockholm, Suède
Introduction. Le daratumumab (DARA) est approuvé pour une administration IV en monothérapie ou en association avec les schémas recommandés pour le traitement du myélome multiple (MM). L’étude de phase 3 COLUMBA a démontré qu’une formulation de DARA sous-cutanée (SC) était non inférieure à DARA IV sur le plan du taux de réponse globale (TRG) et de la Crésiduelle chez les patients atteints d’un MM en rechute ou réfractaire (MMRR). Ici, nous présentons une analyse par sous-groupes de poids corporel.
Patients et méthodes. DARA SC (dose fixe de 1 800 mg de DARA + hyaluronidase PH20 humaine recombinante [technologie ENHANZE®, Halozyme, Inc]) et DARA IV (16 mg/kg) ont été administrés en cycles de 28 jours. Les co-critères principaux étaient le TRG et la Crésiduelle maximale (concentration pré-administration le jour 1 du cycle 3 [J1C3]) de DARA. Les sous-groupes de poids étaient ≤ 65 kg, > 65 à 85 kg, et > 85 kg.
Résultats. 522 patients ont été randomisés pour recevoir DARA SC, n = 263 ou DARA IV, n = 259. Poids corporel médian : 73 kg. DARA SC a atteint une exposition adéquate pour tous les sous-groupes de poids. Il y avait un chevauchement considérable de la Crésiduelle maximale pour DARA SC et IV dans les sous-groupes. Cependant, les concentrations moyennes de DARA SC vs IV étaient 60 % plus élevées pour les patients ≤ 65 kg et 12 % plus faibles pour les patients > 85 kg, mais l’intervalle de Crésiduelle sur l’ensemble des poids pour DARA SC était dans l’intervalle précédemment observé (36 à 1 764 μg/mL) pour DARA IV. Le TRG était de 41,1 % vs 37,1 % pour DARA SC et IV (pop. en ITT) et était respectivement de 43,6 % vs 38,0 %, 37,3 % vs 39,0 %, et 43,9 % vs 32,8 % pour DARA SC et IV dans les bras ≤ 65 kg, > 65 à 85 kg, et > 85 kg, laissant penser que la légère diminution de l’exposition à des poids plus élevés n’était pas cliniquement pertinente. L’incidence des effets indésirables sous traitement (EIST) de grade 3/4/5, des EIST graves, et des réactions liées à la perfusion était similaire dans tous les sous-groupes de poids à la fois pour DARA SC et IV. L’incidence des EIST tous grades confondus a augmenté avec la baisse du poids pour DARA SC, mais était similaire pour DARA IV dans tous les sous-groupes de poids. L’incidence de la thrombopénie et de la neutropénie de grade 3/4 a baissé avec l’augmentation du poids pour DARA SC. L’incidence de l’hypertension de grade 3/4 a augmenté avec le poids pour DARA IV. Chez les patients ≤ 65 kg, les incidences des EIST de grade 3/4/5 étaient similaires, et l’incidence des EIST graves était plus faible avec DARA SC qu’avec IV (23,7 % vs 30,4 %).
Conclusion. Le TRG de tous les sous-groupes de poids corporel correspondait à celui de la population globale ; DARA SC a atteint une exposition adéquate et a été bien toléré. La concentration supérieure de DARA SC chez les patients de ≤ 65 kg n’a pas eu d’impact cliniquement pertinent sur la tolérance, laissant penser qu’un ajustement personnalisé de la dose en fonction du poids n’est pas nécessaire.
14-21
Suivi à quatre ans de l’étude POLLUX de phase 3 évaluant l’association daratumumab plus lénalidomide et dexaméthasone par rapport au lénalidomide et à la dexaméthasone dans le myélome multiple en rechute ou réfractaire
L. Benboubker*1, SZ. Usmani2, J. San-Miguel3, NJ. Bahlis4, D. White5, JL. Kaufman6, G. Cook7, M. Leiba8, PJ. Ho9, K. Kim10, N. Takezako11, P. Moreau12, M. Krevvata13, H. Pei14, J. Ukropec15, T. Renaud16, S. Trivedi17, R. Kobos18, MA. Dimopoulos19
1 Hématologie Thérapie Cellulaire, CHU Tours Hôpital Bretonneau, Tours ; 2 Institut du cancer Levine/Atrium Health, Charlotte, NC, États-Unis ; 3 Clínica Universidad de Navarra-Cima, Idisna, Ciberonc, Pamplona, Espagne ; 4 Hematology, Tom Baker Cancer Centre, Calgary, Canada ; 5 Division of Hematology, Department of Medicine, Queen Elizabeth II Health Sciences Centre, Halifax, Canada ; 6 Winship cancer Institute, Emory University, Atlanta, GA, États-Unis ; 7 St James's Institute of Oncology, Leeds Teaching Hospitals NHS Trust and University of Leeds, Leeds, Royaume Uni ; 8 Faculty of Health science, Assuta University Hospital, Beersheba, Israël ; 9 Institute of Haematology, Royal Prince Alfred Hospital, Camperdown, Australie ; 10 Department of Medicine, Samsung Medical Center, Sungkyunkwan University School of Medicine, Seoul, République de Corée ; 11 Department of Hematology, National Hospital Organization Disaster Medical Center of Japan, Tachikawa, Japon ; 12 Service d’hématologie clinique, Hôtel-Dieu, Nantes ; 13 Janssen Research & Development, LLC, Spring House, PA, États-Unis ; 14 Janssen Research & Development, Llc, Raritan, États-Unis ; 15 Janssen Global Medical Affairs, LLC, Horsham, PA, États-Unis ; 16 Janssen research & development, raritan, États-Unis ; 17 Us Clinical Oncology pa, Janssen Research & Development, Spring House, PA, États-Unis ; 18 Janssen Research & Development, Raritan, NJ, États-Unis ; 19 Clinical Therapeutics, Université d’Athènes, Athens, Grèce
Introduction. Le daratumumab (DARA) est approuvé en association avec des standards de traitement recommandés pour le myélome multiple nouvellement diagnostiqué (MMND) et le myélome multiple en rechute ou réfractaire (MMRR). Dans des études de phase 3, les schémas à base de DARA ont réduit le risque de progression/décès et augmenté les taux de réponse complète (RC) ou mieux et de maladie résiduelle minimale (MRD) négative chez les patients (pts) atteints de MMND et de MMRR. Dans l’étude POLLUX (suivi médian [SM] de 44,3 mois [m.]), l’association lénalidomide (D) et dexaméthasone (Rd) a réduit le risque de progression/décès et significativement augmenté le taux de réponse globale (TRG) comparé à Rd chez les patients (pts) atteints d’un MMRR. Ici, nous présentons une analyse actualisée après un SM > 4 ans.
Patients et méthodes. Des pts avec ≥ 1 ligne de traitement (LDT) antérieure ont été randomisés avec Rd ± DARA. Les pts de haut risque cytogénétique présentaient des anomalies de t(4;14), t(14;16) et del(17p). La survie sans progression à la LDT suivante (SSP2) a été définie comme le délai entre la randomisation et la progression de la maladie après la LDT suivante ou le décès.
Résultats. 569 pts ont été randomisés (D-Rd, n = 286 ; Rd, n = 283). Lors du SM à 54,8 m., D-Rd a significativement prolongé la SSP comparé à Rd (médiane de 45,0 contre 17,5 m. ; hazard ratio [HR], 0,44 ; intervalle de confiance [IC] à 95 %, 0,35-0,54 ; P < 0,0001) ainsi que la SSP comparé à Rd indépendamment de la LDT antérieure ou du risque cytogénétique. D-Rd a été associé à un TRG significativement plus élevé qu’avec Rd (93 % contre 80 %) et à des réponses ≥ très bonne réponse partielle et ≥ RC aussi plus élevées. D-Rd a prolongé le délai jusqu’au traitement suivant comparé à Rd (durée médiane : non atteinte contre 22,8 m. ; HR, 0,38 ; IC 95 %, 0,30-0,48 ; P < 0,0001) et la SSP2 comparé à Rd (médiane de 53,3 contre 31,6 m. ; HR, 0,53 ; IC 95 %, 0,42-0,66 ; P < 0,0001). 125 décès ont été observés avec D-Rd contre 144 avec Rd ; le suivi de la survie globale (SG) est en cours. La durée médiane de traitement était de 34,3 (D-Rd) contre 16,0 m. (Rd). Les événements indésirables apparus sous traitement (EIST) de grade 3/4 les plus fréquents (≥ 10 %) sous D-Rd comparé à Rd étaient : neutropénie (57 % vs 42 %), anémie (19 % vs 22 %), thrombopénie (15 % vs 16 %), pneumonie (16 % vs 10 %) et diarrhée (10 % vs 4 %). D’autres données d’efficacité et de tolérance seront présentées.
Conclusion. Après un SM > 4 ans, D-Rd présentait toujours un bénéfice significatif en SSP avec des réponses plus élevées et plus profondes comparé à Rd chez des pts atteints d’un MMRR. Un bénéfice en SSP a été observé avec D-Rd indépendamment du traitement antérieur ou du risque cytogénétique ; un bénéfice supérieur a été observé chez les patients traités à des lignes plus précoces par D-Rd. Une amélioration significative de la SSP2 suggère un bénéfice potentiel en termes de SG, mais les données de SG sont encore immatures. Aucun nouveau signal de tolérance n’a été identifié.
14-22
Profil d’expression antigénique des plasmocytes pathologiques avec apport d’un nouveau marqueur de gating : le CD319
S. Barreau*, C. Almire, C. Dussiau, C. Friedrich, M. Fontenay, N. Chapuis
Hématologie biologique, Hôpital Cochin, Paris
Introduction. Les pathologies plasmocytaires détectables dans la moelle osseuse (gammapathies monoclonales de signification indéterminée [MGUS] et myélome multiple [MM]) sont des pathologies dont le diagnostic repose sur la mise en évidence et la quantification d’un pic monoclonal, le décompte de plasmocytes au myélogramme et sur la présence de critères CRAB. La cytométrie en flux (CMF) apporte un complément d’information en confirmant le caractère monoclonal des plasmocytes et est également une source d’information importante concernant le profil d’expression antigénique à la surface des plasmocytes pathologiques.
Matériels et méthodes. Dans le cadre de ce travail, nous avons analysé de façon rétrospective le profil phénotypique des plasmocytes issus de la moelle osseuse de patients prélevés dans le cadre d’une suspicion de pathologie plasmocytaire (n = 95). Au sein de cette cohorte, les données phénotypiques sur les plasmocytes normaux et pathologiques ont été utilisées pour chaque échantillon si leur taux était supérieur ou égal à 10 % des plasmocytes totaux. Au total, nous avons donc analysé le profil phénotypique de plasmocytes normaux et pathologiques sur respectivement 57 et 79 (52 MGUS et 27 MM) échantillons. Nous avons tout d’abord évalué la positivité de différents marqueurs (CD19, CD56, CD20, CD27, CD200, CD28) avec un cut-off de positivité à 20 %. Ensuite, l’intensité d’expression des marqueurs de gating classiquement (CD38 et CD138) et nouvellement (CD319) utilisés a été étudiée via le calcul d’un ratio de fluorescence (RFI, avec utilisation d’un contrôle interne lymphocytaire négatif).
Résultats. Comme attendu, nous retrouvons une expression du CD19 (93% vs 10 %, p < 0,0001) et du CD27 (100 % vs 86 %, p < 0,01) significativement plus fréquente sur les plasmocytes normaux que sur les plasmocytes pathologiques. À l’inverse, l’expression du CD20 (11 % vs 27 %, p < 0,05), du CD56 (33 % vs 66 %, p < 0,001), et du CD200 (40 % vs 71 %, p < 0,001) est plus fréquente sur les plasmocytes pathologiques. Il n’a pas été observé de différence significative pour le marqueur CD28.
Quant aux trois marqueurs de gating (CD38, CD138, CD319), l’intensité d’expression du CD38 et du CD319 est significativement plus faible sur les plasmocytes pathologiques que sur les plasmocytes normaux (p < 0,0001 et p < 0,001 respectivement), et ce d’autant plus chez les patients atteints de myélome (p < 0,05 et p < 0,01 respectivement). Aucune différence significative n’est par contre observée pour le CD138.
Conclusion. En conclusion, cette étude a permis de conforter des données connues sur le profil antigénique des plasmocytes tumoraux, avec une perte d’expression de marqueurs normalement exprimés (CD19, CD27) ou l’acquisition fréquente de marqueurs « aberrants » (CD20, CD56, CD200). Il est également observé une modulation d’intensité d’expression des marqueurs de gating CD38 et CD319 sur les plasmocytes pathologiques. Malgré cette diminution d’expression, ce travail démontre l’intérêt du CD319 comme nouveau marqueur de gating en complément de la combinaison classiquement utilisée CD38/CD138, celle-ci étant parfois mise en défaut lorsque l’expression du CD38 est fortement diminuée, voir absente notamment chez les patients traités par un anticorps monoclonal ciblant le CD38 (e.g. daratumumab). Compte tenu de ces résultats, nous avons donc intégré le CD319 dans notre panel de recherche de maladie résiduelle en routine chez les patients atteints de MM.
14-23
Comparaison des combinaisons Euroflow pour la recherche de maladie résiduelle en cytométrie en flux dans le myélome
MC. Béné*1, N. Robillard1, P. Moreau2, S. Wuillème1
1 Service d’hématologie biologique, Hôtel-Dieu, Nantes ; 2 Service d’hématologie clinique, Hôtel-Dieu, Nantes
Introduction. La recherche de maladie résiduelle (MRD) gagne en importance dans le suivi et la prise en charge des patients atteints de myélome multiple. La détection des plasmocytes anormaux tumoraux peut se faire à l’aide de techniques moléculaires identifiant le réarrangement des gènes des immunoglobulines du clone malin ou en cytométrie en flux multiparamétrique (CMF). Cette dernière permet l’obtention d’un résultat rapide sur de cellules fraîches. Elle ne prend de plus en compte que les cellules vivantes, après exclusion des débris. De nombreuses publications ont rapporté que les marqueurs les plus fiables pour la recherche de MRD en CMF sont CD38 et CD138, dont la coexpression permet de sélectionner les populations plasmocytaires dans la moelle osseuse ou, plus rarement, dans le sang. De plus, les plasmocytes malins diffèrent souvent, mais pas toujours, des plasmocytes normaux par la perte de CD19 et l’acquisition de CD56. D’autres anomalies immunophénotypiques ont été décrites, liées à l’expression de CD20, CD27, CD28, CD33, CD45, CD81 ou CD117. Les plasmocytes malins possèdent également dans leur cytoplasme l’immunoglobuline myélomateuse monotypique. Ceci peut être détecté en CMF après perméabilisation des cellules. Le consortium Euroflow (Flores Montero, 2018) a proposé pour la recherche de MRD dans le MM, l’utilisation de deux tubes comportant les mêmes marqueurs de base (backbone) dans une stratégie « de surface » avec l’exploration en plus de CD81 et CD117 et une stratégie “cytoplasmique” recherchant l’expression des chaînes légères d’immunoglobulines kappa et lambda. Ces deux stratégies ont été comparées ici.
Patients et méthodes. Une cohorte de 100 patients ayant bénéficié de ces deux approches a été sélectionnée rétrospectivement sur la base de la présence de MRD évaluée par la méthode cytoplasmique. Après lyse macrovolume, 5 × 106 à 10 × 106 de cellules nucléées ont été utilisées pour le tube « cytoplasmique » et 3 × 106 à 5 × 106 pour le tube « de surface ». Les marqueurs membranaires communs aux deux tubes étaient CD45, CD19, CD38, CD138 et CD27. Le tube « de surface » contenait aussi des anticorps anti-CD81 et CD117 et le tube « cytoplasmique » des anticorps anti-chaînes kappa et lambda.
Résultats. Une corrélation linéaire a été observée entre les deux valeurs de chaque patient (R2 = 0,83). Le tube « cytoplasmique » présentait un taux de MRD plus bas que le tube « de surface » (68 % des cas, médiane -0,0113 ; -0,0001 à -1,4), mais les taux plus élevés retrouvés dans 32 % des cas (0,0007 à 1,44) excluent l’influence d’une perte cellulaire. Au total, 58 % des échantillons exprimaient CD56 dont 43 avaient perdu l’expression de CD19. CD19 était également absent de 40 échantillons CD56-. Toutes les combinaisons possibles de marquage par CD117 et CD81 ont été retrouvées, rendant délicate l’interprétation de chaque patient.
Conclusion. Au total, ce travail montre une corrélation convenable entre les deux combinaisons, mais une plus grande confiance est accordée au tube “cytoplasmique” pour lequel l’identification de la population anormale est confirmée par la démonstration de sa monotypie. De plus, alors que la confirmation de la présence d’une population anormale a souvent été requise pour conclure avec le tube « de surface », la situation inverse ne s’est jamais produite. L’utilisation du seul tube « cytoplasmique », en huit couleurs, apparaît donc comme une méthode robuste et fiable pour la détection de la MRD dans le MM.
14-24
Traitement du myélome multiple du sujet jeune
E. Berred*1, R. Barred1, R. Mansouri1, B. Manel1, S. Kefi1, D. Jabr1, M. Bahri1, H. Ben Neji1, M. Achour2, R. Kharrat3, Y. Ben Abdennebi1, K. Kacem1, R. Belakhal4, B. Meddeb2, L. Aissaoui1
1 Hématologie clinique, Hôpital Aziza Othmana, Tunis, Tunisie ; 2 Service d’hématologie clinique, Hôpital Aziza Othmana, Tunis, Tunisie ; 3 Service d’hématologie, Hôpital Aziza Othmana, Tunis, Tunisie ; 4 Hématologie, hôpital Aziza Othmana, Tunis, Tunisie
Introduction. La chimiothérapie à hautes doses suivie d’autogreffe reste l’épine dorsale de la prise en charge des patients jeunes en première ligne de traitement. Actuellement, les nouvelles drogues, dont le bortézomib, sont à la base de tous les protocoles thérapeutiques. En Tunisie, la prise en charge du myélome multiple du sujet jeune (< 65 ans) est codifiée par un référentiel national révisé dans sa dernière version en 2016.
Patients et méthodes. Il s’agit d’une étude monocentrique rétrospective menée au service d’hématologie clinique de l’hôpital Aziza Othmana janvier 2017 et juin 2019 ayant colligé les patients jeunes (< 65 ans) traités pour myélome multiple selon le référentiel national Tunisien 2016. Nous avons analysé les réponses aux différents traitements d’induction selon la stratification de risque. Sont classés haut risque les patients ayant : un score ISS à 3 et/ou une insuffisance rénale et/ou un caryotype Fish défavorable (del[17p], t(4;14)) et/ou une localisation extramédullaire. Ces patients sont candidats à un traitement d’induction par le VTD. En l’absence de ces critères, le patient est classé risque standard et reçoit une induction de type CTD.
Résultats. Cent sept patients ont été traités durant cette période. L’âge médian était de 55 ans (33-67 ans). Le sex-ratio était de 0,72. Trente et un patients ont été classés risque standard (CTD). Chez les 76 patients classés haut risque (VTD), 23 avaient un score ISS à 3, 25 une anomalie cytogénétique défavorable au caryotype Fish (neuf del(17p), 11 anomalies du chromosome 14 et quatre associations ch. 4/14/17), 11 patients en insuffisance rénale et 17 localisation extramédullaire. Les réponses au traitement dans les deux bras thérapeutiques sont illustrées par le tableau suivant :Total patients Bras VTD Bras CTD RG 93 % (n = 99) 96 % (n = 73) 84 % (n = 26) RC 14 % (n = 15) 17 % (n = 13) 6,5 %(n = 2) VGPR 46 % (n = 49) 50 % (n = 38) 35,5 %(n = 11) RC+VGPR 60 % (n = 64) 67 % (n = 51) 42 % (n = 13) RP 33 % (n = 35) 29 % (n = 22) 42 % (n = 13) Echec/progression 7 % (n = 8) 4 % (n = 3) 16 % (n = 5)
Discussion. 93 % des patients sont en réponse après le traitement d’induction : 96 % dans le bras VTD versus 84 % dans le bras CTD (p = 0,03). Le traitement par VTD permet l’obtention d’une meilleure qualité de réponse avec un taux de ≥ VGPR de 67 % versus 42 % avec le CTD (p = 0,016).
Conclusion. Un ajustement du référentiel national tunisien s’impose. Une induction de type VTD devrait être adoptée pour tous les patients afin d’assurer la meilleure réponse possible avant l’autogreffe de CSP.
14-25
Rétinite à cytomégalovirus chez des patients traités par pomalidomide, dexaméthasone et cyclophosphamide pour un myélome multiple : à propos de deux cas
G. Antherieu*1, O. Attoui2, M. Fabre3, F. Lachenal4
1 Médecine interne, Ctre Hospitalier Pierre Oudot, Bourgoin-Jallieu ; 2 Ophtalmologie, Ctre Hospitalier Pierre Oudot, Bourgoin-Jallieu ; 3 Médecine interne - maladies infectieuses, Ctre Hospitalier Pierre Oudot, Bourgoin-Jallieu ; 4 Hématologie, Ctre Hospitalier Pierre Oudot, Bourgoin-Jallieu
Introduction. La rétinite à cytomégalovirus (CMV) est habituellement observée chez des patients VIH+ avec des CD4 < 50/μL. Elle a été décrite chez des patients avec un myélome multiple en rechute ou réfractaire (MM R/R) traités par lénalidomide (LEN) dexaméthasone (DEX). Nous présentons deux cas de rétinite à CMV chez des patients traités par Pomalidomide (POM) Cyclophosphamide DEX (PCD) pour un MM R/R. Ceci n’a jamais été rapporté dans la littérature.
Résultats. Le premier patient, 75 ans, est suivi pour un MM depuis 2014 (traitement par bortézomib (BOR) Cyclophosphamide DEX et autogreffe, puis LEN DEX en 2016, puis Carfilzomib DEX en 2016). Un traitement par PCD est engagé en avril 2018 sous couvert de Valaciclovir. Après un an le patient est en VGPR. Il présente une toxoplasmose oculaire droite avec PCR+ sur humeur aqueuse (HA). La DEX et le cyclophosphamide sont interrompus. Du cotrimoxazole (TMP-SMX) à forte dose est maintenu. La lymphopénie est profonde (0,2 G/L). Le POM est interrompu pour progression en août 2019. Un mois après, à sa venue pour 1re cure de daratumumab, le patient décrit des myodésopsies de l’œil gauche. Le fond d’œil montre une nécrose rétinienne étendue ; le diagnostic de rétinite à CMV est porté par PCR sur HA et le patient placé sous ganciclovir. Les CD4 sont dosés à 33/μL. Les séquelles sont minimes. Le traitement du MM est poursuivi.
La deuxième patiente, 62 ans, est suivie depuis 2013 pour un MM (traitement par BOR thalidomide DEX et autogreffe puis LEN DEX à partir de 2015). Elle est placée sous PCD en août 2017, sous couvert de Valaciclovir. Une prophylaxie secondaire par TMP-SMX est instaurée après six mois suite à une pneumocystose. Le cyclophosphamide est arrêté après un an et la DEX poursuivie à 10 mg/sem. La patiente présente en sept 2019 une baisse d’acuité visuelle progressive et des myodésopsies conduisant au diagnostic de rétinite à CMV (PCR CMV+ sur HA). L’évolution est favorable sans séquelles sous ganciclovir. Les lymphocytes sont à 0,9 G/L, les CD4 à 131/μL. Le traitement par POM est poursuivi et la patiente toujours en VGPR.
La PCR VIH est négative chez les deux patients.
Discussion. Nous rapportons les cas de deux patients traités par PCD pour un MM R/R et ayant présenté une rétinite à CMV, dont une forme sévère avec nécrose rétinienne aiguë. Les signes d’appel étaient peu spécifiques (myodésopsies). Un diagnostic et une prise en charge spécialisée précoces ont permis d’éviter des séquelles visuelles importantes. Si un patient avait une immunodépression cellulaire profonde, la seconde avait une lymphopénie modérée et des CD4 supérieurs à 50/μL. Tous deux avaient des antécédents d’infections opportunistes.
Conclusion. Les patients avec un MM R/R doivent être considérés comme de grands immunodéprimés. Le diagnostic d’infection opportuniste ophtalmologique doit être évoqué au moindre symptôme, même banal, en particulier chez les patients ayant fait une autre infection opportuniste. Un monitoring des CD4 peut permettre une meilleure évaluation des risques.
14-26
Profil immunoélectrophorétique du myélome multiple du sujet âgé : à propos de 91 cas au service d’hématologie clinique du centre hospitalier national Dalal Jamm
FS. Ndiaye*1, S. Fall1, D. Fatma1, N. E H D2
1 Hématologie clinique, CHU Dalal Jamm, Dakar ; 2 Hématologie, Université Cheikh Anta Diop, Dakar, Sénégal
Introduction. La mise en évidence de l’immunoglobuline monoclonale, importante dans le diagnostic positif et le suivi du myélome multiple, repose sur l’immunofixation sérique et/ou urinaire.
L’objectif de cette étude était de décrire et d’évaluer les aspects immunoélectrophorétiques observés dans nos pratiques de prise en charge du myélome multiple du sujet âgé.
Patients et méthodes. Il s’agissait d’une étude rétrospective (2005-2019), transversale menée dans les services d’hématologie clinique de l’hôpital Le Dantec et Dalal Jamm, qui a inclus les données de l’électrophorèse et de l’immunoélectrophorèse, de 186 malades suivis pour un myélome multiple retenu selon les critères de l’International, Myeloma Working Group de 2003 et 2014.
Résultats. L’âge moyen des malades était de 67,5 ans avec un sex-ratio égal à 1.
L’électrophorèse des protéines sériques avait mis en évidence un pic au niveau des gammaglobulines dans 76,25 % des cas, des β-globulines dans 11,49 % des cas et un double pic gamma et β dans 6,9 % des cas. Le pic était absent chez deux malades.
À l’immunofixation des protéines sériques, l’isotype était IgG dans 65,71 %, IgA dans 15,24 % des cas, un double pic IgG-IgA dans 2/des cas et IgE dans 0,05 % des cas. Les chaînes légères étaient kappa 62,7 % % des cas, lambda dans 35,45 % des cas et, et leur association dans 1,8 % des cas.
Conclusion. Notre étude est particulière par la diversité du profil électrophorétique dominé par le pic de gammaglobuline qui n’est pas constant. Afin d’éviter les errances diagnostiques, il ne faut pas méconnaître les autres pics de gammaglobuline. L’isotype est le plus souvent à IgG Kappa comme décrit dans la littérature.
14-27
Modes de révélation du myélome multiple dans un service de médecine interne
W. Ben Yahia*, N. Hadded, A. Guiga, A. Baya Chatti, A. Bouker, A. Atig, N. Ghannouchi
Service de médecine interne, CHU Farhat Hached, Sousse, Tunisie
Introduction. Le myélome multiple (MM) est une dysglobulinémie maligne qui nécessite un diagnostic précoce pour une prise en charge rapide. Le MM est doté d’une variabilité clinique et biologique d’où sa découverte peut faire intervenir différentes spécialités. Le but de notre étude était de décrire les différents modes de révélation du MM dans un service de médecine interne ainsi que son profil épidémiologique, clinique, paraclinique et évolutif.
Patients et méthodes. Étude rétrospective descriptive des patients hospitalisés dans notre service de médecine interne entre les années 2009 et 2019 et chez qui un myélome multiple était diagnostiqué. Le diagnostic était retenu sur des critères cliniques, biologiques, histologiques et morphologiques.
Résultats. L’étude incluait 26 patients de sex-ratio = 1,6. L’âge moyen était de 61,5 ans [43-85]. Un antécédent néoplasique était noté dans trois cas. Le délai diagnostic moyen était de cinq mois [2 semaines-un an]. Les modes de révélations étaient une altération de l’état général (n = 14), des douleurs osseuses (n = 12), une fièvre prolongée (n = 2), une fracture pathologique (n = 2), une compression médullaire (n = 1), une amylose (n = 1). Le MM était découvert suite à des anomalies biologiques dans trois cas soit une hypercalcémie, une insuffisance rénale et une bicytopénie. Le diagnostic de MM était posé sur des images radiologiques suspectes dans un cas et était fortuit dans trois cas suite à des anomalies de l’électrophorèse des protéines demandée pour une autre pathologie. L’examen physique trouvait un syndrome tumoral dans sept cas. La biologie montrait une anémie (n = 24), une VS accélérée (n = 14), une hypercalcémie (n = 10), une insuffisance rénale (n = 10) et une protéinurie (n = 8). L’électrophorèse des protides révélait un pic monoclonal en gammaglobulines dans 12 cas, un pic en β2-globuline dans six cas, un pic en β1-globulines dans un cas et une hypogammaglobulinémie dans cinq cas. L’immunoélectrophorèse des protides réalisée chez 11 patients montrait un pic de type Kappa dans 10 cas et un pic de type lambda dans un cas. L’imagerie montrait des lésions osseuses à type de géodes ou de lyse osseuse dans 14 cas. Le diagnostic de MM était retenu sur le myélogramme réalisé chez 24 patients avec présence de plasmocytes dystrophiques > 10 % dans tous ces cas. Le diagnostic était retenu sur la biopsie ostéomédullaire chez les deux autres patients. Le MM était classé selon la classification de Salmon et Durie : stade IIIa (n = 13), stade IIIb (n = 7), stade un (n = 1), MM non sécrétant (n = 5). La conduite était d’administrer un traitement symptomatique (antalgiques, transfusion) et de corriger l’hypercalcémie. Dans 12 cas une corticothérapie était débutée et le thalidomide dans sept cas. Une radiothérapie décompressive était indiquée dans deux cas. Les patients étaient ainsi transférés dans une unité d’hématologie clinique.
Conclusion. Le MM représente 10 % des hémopathies malignes et son incidence augmente avec l’âge. Il est doté d’un polymorphisme clinique et biologique et son diagnostic repose sur la mise en évidence d’un clone monoclonal et de la prolifération maligne médullaire de plasmocytes dystrophiques. Le MM n’est pas seulement l’apanage des hématologues. Il peut être diagnostiqué dans différents services : médecine interne, néphrologie, rhumatologie… Le traitement doit être précoce et associe une chimiothérapie ou une greffe de cellules souches aux traitements symptomatiques.
14-28
Caractéristiques diagnostiques et pronostiques du myélome multiple du sujet âgé
S. Fall*1, F. Dieng1, EHD. Niang1, C. Lolita1, A. Sall2, FS. Ndiaye1
1 Hématologie clinique, CHN Dalal Jamm, Guédiawaye, Sénégal ; 2 Hématologie biologie, CHN Dalal Jamm, Guédiawaye, Sénégal
Introduction. Dans nos régions, le myélome multiple est plus diagnostiqué dans la soixantaine. Notre but est de décrire les caractéristiques diagnostiques et pronostiques, chez des myélomateux de 65 ans et plus.
Patients et méthodes. : Une étude descriptive rétrospective (janvier 2005-août 2019) avait inclus les patients âgés de plus de 65 ans et suivis pour un myélome multiple retenu sur les critères de l’International Myeloma group (2003,2014. Les aspects épidémiologiques, cliniques, paracliniques et pronostiques étaient précisés.
Résultats. Nous avons inclus 52 observations sur un total de 186 dossiers suivis durant la période d’étude. L’âge moyen était de 70,5 ans [65-84 ans]. Les patients étaient à risque cardiovasculaire dans 38,5 % des cas. Le score OMS était de 3-4 dans 73 % des cas. Les symptômes révélateurs étaient des douleurs osseuses (98,1 %), une fracture (34,6 %), une compression médullaire (32,6 %), une infection (32,6 %) et un plasmocytome osseux (11,5 %). Le taux d’hémoglobine moyen était de 8,7 g/dL [3,1-14,2 g/dL] et était inférieur à 10 g/dL dans 65,3 % des cas. La calcémie moyenne était de 2,48 mmol/L [1,99-4,11 mmol/L]. Le myélome était symptomatique dans tous les cas et l’isotype était IgG dans 73,3 % des cas, biclonal dans 13 % des cas, IgA dans 10 % des cas et de type Kappa dans 65,5 des cas. Les malades étaient au stade III de Salmon Durie dans 63,46 % des cas, la C réactive protéine était supérieure à 6 mg/L dans 50 % des cas et la fonction rénale était altérée chez 39,4 % des patients.
Conclusion. Il ressort de notre étude que le myélome multiple du sujet de plus de 65 ans est diagnostiqué au stade de forte masse tumorale, avec de mauvais facteurs pronostiques liés au myélome et au risque cardiovasculaire.
14-29
Comptage des cellules CD34+ par cytométrie en flux dans le cadre de l’autogreffe
MR. Abbadi, F. Talbi*, M. Rahali, S. Menouer, S. Belakehal, K. Djouadi
Hématologie, hôpital central de l’armée DR Mohamed Seghir Nekkache, Alger, Algérie
Introduction. La quantification des cellules CD34 + par cytométrie en flux est obligatoire pour confirmer l’adéquation des prélèvements de PBSC. Un « bon » greffon de moelle contient 3 à 5 millions de CD34+ par kg de receveur. Pour la numération des progéniteurs hématopoïétiques. On utilise souvent un Ac anti-CD45 et un Ac monoclonal spécifique anti-CD34. L’utilisation de billes de valeurs absolues permet d’établir la numération précise et non le pourcentage. Dans ce cadre, on présente ce travail qui porte sur la numération des CD34+ depuis l’initiation de l’autogreffe dans notre centre, on va illustrer les différentes étapes de la numération avec les différents réactifs utilisés en s’appuyant sur les recommandations internationales. Dans ce travail on va également exposer les différents résultats obtenus chez les 12 patients greffés à notre niveau et méthodes de calculs utilisés.
Résultats. Sur une période six mois, 12 patients présentant un myélome multiple en rémission complète ont été autogreffés, l’âge moyen est de 58,8 ans (53-63 ans), poids moyen est de 75 kg (59-94 kg), tous nos patients ont bénéficié de deux mobilisations, le comptage a été réalisé dans tous les cas analysés, nous avons réalisé 24 comptages de CD34+ par cytomètre en flux. La quantité de poche moyenne est de 158 mL (54-342 mL) : 1re mobilisation : 202,4 mL, deuxième mobilisation : 115,4 mL. Le nombre de GB moyen est de 192 756 elts/mm3 (1 456 150-275 480), le nombre de CD34/μL moyen est de 1 259 et le nombre moyen de CD34/poche est de 185 CD34+/poche. Le pourcentage de viabilité moyen est de 95 % (80-99 %). Le nombre de CD34+/kg moyen est de 2,44 million/kg (1re mobilisation → 2,99 millions/kg : deuxième 1,88 millions/kg.
Conclusion. Le comptage des cellules CD34+ constitue une étape primordiale et très importante dans le processus de l’autogreffe car un faux compte met en jeu le pronostic vital du patient recevant un traitement myéloablatif.
14-30
Résultats préliminaires du traitement d’induction du référentiel national tunisien du myélome multiple du sujet jeune : à propos d’une série de patients du Sud tunisien
F. Kallel*1, M. Charfi2, Y. Fakhfakh1, M. Medhaffar1, D. Belloumi3, F. Rym4, M. Ghorbel1, O. Kassar2, I. Frikha2, I. Ben Amor1, L. Khalifa5, H. Bellaaj6, S. Hdiji6, M. Elloumi6
1 hématologie clinique, CHU Hédi Chaker, Sfax, Tunisie ; 2 Hématologie clinique, chu Hedi Chaker, Sfax, Tunisie ; 3 Service d’hématologie biologique, Hôpital Aziza Othmana, Tunis, Tunisie, Tunis, Tunisie ; 4 Hématologie clinique, Centre National de Greffe de la Moelle Osseuse, Tunis, Tunisie ; 5 Hématologie clinique, CHU Hédi Chaker  , Sfax, Tunisie ; 6 Service d’hématologie, CHU Hédi Chaker, Sfax, Tunisie
, Sfax, Tunisie ; 6 Service d’hématologie, CHU Hédi Chaker, Sfax, Tunisie
Introduction. Le myélome multiple (MM) est une hémopathie maligne qui a connu, ces dernières années, d’importants progrès permettant une amélioration de la réponse au traitement ainsi que de la survie. La chimiothérapie à hautes doses suivie d’autogreffe reste un standard de la prise en charge des sujets jeunes en première ligne de traitement. L’introduction de nouvelles drogues, dont le bortézomib, inhibiteur de protéasome, a considérablement modifié la prise en charge de ces patients et est à la base de tous les protocoles thérapeutiques. La prise en charge du MM du sujet jeune (< 65 ans) en Tunisie a été codifiée par un référentiel national révisé dans sa dernière version en 2016.
Patients et méthodes. Notre étude est rétrospective concernant les patients jeunes de moins de 65 ans atteints de MM symptomatique suivis et diagnostiqués entre janvier 2016 et décembre 2018 et traités au service d’hématologie du CHU Hédi Chaker de SFAX selon le référentiel national Tunisien. Le référentiel a été basé sur une stratification de risque. Sont classés haut risque les myélomes avec : un score ISS à trois et/ou une insuffisance rénale (IR) et/ou un caryotype FISH défavorable (del(17p), t(4;14)) et/ou une localisation extramédullaire. Ces patients sont candidats à un traitement d’induction par VTD. En l’absence de ces critères, le patient est classé risque standard et reçoit une induction de type CTD. L’évaluation de la réponse s’est basée sur les critères de l’IMWG.
Résultats. Nous avons colligé 37 patients. L’âge médian était de 53 ans (30-65 ans). Quatorze cas ont été classes risque standard et ont reçu une induction par des cycles CTD. Chez les 23 patients classés haut risque et traités par des cycles VTD, 17 avaient un score ISS à 3. Les réponses à l’induction sont illustrées par le tableau suivant.
Le recul médian était de 14 mois. La survie globale et la survie sans progression à 12 mois étaient respectivement de 74 % et de 66 %.2016-2018 VTD CTD Réponse globale 29 (78 %) 19 (82 %) 10 (71%) Réponse complète 7 (18 %) 7 (30 %) 0 Très bonne réponse partielle 11 (30 %) 9 (39 %) 2 (14 %) Réponse partielle 11 (30 %) 3(13%) 8 (57%) Échec/progression 8 (22 %) 4 (18 %) 4 (29 %)
Conclusion. De cette évaluation préliminaire de la dernière version du référentiel, 78 % des patients sont en réponse globale au traitement d’induction dont 48 % avaient plus de VGPR. L’induction par VTD permet l’obtention d’une meilleure qualité des réponses (30 % RC vs 0 % avec CTD). La supériorité du VTD est également bien illustrée dans les taux d’échec qui s’élèvent à 29 % avec le CTD vs 18 % avec le VTD. Ces résultats se rapprochent de ceux retrouvés dans la littérature. Le bortézomib est une drogue majeure dans l’arsenal thérapeutique. La supériorité du VTD dans le traitement d’induction, bien illustré d’après ces premières résultats, nous incite à élargir la prescription à tous les patients < 65 ans avec MM.
14-31
Résultats thérapeutiques du myélome multiple chez le sujet jeune (évaluation du protocole national)
W. Chenbah*, N. Bensayed, E. Bouslama, R. Haifa, B. Achour, YY. Ben, K. Abderrahim
Hématologie clinique, CHU Farhat Hached, Sousse, Tunisie
Introduction. Le myélome multiple (MM) représente moins de 2 % de l’ensemble des cancers et 10 à 12 % des hémopathies malignes. C’est une hémopathie maligne due à la prolifération tumorale de plasmocytes monoclonaux dans la moelle osseuse qui atteint le sujet agé. Le traitement a eu plusieurs progrès ces dernières décennies en particulier les inhibiteurs des protéasomes qui ont permis d’améliorer le pronostic des malades, certes, celle-ci reste incurable.
Matériels et méthodes. C’est une étude rétrospective colligeant 34 malades porteurs de MM symptomatique dans le service d’hématologie clinique à CHU Farhat Hached de Sousse dont l’âge est inférieur à 65 ans sur une période de deux ans étendue de 2016 à 2018 traités par chimiothérapie selon le protocole national.
Résultats. Il s’agissait de 17 femmes et 17 hommes avec un sex-ratio = 1, leur âge moyen était de 55 ans (40 ans-65 ans). Le principal motif de consultation était les douleurs osseuses en particuliers de type rachialgies dans 56 % des patients suivis par l’insuffisance rénale dans 19 % des patients. Le composant monoclonal de type IgG était présent dans 50 % des patients. 14 % des patients avaient des anomalies cytogénétiques de haut risque. Tous les malades étaient classés stade III selon Salmon et Durie avec insuffisance rénale dans 32 % des cas. Le score ISS et R-ISS à III étaient objectivés chez 47 % et 38 % des cas. 33 patients ont eu un traitement d’induction (quatre cycles) comme suit : 18 thalidomide-dexa-bortézomib ; quatre cyclophosphamide-dexa-thalidomide ; six dexa-thalidomide et cinq melphalan-dexa-thalidomide. L’évaluation post-induction a permis d’avoir huit RC, trois VGPR, sept RP, six échecs et deux décès toxiques. Sept patients n’ont pas encore fini leur induction. Cinq patients parmi les sept RC ont été traités par VTD. En effet l’étude des facteurs prédictifs d’échec a montré L’ISS III, l’insuffisance rénale et le taux élevé de β2-microglobuline. Seulement cinq patients ont fait l’autogreffe pour des problèmes de disponibilité place. Le traitement d’entretien a été donné à quatre patients. 11 patients ont rechuté après un délai moyen de huit mois, tous ces patients n’ont pas eu d’autogreffe et avaient des éléments de mauvais pronostic dès le diagnostic. Seulement six patients ont eu un traitement de rattrapage, le bortézomib était donné à trois patients d’entre eux. L’évaluation post-rattrapage a montré un RC, deux RP et deux échecs. Pour le traitement de support tous les malades ont les biphosphonates avec une thérapie antalgique. La radiothérapie était faite chez quatre patients, à visée décompressive chez deux d’entre eux. Les neuropathies périphériques ont été objectivées chez cinq patients. La SG était de 20,5 mois et la SSR était de 13 mois. L’étude des survies en fonction des facteurs pronostic a montré une différence statiquement significative pour le score ISS III avec un p = 0,09.
Conclusion. Le traitement du myélome multiple se base essentiellement sur l’association de plusieurs drogues en induction pour avoir le maximum de réponse. La recherche de cette combinaison fait le sujet de plusieurs études. En effet toutes les études ont mis le point sur la nécessité de la présence d’Immunomodulateur avec un inhibiteur de protéasome. Notre étude malgré le faible échantillon et sa courte durée a confirmé l’intérêt de ces drogues dans le traitement de la maladie. Une indication plus élargie de ces médicaments doit être proposée.
14-32
Rôle d’une infirmière en pratique avancée en oncohématologie auprès de patients atteints d’un myélome multiple traités par thérapies orales
C. Migala*1, D. Guyotat2, F. Honeyman2, K. Augeul-Meunier2, P. Collet2
1 Infirmière en pratique avancée en oncohématologie - plateforme de coordination, Institut de Cancérologie Lucien Neuwirth, Saint-Priest-En-Jarez ; 2 Hématologie, ICLN, Saint-Priest-en-Jarez
Introduction. Le myélome multiple représente environ 5 000 nouveaux cas/an en France, avec un âge médian au diagnostic de 70 ans. Les patients de plus de 65 ans bénéficient le plus souvent de traitements oraux, nécessitant une surveillance clinique mensuelle, des bilans biologiques hebdomadaires et la gestion de nombreux effets secondaires.
Patients et méthodes. Au sein de l’établissement, une surveillance alternée IPA/Hématologue, est proposée aux patients atteints d’un myélome multiple traités par thérapies orales : appels téléphoniques et consultations de suivi programmés ainsi que la mise à disposition d’un numéro direct.
Résultats. Cette nouvelle modalité de prise en charge permet de veiller de manière plus régulière à l’observance du traitement, de détecter et de grader plus précocement d’éventuelles toxicités, d’analyser les bilans biologiques répétés, de renouveler ou d’interrompre la chimiothérapie, d’apporter des conseils ou des traitements appropriés, de mettre en évidences des fragilités psycho-sociales ou autres et d’orienter les patients auprès des professionnels de santé compétents.
Conclusion. L’infirmière en pratique avancée est un interlocuteur privilégié pour le patient, le but étant d’assurer une prise en charge globale plus satisfaisante, sans rupture de soins, ainsi qu’une meilleure coordination ville/hôpital. Cette nouvelle modalité de prise en charge permettrait également une épargne de temps médical avec de possibles économies pour les établissements de santé.
14-33
Lymphome plasmablastique : une évolution rare du myélome : à propos de quatre cas
N. Taar1, P. Lionne-Huyghe1, D. Stéphane1, R. Dubois2, M. Brouillard*1
1 Hématologie, CH d’Arras, Arras ; 2 Service d’anatomopathologie, Centre de Biologie - Pathologie, Lille
Introduction. Le myélome multiple est une pathologie dont le traitement depuis 20 ans a bénéficié d’avancées majeures permettant un meilleur contrôle de la maladie. L’espérance de vie s’est donc considérablement accrue, mais la majorité des patients présentent encore de multiples rechutes justifiant de nombreuses lignes thérapeutiques. Cette « chronicisation » de la maladie et le recours d’emblée à des traitements combinés conduisent à observer des rechutes plus nombreuses et dans des formes parfois beaucoup plus agressives, leucémies à plasmocytes, myélomes « tumoraux » avec de volumineuses masses plasmocytaires isolées ou disséminées voire même sous forme lymphomateuse de type lymphome plasmablastique (plasmablastic plasma cell myeloma ou anaplastic multiple myeloma des Anglo-Saxons).
Patients et méthodes. Nous rapportons la transformation de quatre cas de myélome en lymphome plasmablastique diagnostiquée devant un syndrome tumoral important avec adénopathies.
Résultats. Le premier cas est celui d’un homme de 64 ans présentant un myélome à IgG lambda en octobre 2015. Il bénéficie de cinq lignes de traitement avant de présenter une transformation de sa maladie en octobre 2019 en lymphome plasmablastique avec de multiples adénopathies et une volumineuse masse abdominale ; décès après deux cycles inefficaces de KCD.
Le second cas est celui d’une femme de 72 ans présentant un myélome à IgG kappa en décembre 2013. Elle bénéficie de deux lignes de traitement avant de présenter une transformation de sa maladie en lymphome plasmablastique en août 2018 avec de multiples adénopathies et de volumineuses masses iliaques et mammaires ; en vie après trois lignes thérapeutiques supplémentaires dont une avec anthracyclines, KCD actuellement.
Le troisième cas est celui d’une femme de 68 ans présentant un myélome à chaîne légère lambda en juillet 2018. Elle bénéficie de deux lignes de traitement avant de présenter une transformation de sa maladie en lymphome plasmablastique en septembre 2019 avec de multiples adénopathies et une masse orbitaire ; en vie après radiothérapie et sous KCD, deux cycles.
Le quatrième cas est celui d’un homme de 75 ans présentant un myélome à IgG kappa en avril 2018. Il bénéficie de trois lignes de traitement avant de présenter une transformation tumorale brutale de sa maladie en novembre 2019 avec de multiples adénopathies et de volumineuses masses pancréatiques et hypogastriques ; en vie, premier cycle de KCD en cours.
Chaque patient a bénéficié d’une TEP et d’examens anatomopathologiques centralisés. D’autres dossiers sont à l’étude.
Discussion. Quelques cas de patients présentant une telle évolution sont rapportés dans la littérature. Leur nombre semble augmenter rapidement du fait d’une meilleure efficacité des multiples traitements désormais utilisés entraînant au fil des lignes thérapeutiques la probable sélection de clones tumoraux beaucoup plus agressifs responsable d’une transformation tumorale péjorative du myélome.
Conclusion. Ces quelques cas permettront de souligner la difficulté diagnostique sur le plan anatomopathologique et thérapeutique de ces évolutions brutales.
14-34
Leucémie à plasmocytes de novo : à propos de quatre observations
S. Atik*1, L. Hamri1, I. Khoussar2, W. Ghandour3, R. Felk4, S. Saoudi5, B. S. bouchanafati1, M. Bouzaid5, L. Abarkan6, N. Al-Saddiq5, A. Oudrhiri3, N. Oubelkacem5, M. Ouazzani5, N. Alami5, Z. Khammar5, R. Berrady5
1 Médecine interne et oncohématologie, CHU Hassan II, Fès, Maroc ; 2 Médecine interne et oncohématologie, CHU Hassan 2, Fès, Maroc ; 3 Médecine interne et oncohématologie, CHU Hassan II, Fès, Maroc ; 4 médecine interne, chu Hassan II Fès, Fès, Maroc ; 5 Médecine interne, CHU Hassan II, Fès, Maroc ; 6 Médecine interne, CHU Hassan II. Fès, Fès, Maroc
Introduction. La leucémie à plasmocytes (LAP) constitue une forme rare des leucémies et une manifestation rare du myélome multiple. Il en existe deux variantes, la forme primitive (60 % des cas) est observée de novo chez des patients qui n’ont présenté aucun signe préalable de myélome, alors que la forme secondaire (40 % des cas) consiste en la transformation leucémique d’un myélome multiple déjà connu.
Patients et méthodes. Notre étude, rétrospective, a concerné les patients ayant une leucémie à plasmocytes diagnostiqués et suivis au service de médecine interne et d’oncohématologie de CHU de Fès durant la période allant de janvier 2016 à décembre 2019. Nous en rapportons quatre observations de LAP de novo, à traves lesquels nous discutons les particularités diagnostiques et thérapeutiques de cette affection.
Résultats. Nous avons colligés quatre cas de LAP primaire ou de novo, dont deux hommes et deux femmes avec un sex-ratio H/F de 1. L’âge médian au diagnostic est de 65 ans avec des extrêmes [63-67 ans]. L’altération de l’état général est notée chez tous les patients, les douleurs osseuses sont retrouvées chez deux patients. La présence d’une atteinte extramédullaire est notée chez une patiente (maxillaire supérieur). Le pourcentage moyen de plasmocytes circulants est de 46,5 % et celui de plasmocytes médullaires est de 51 %. Le taux moyen de globules blancs, hémoglobine, et plaquettes est respectivement : 35 200 e/mm3, 6,62 g/dL, 44 550 e/mm3. La gammapathie monoclonale est de type IgG chez deux cas, IgA dans un cas, et de chaînes légères de type lambda dans un cas. L’étude cytogénétique est réalisée chez un seul patient revenue sans anomalies. L’insuffisance rénale est notée chez deux patients, alors que l’hypercalcémie est objectivée chez un seul patient. Sur le plan thérapeutique, deux patients sont traités par une polychimiothérapie type VDT, et deux patients traités par VCD. Aucun patient n’a bénéficié d’autogreffe de cellules souches hématopoïétiques. Pour l’évolution : la réponse thérapeutique était complète chez un patient mais transitoire, une progression est notée chez trois patients. Les quatre patients sont décédés avec un délai moyen de décès de 5,5 mois, deux patients par un choc septique, une patiente par une embolie pulmonaire et un patient par un syndrome hémorragique.
Conclusion. Nos résultats confirment les données de la littérature, la leucémie à plasmocytes est une variante rare très agressive, et qui reste d’évolution et de pronostic sombre malgré l’utilisation de nouveaux agents incluant les inhibiteurs de protéasomes.
14-35
Prise en charge du myélome multiple chez le sujet âgé marocain
S. Atik*1, L. Hamri1, I. Khoussar2, W. Ghandour3, R. Felk4, S. Saoudi5, M. Bouzaid5, L. Abarkan6, N. Al-Saddiq5, A. Oudrhiri3, S. Bouchnafati3, N. Oubelkacem5, N. Alami1, M. Ouazzani5, Z. Khammar5, R. Berrady5
1 Médecine interne et oncohématologie, CHU Hassan II, Fès, Maroc ; 2 Médecine interne et oncohématologie, CHU Hassan 2, Fès, Maroc ; 3 Médecine interne et oncohématologie, CHU Hassan II, Fès, Maroc ; 4 médecine interne, chu Hassan II Fès, Maroc ; 5 Médecine interne, CHU Hassan II, Fès, Maroc ; 6 Médecine interne, CHU Hassan II, Fès, Maroc
Introduction. Le myélome multiple (MM) est caractérisé par une prolifération plasmocytaire monoclonale d’origine médullaire de plus en plus fréquente du fait du vieillissement de la population. Plus de 66 % des patients sont âgés de plus de 65 ans lors du diagnostic. La prise en charge du myélome dans cette tranche d’âge est différente compte tenu de la fragilité de ces patients et la fréquence de la toxicité des différents agents thérapeutiques.
Patients et méthodes. Étude descriptive colligeant tous les patients suivis pour myélome multiple nouvellement diagnostiqués entre janvier 2012 et décembre 2019 et dont l’âge est supérieur ou égal à 65 ans. L’objectif de cette étude est de déterminer les particularités épidémiologiques, cliniques, paracliniques et thérapeutiques chez ces patients.
Résultats. Soixante et un patients sont colligés dans cette étude dont l’âge est supérieur ou égal à 65 ans soit 34,8 % de tous les cas du MM (175 cas). La médiane de l’âge est de 71, 29 ans (± 6,25 ans), et des extrêmes [65-91 ans]. Le sex-ratio H/F est de 1,18. Trente-trois pour cent des cas ont des comorbidités. L’HTA est retrouvée dans 14,7 % des cas. Les motifs de consultation les plus fréquents sont des douleurs osseuses dans 85,2 % des cas et le syndrome anémique dans 52,4 %. L’hémoglobine est inférieure à 10 g/dL chez 59 % des cas. Le myélogramme a confirmé le diagnostic dans tous les cas. L’hypercalcémie est retrouvée chez 29,5 % des cas. L’insuffisance rénale est retrouvée chez 32,7 % des cas. À l’électrophorèse sérique ; le pic monoclonal en zone gamma est le plus fréquent (72 %). L’immunofixation sérique est faite chez tous les patients montrant une fixation des IgG chez 62,3 % des cas, et en deuxième lieu une fixation des IgA chez 24,5 % des cas. Pour les MM à chaînes légères, ils représentent 11,4 % des cas. Selon la classification de Salmon et Durie, 83,6 % de nos patients sont classés stade III, 13,11 % stade II et 1,63 % stade I, et selon le score pronostic ISS, 62,3 % ont un ISS à III alors que 24,6 % ont un ISS à II et seulement 13,1 % ont un ISS à I. Sur le plan thérapeutique, les protocoles de chimiothérapie de 1re ligne utilisés sont CDT (44,2 %), MPT/MDT (41 %), MP/MD (3,27 % patients), VDT (1,63 %), VCD (1,63 %), VMP (1,63 %), avec une abstention thérapeutique chez trois patients. On a eu recours à une chimiothérapie de deuxième ligne chez 14,75 % représentée par le protocole VDT chez 6,55 % des cas, CDT chez 4,91 % des cas, DCEP chez 1,63 % des cas et RD chez 1,63 % des cas. Parmi 33 patients évaluables nous avons obtenu : une rémission chez 75,85 % des cas, une progression de la maladie chez 9 % des cas, et une rechute chez 15,15 % des cas.
Conclusion. Dans notre série, Le profil clinique et paraclinique du MM du sujet âgé ne diffère pas de celui du sujet jeune. La personnalisation du traitement selon les scores de comorbidités et selon l’agressivité de la maladie ainsi que l’introduction de nouvelles molécules ont permis d’améliorer le pronostic de nos patients.
14-36
Myélome multiple chez les sujets âgés : aspects clinicobiologiques et évolutifs
N. Ait Amer*, F. Tensaout, H. Moussaoui, F. Belhadri, N. Abdennebi, F. Boukhamia, S. Akhrouf, I. Abderrahim, F. Louar, R. Hamladji, R. Ahmed Nacer
Hématologie greffe de moelle osseuse, CPMC, Alger, Algérie
Introduction. Le myélome multiple (MM) est une hémopathie maligne incurable dont la fréquence augmente avec l’âge. Un traitement est indiqué si le MM est symptomatique dont le type est stratifié en fonction de l’âge du patient et ses comorbidités. Les sujets âgés sont inéligibles à l’intensification.
Patients et méthodes. Sur une période de six ans, de janvier 2013 à décembre 2018, 71 patients (pts) âgés de plus de 65 ans ont été pris en charge pour MM. L’âge médian des patients (pts) est de 74 ans (65-90), le sex-ratio de 0,78 (31 H/40 F). Le délai diagnostic médian est de quatre mois (0-52), le diagnostic est posé sur la prolifération plasmocytaire monoclonale, la présence d’un pic monoclonal, l’immunofixation et le dosage des chaînes légères. Sur les 71 pts, 1 pt vivant sans traitement (TRT) sur un suivi de 30 mois, un pt est décédé avant tout TRT, huit pts sont perdus de vue après un cycle de chimiothérapie et 61 pts ont reçu une chimiothérapie (MP : quatre pts, MPT : 14 pts, VMP : 35 pts, VTD : six pts, VCD : deux pts). Seize pts ont bénéficié d’une radiothérapie décompressive, trois pts d’une laminectomie et six pts d’une hémodialyse pour une insuffisance rénale (IR) aiguë dont deux sont actuellement en IR terminale.
Résultats. Tous les pts présentaient au moins une comorbidité : le diabète et l’hypertension artérielle sont les plus fréquents et retrouvés chez 63 pts (89 %). Sur le plan clinique 51 pts (72 %) étaient en ECOG ≤ 2, des douleurs osseuses ont été retrouvées chez 63 pts (89 %). Sur le plan biologique, le taux moyen d’hémoglobine est de 8,5 g/dL (5,6-14,8), 10 pts (14 %) avaient une IR et neuf pts (13 %) avaient une hypercalcémie dont deux avec trouble de la vigilance. Un pic monoclonal à l’électrophorèse des protides a été constaté dans 65 cas (92 %) avec un taux de composant monoclonal médian était 41 g/L (11-129), l’immunofixation a montré une Ig monoclonale de type : IgG : 37 pts (52 %), IgA : 27 pts (38 %) et IgM : un pt, chaînes légères : six pts (8 %) (Kappa : trois pts et lambda : trois pts). La majorité des pts étaient au stade III : 63 pts (89 %), stade II : sept pts (10 %) et stade I : et un pts (1 %). L’ISS a été précisé chez 64 pts (90 %) = stade I : 12 pts (19 %), stade II : 14 pts (22 %) et stade III : 38 pts (59 %). Parmi les 61 pts traités et évaluables, 53 pts (87 %) ont été en réponse selon l’IMWG : Seize pts (17 %) en rémission complète (RC), 37 (61 %) en réponse partielle (RP) dont sept en très bonne réponse partielle, huit pts (13 %) en échec.
Au 31 décembre 2019, sur un suivi médian de 42 mois (0-74), sur les 53 pts en réponse, 26 pts (49 %) ont rechuté après un délai moyen de 11 mois (2-24) (18 pts sont vivants, sept pts décédés, un pt perdu de vue en rechute), 23 pts (43 %) sont vivants en réponse persistante, deux pts sont perdus de vue en réponse et deux pts décédés en réponse (une embolie pulmonaire, une insuffisance cardiaque). Sur les huit pts en échec, six pts sont vivants et deux sont décédés.
La survie globale (SG) est à 63 % à partir de 60 mois et la survie sans événement (SSE) est à 33 % à partir de 24 mois. Pour les patients traités par le protocole VMP (35 patients), la SG et la SSE à 36 mois est à 78 % et 45 % respectivement.
Conclusion. Des efforts sont à déployer, par l’introduction de drogues innovantes, pour améliorer la SSE dans le MM du sujet âgé non éligible à l’intensification. Nos résultats rejoignent ceux de la littérature concernant le protocole VMP.
14-37
Leucémie à plasmocytes de novo, une dyscrasie plasmocytaire de mauvais pronostic : à propos de six cas
S. Ahchouch*, S. Jennane, EM. Mahtat, I. Ait El Filali, S. Loubnan, K. Doghmi
Hématologie clinique, Hôpital Militaire d’Instruction Mohamed V, Rabat, Maroc
Introduction. La leucémie primitive à plasmocytes ou PPCL (Primary Plasma Cell Leukemia) est une dyscrasie plasmocytaire de novo rare et agressive du myélome, définie par la présence d’une plasmocytose monoclonale sanguine au-delà de 20 % ou au-delà de 2 G/L en nombre absolu.
Patients et méthodes. Il s’agit d’une étude rétrospective descriptive menée au service d’hématologie clinique de l’hôpital militaire d’instruction Mohamed V sur une période de 13 ans (2007-2019). Les dossiers incomplets et les patients perdus de vue ont été exclus de l’étude.
Résultats. Sur un total de 11 patients, six patients ont été colligés. L’âge médian au diagnostic était de 58,6 ans [46-68 ans], avec une prédominance masculine, soit sex-ratio H/F de 0,8. La médiane du délai de consultation est de 10 semaines [6-32]. Au diagnostic, tous les patients ont présenté une altération de l’état général avec un Performance status à 3, un syndrome hémorragique dans un cas (hémoptysie, gingivorragies) et deux d’entre-deux avaient un syndrome infectieux inaugural. Deux patients avaient une localisation extra-médullaire (nodules sous-cutanées, pulmonaires, adénopathies, hépatomégalie et/ou splénomégalie). Tous nos patients avaient une hypercalcémie et une anémie avec ou sans thrombopénie grade 3-4 (41,67 %). 66,67 % des malades présentaient initialement une insuffisance rénale. 83,3 % de nos sujets avaient des lésions osseuses ostéolytiques, avec présence d’un plasmocytome envahissant la selle turcique dans un cas. Une gammapathie monoclonale était retrouvée : IgGλ et IgGκ (50 %), IgAκ (16,67 %), CLL (16,67 %) et non sécrétant dans un cas. La médiane de plasmocytose sanguine était de 3 250 éléments/mm3 [1160-8832]. Un caryotype médullaire avec FISH initiale a été réalisé chez tous les patients mais aucun n’a retrouvé de t(4;14), de del(17p) ou de trisomie du 13 : trois patients (50 %) avaient un caryotype normal, une trisomie du locus MM en 1q21 était présente dans un caset deux étaient en échec. Trois patients ont reçu une chimiothérapie faite d’un triplet comprenant le bortézomib (bortézomib-thalidomide-Dexamethasone) avec obtention d’une VGPR (pour very good partial response)transitoire uniquement. La MRD a été réalisée chez un seul patient. Deux patients ont bénéficié d’une autogreffe de cellules souches périphériques (ASCT) : Un patient a reçus une induction par CTD (cyclophosphamide-thalidomide-dexaméthasone) suivie d’une ASCT tandis qu’un second a été traité par PAD (bortézomib-doxorubicine-dexaméthasone) avant son ASCT. Ces derniers ont reçu un traitement de maintenance par du bortézomib bimensuel avec obtention d’une mission complète chez ces patients. Deux patients en progression sous traitement par VTD et sont décédés après échappement thérapeutique après deuxième ligne de traitement dans un délai moyen de décès de 1,4 mois. Un patient autogreffé est actuellement sous deuxième ligne de traitment par RCD (revlimid-cyclophosphamise-dexaméthasone) après rechute post-ASCT. Le second patient autogreffé est actuellement toujours en rémission complète à 72 mois de recul par rapport à son ASCT.
Conclusion. La PPCL reste une entité rare qui garde malgré un traitement précoce, un pronostic sombre et d’évolution souvent fatale. L’autogreffe, l’allogreffe et les nouvelles stratégies innovantes tels que les anticorps monoclonaux anti-CD38, les inhibiteurs du BCL2 ou encore les CAR-T semblent donner de l’espoir dans le traitement de ce groupe de patients.
14-38
Leucémie à plasmocytes : à propos de six observations cliniques
M. Kasdallah*1, W. Chenbah2, A. Bouatay1, SN. Ben2, A. Khelif2
1 Laboratoire d’hématologie biologique, CHU Farhat Hached Sousse, Sousse, Tunisie ; 2 Hématologie clinique, CHU Farhat Hached, Sousse, Tunisie
Introduction. La leucémie aiguë à plasmocytes (LP) est une prolifération monoclonale maligne de cellules plasmocytaires. Elle est définie par une plasmocytose sanguine supérieure à 2 G/L ou un taux de plasmocytes supérieur à 20 %. Elle se présente sous deux formes : une forme primitive ou une forme secondaire compliquant un myélome multiple (MM). La LP se caractérise par un tableau clinique agressif avec des localisations extra-médullaires fréquentes et des anomalies biologiques (anémie, thrombocytopénie, insuffisance rénale et hypercalcémie) plus sévères que dans le MM.
Patients et méthodes. Nous rapportons six observations de LP (un cas de LP primitive et cinq cas de LP secondaire) survenus pendant une durée de neuf ans.
Résultats. Observations un à 5, LP secondaires. Il s’agit de cinq patients âgés d’âge moyen de 55 ans (40 ans-79 ans) avec un sex-ratio de 1,5. Le motif de consultation était les douleurs osseuses, présent chez tous les patients. L’électrophorèse des protéines sériques a révélé une bande étroite monoclonale en gamma chez deux patients et une hypogammaglobulinémie chez trois patients. L’immunofixation a caractérisé l’isotype IgG lambda chez deux patients, une chaîne légère kappa chez deux patients et une chaîne légère lambda chez une patiente. Le myélogramme a montré une infiltration de 30 à 72 % par des plasmocytes dystrophiques posant le diagnostic de MM symptomatique. L’évolution a été marquée par l’aggravation des douleurs osseuses, l’apparition d’une altération de l’état général et l’apparition d’un syndrome hémorragique chez un patient. L’hémogramme de contrôle a révélé une hyperleucocytose avec présence de plasmoblastes circulants évalués à un taux supérieur à 20 % sur frottis sanguin, ce qui a permis de poser le diagnostic d’une LP secondaire. Observation 6, LP primitive. Il s’agit d’un patient, âgé de 60 ans, admis pour fièvre, douleurs thoraciques et pour exploration de multiples adénopathies axillaires et inguinales. L’immunofixation a mis en évidence une immunoglobuline monoclonale de type IgG Lambda. L’hémogramme a montré une hyperleucocytose à 21 G/L, une anémie sévère macrocytaire arégénérative (Taux d’hémoglobine à 3,8 g/dL) et une thrombocytopénie à 115 G/L. Le frottis sanguin a révélé la présence de 47 % de plasmocytes matures. Le myélogramme a montré une infiltration plasmocytaire à 63 % faite de plasmocytes matures et quelques formes dystrophiques. Le diagnostic d’une LP primitive a été retenu. Le patient a donc bénéficié de trois cures de polychimiothérapie (Vincristine, Melphalan, Cyclophosphamide, Prednisone) avec une bonne réponse marquée par la diminution du taux de plasmocytes circulants à 3 %. Le patient est décédé en quelques semaines suite à une complication infectieuse.
Conclusion. La LP, rare désordre lymphoprolifératif B, reste une maladie incurable et d’évolution fatale. L’examen minutieux du frottis sanguin reste un élément clé du diagnostic qui permet de rechercher une plasmocytose périphérique. L’émergence de nouveaux agents tels que le bortézomibe et les immunomodulateurs, constitue un réel progrès dans la prise en charge de la maladie avec une amélioration de la réponse thérapeutique, de la survie et de la qualité de vie des patients mais qui reste toutefois médiocre.
14-39
Imagerie des lésions osseuses au cours du myélome multiple
M. Jguirim1, S. Boukhris*2, M. Askri1, O. Jomaa1, B. Laabidi2, W. Boufrikha2, S. Zrour1, L. Khefacha3, I. Bejia1, MA. Laatiri4, N. Berguaoui1
1 Rhumatologie, Hôpital Fattouma Bourguiba, Monastir, Tunisie ; 2 Hématologie, Hôpital Fattouma Bourguiba, Monastir, Tunisie ; 3 Laboratoire de biologie, EPS Fattouma Bourguiba, Centre de Maternité et de Néonatologie, Monastir, Tunisie ; 4 Hématologie clinique, CHU Fattouma Bourguiba, Monastir, Tunisie
Introduction. Le myélome multiple (MM) est une hémopathie maligne caractérisée par une prolifération incontrôlée de plasmocytes monoclonaux dans la moelle osseuse. La maladie osseuse est la caractéristique la plus fréquente et représente un marqueur des dommages aux organes cibles. L’imagerie joue un rôle crucial dans le diagnostic et le suivi.
Patients et méthodes. Nous avons étudié rétrospectivement 130 cas de MM diagnostiqués entre janvier 1996 et décembre 2018 dans le département de rhumatologie de Fattouma Bourguiba de Monastir. La classification des lésions osseuses était basée sur la classification de Durie et Salmon.
Résultats. La moyenne d’âge des patients était de 65,4 ans. Le sex-ratio était de 1,36. Les manifestations osseuses étaient la circonstance de découverte et la plainte les plus fréquentes (83,1 %). Des anomalies radiologiques ont été trouvées dans 90,5 % des cas dans les radiographies standard et dans 87,14 % des cas en IRM rachidienne. Les radiographies standard étaient les outils d’imagerie les plus largement utilisés pour le diagnostic et même le suivi après traitement. Le diagnostic et l’évaluation pronostique de la maladie selon la classification de Durie Salmon ont montré nette prédominance du stade III (77 %). En analyse univariée, le MM à chaînes légères, le type de chaîne légère kappa, le pourcentage plasmocytaire, le MM type Ig A et le stade III de Durie Salmon ont influencé négativement le pronostic osseux de nos malades. L’analyse multivariée a identifié le type de chaîne légère kappa ainsi que le stade III de la maladie comme des facteurs prédictifs indépendants associés au pronostic osseux et donc la qualité de vie de nos patients.
Conclusion. Bien que la radiographie conventionnelle soit traditionnellement la modalité d’imagerie standard du myélome multiple, sa faible sensibilité à la détection des lésions ostéolytiques et son incapacité à évaluer la réponse au traitement ont nécessité le recours à des techniques plus sophistiquées, telles que la tomodensitométrie à faible dose au corps entier, IRM corps entier basée sur les séquences STIR et Diffusion, et tomographie par émission de positrons au 18F-fluorodésoxyglucose (FDG-PET/CT).
14-40
L’impact pronostique des paramètres plaquettaires dans le myélome multiple
M. Hadhri*, H. Baccouche, A. Chakroun, Z. Manai, S. Mahjoub, N. Ben Romdhane
Service d’hématologie, Hôpital La Rabta, Tunis, Tunisie
Introduction. Il a été suggéré que les plaquettes jouent un rôle important dans la progression des maladies cancéreuses. Certaines études récentes ont démontré l’impact pronostique négatif des valeurs basses du volume plaquettaire moyen (VPM) dans les cancers, en particulier le myélome multiple (MM).
Nous proposons d’étudier l’impact des paramètres plaquettaires sur le pronostic du MM.
Patients et méthodes. Il s’agit d’une étude rétrospective dans laquelle ont été inclus 41 patients ayant un MM au diagnostic, sur une période s’étalant de juin 2016 à décembre 2019. Les différents paramètres plaquettaires (VPM, PCT : plaquettocrite, IDP : index de distribution des plaquettes) ainsi que les données pronostiques (scores de Durie et Salmon, score international ISS et mortalité) ont été recueillies.
Résultats. Le VPM et l’IDP étaient significativement plus faibles chez les patients ayant un MM de mauvais pronostic selon l’ISS (stade III) que chez les patients avec un MM considéré de pronostic meilleur (stades I et II) (9,1 vs 9,9 fL ; p = 0,02 et 9,5 vs 11,7 fL ; p = 0,003 respectivement). L’IDP était aussi associé à la mortalité dans notre population, avec des valeurs significativement plus basses chez les patients décédés (9,9 vs 12 fL ; p = 0,01). Quant au PCT, il était significativement plus bas chez les patients avec un MM de mauvais pronostic selon le score de Durie et Salmon (stade III) (0,2 vs 0,3 % ; p = 0,02).
Conclusion. Il semble que des valeurs basses des paramètres plaquettaires sont associées à un pronostic défavorable chez les patients ayant un MM. Ces différents paramètres obtenus par un examen de routine simple pourraient être utilisés comme un des marqueurs pronostiques dans le MM.
14-41
Évaluation de l’efficacité d’une double intensification thérapeutique avec autogreffe de cellules souches hématopoïétiques chez des patients à haut risque atteints de myélome multiple
S. Loubnan*, A. Almansoori, L. Vincent, F. Paul, G. Cartron
Département d’hématologie clinique, CHU Montpellier St Eloi, Montpellier
Introduction. L’autogreffe des cellules souches périphériques a été considérée comme l’approche standard du traitement de première ligne du MM chez les patients éligibles à la greffe. Chez certains patients une simple autogreffe ne suffira pas.
L’objectif de ce travail est d’évaluer de l’intérêt de la double autogreffe dans le MM à haut risque cytogénétique.
Patients et méthodes. Il s’agit d’une étude rétrospective monocentrique menée sur une période de 10 ans (entre janvier 2008 et décembre 2018) incluant les patients atteints de myélome multiple, avec au moins une anomalie cytogénétique défavorable notamment : del(17p), t(4;14), gains 1q.
Résultats. Au total, 68 ont reçu une double autogreffe. Parmi eux, seulement 12 patients étaient considérés comme étant à haut risque (29 %).
Parmi les 12 patients inclus dans l’étude, nous comptions six hommes et six femmes.
L’âge médian au diagnostic était de 59 ans (41-65 ans), 33 % des patients avaient un score ISS à 3.
Il s’agissait d’un myélome à IgG kappa pour cinq patients, à IgG lambda pour trois patients, à chaînes légères Kappa pour trois patients et une forme plasmablastique pour une patiente.
La del(17p) était l’anomalie cytogénétique la plus fréquente chez 50 % des patients, cinq patients (42 %) avaient une t(4;14) dont trois avait une double mutation (t(4 ;14) + del(13)) et un patient avait un gain un q.
Tous nos patients ont bénéficié d’une association à base de bortézomib en première ligne.
Après le traitement d’induction et juste avant l’autogreffe, le taux de réponse globale était de 92 % dont 8 % de réponse complète (RC), 67 % de très bonne réponse partielle (TBRP) et 25 % de réponse partielle (RP).
Le temps médian entre le diagnostic et la première intensification autogreffe était de 5,3 mois.
Après la première autogreffe, le taux de RC augmentait à 25 % des patients. Le taux de très bonne réponse partielle (TBRP) et de réponse partielle (RP) était respectivement de 50 % et 25 %.
Le temps médian entre la première et la deuxième autogreffe était de 3,3 mois, et après la deuxième autogreffe le taux de RC augmentait à 33 % des patients. Le taux de très bonne réponse partielle (TBRP) et de réponse partielle (RP) était respectivement de 58 % et 9 %.
Aucun décès n’a été constaté dans les 100 jours post-greffe.
Avec un suivi médian de 46 mois la survie sans progression était 83 % et la survie globale de 66 %.
La médiane de SSP est de 36 mois (25,2-43 mois).
La médiane de SG de 34 mois (24,8-42,6 mois).
Conclusion. Malgré la petite taille de notre échantillon, nos résultats semblent confirmer l’intérêt de la double autogreffe chez les patients à haut risque cytogénétique surtout sur la survie sans progression.
Les études s’intéressant aux bénéfices potentiels de double autogreffe chez le groupe à haut risque sont rares. Les nouvelles recherches prospectives peuvent être intéressantes sur ce sujet.
14-42
Autogreffe des cellules souches périphériques dans le myélome multiple : expérience monocentrique
E. Berred*1, R. Barred1, R. Mansouri1, B. Manel1, S. Kefi1, D. Jabr1, M. Bahri1, H. Ben Neji1, M. Achour2, R. Kharrat3, Y. Ben Abdennebi1, K. Kacem1, R. Belakhal4, B. Meddeb2, L. Aissaoui1
1 Hématologie clinique, Hôpital Aziza Othmana, Tunis, Tunisie ; 2 Service d’hématologie clinique, Hôpital Aziza Othmana, Tunis, Tunisie ; 3 Service d’hématologie, Hôpital Aziza Othmana, Tunis, Tunisie ; 4 Hématologie, hôpital Aziza Othmana, Tunis, Tunisie
Introduction. La chimiothérapie à haute dose avec support de cellules souches est une option thérapeutique importante pour les patients éligibles, atteints de myélome multiple. Malgré l’avènement des drogues innovantes dans les protocoles d’induction, l’intensification par l’autogreffe de CSP reste la pierre angulaire du traitement du myélome multiple du sujet jeune.
Patients et méthodes. Il s’agit d’une étude monocentrique rétrospective menée au service d’hématologie clinique de l’hôpital Aziza Othmana entre juin 2016 et décembre 2018 ayant colligé les patients jeunes (< 65 ans) traités pour myélome multiple selon le référentiel national Tunisien 2016 et ayant bénéficié d’une autogreffe de CSP. Nous avons étudié les réponses postautogreffe et les traitements de consolidation et d’entretien puis nous avons analysé les rechutes et enfin, nous avons calculé les survies globale (SG) et survies sans rechute (SSR).
Résultats. 73 patients ont bénéficié d’une autogreffe de CSP durant la période d’étude, dans un délai médian de sept mois par rapport à la date du diagnostic (3-15 mois).
Le tableau suivant illustre les réponses à trois mois de l’autogreffe.A 3 mois postautogreffe RC VGPR RP progression Non évaluable Statut prégreffe RC n = 7 n = 5 n = 1 VGPR N = 10 N = 22 N = 5 N = 2(1 DC, un PDV) RP N = 2 N = 7 N = 9 N = 1 N = 2 (1 DC, un PDV) N = 19 N = 34 N = 15 N = 1 N = 3
À six mois, 18 patients étaient en RC, 34 en VGPR, 10 en RP, cinq avaient progressé et un patient était décédé.
Seuls 19 patients ont reçu une consolidation par deux cycles VTD (six RP, 13 VGPR à trois mois de l’autogreffe).
À la date de clôture de l’étude, nous avons enregistré 18 rechutes postautogreffe dans un délai médian de 11 mois (3-38 mois) : 11 rechutes précoces et sept rechutes tardives.
À la date des dernières nouvelles, 55 patients sont vivants, 18 sont décédés (14 décès maladie).
Conclusion. L’autogreffe de CSP a permis d’améliorer les réponses au traitement d’induction, particulièrement chez les malades en RP.
Le traitement de consolidation par VTD, indiqué chez les patients en RP+VGPR en postautogreffe, n’a été administré que dans 38 % des cas (19/49).
Aucun patient en RP postautogreffe n’a bénéficié d’une deuxième autogreffe de consolidation.
En l’absence des drogues innovantes (en dehors du bortézomib et du Lénalidomide), les options thérapeutiques restent limitées chez les malades en rechute.
14-43
Particularités des plasmocytoses médullaires réactionnelles
W. Ben Yahia*, N. Ghriss, A. Guiga, E. Belhadjali, A. Bouker, A. Atig, N. Ghannouchi
Service de médecine interne, CHU Farhat Hached, Sousse, Tunisie
Introduction. Une plasmocytose médullaire réactionnelle est une anomalie hématologique rare. Elle se caractérise par un taux de plasmocytes dans la moelle osseuse supérieure à 5 % par rapport à la population cellulaire nucléée en absence d’éléments évocateurs d’une dysglobulinémie maligne. Nous rapportons dans ce travail le profil épidémiologique, clinique et paraclinique des plasmocytoses réactionnelles retrouvées dans un service de médecine interne.
Patients et méthodes. Il s’agit d’une étude monocentrique, rétrospective et descriptive colligeant des patients explorés dans notre service de médecine interne entre les années 2010 et 2019. Les sujets ayant une plasmocytose médullaire réactionnelle étaient étudiés.
Résultats. Nous avons recensé 12 patients d’un âge moyen de 59,2 ans [19-76]. Le sex-ratio H/F était égal à 0,5. Des antécédents pathologiques étaient retrouvés chez sept patients à type d’une hypertension artérielle (n = 5), un diabète (n = 1) et l’association de ces deux derniers dans un cas. Les manifestations cliniques étaient dominées par une altération de l’état général, une fièvre prolongée et un syndrome anémique dans huit cas chacun. Des arthralgies étaient retrouvées dans cinq cas, des douleurs abdominales et un syndrome hémorragique dans deux cas chacun. Les douleurs osseuses n’étaient pas rapportées chez nos patients. Un syndrome tumoral était retrouvé dans sept cas. La biologie montrait une anémie chez tous les patients, associée à une leucopénie dans cinq cas avec une lymphopénie dans trois cas. Une pancytopénie était objectivée dans cinq cas. L’électrophorèse des protides avait montré une hypogammaglobulinémie chez cinq patients et un pic monoclonal chez un autre patient. Le myélogramme, réalisé chez tous les patients, trouvait des plasmocytes matures non dystrophiques ayant un taux moyen de 12,3 % [5-19]. Le diagnostic retenu était un lupus érythémateux systémiques (n = 3), une anémie mégaloblastique (n = 2), un syndrome lymphohistiocytaire (n = 1), un lymphome non hodgkinien (n = 1), un syndrome myélodysplasique (n = 1), une polyarthrite rhumatoïde (n = 1) et une infection virale (n = 1). Le diagnostic restait indéterminé dans deux cas.
Conclusion. Les étiologies de la plasmocytose médullaire réactionnelle sont variées. Elles peuvent être liées à un dysfonctionnement immunitaire auto-immun ou allergique, une infection virale, une origine toxique ou une prolifération maligne. Le contexte clinique et les anomalies biologiques sont d’une grande aide pour établir le diagnostic, mais il est indispensable d’éliminer le diagnostic de myélome multiple avant de retenir le caractère réactionnel de la plasmocytose médullaire.
14-44
Place de la radiothérapie dans la prise en charge du myélome multiple
N. Ben Sayed*1, W. Chambeh2, E. Bouslama3, R. Haifa3, B. Achour3, YY. Ben3, A. Khelif3
1 Service d’hématologie clinique, CHU Farhat Hached, Sousse, Tunisie ; 2 Service d’hématologie clinique, CHU Farhat Hached,  , Tunisie ; 3 hématologie clinique, CHU Farhat Hached, Sousse, Tunisie
, Tunisie ; 3 hématologie clinique, CHU Farhat Hached, Sousse, Tunisie
Introduction. Le myélome multiple représente moins de 2 % de l’ensemble des cancers et 10 à 12 % des hémopathies malignes. C’est une hémopathie maligne due à la prolifération tumorale de plasmocytes monoclonaux dans la moelle osseuse. Les plasmocytes tumoraux produisent une immunoglobuline monoclonale ou un fragment d’immunoglobuline monoclonale (chaîne légère libre) qui peut être décelé dans le sang et/ou dans les urines.
Résultats. Il s’agit d’une étude rétrospective colligeant 64 malades dans le service d’hématologie clinique Farhat Hached de Sousse sur une période de sept ans. L’âge médian des patients était de 55 ans (36 ans-65 ans) avec un sex-ratio à 0,72 (37 F-27 H). Le principal motif de consultation était les manifestations osseuses dans 56 % des cas (douleurs osseuses 40 %, tassement vertébral 3 %, fracture pathologique 3 %, plasmocytome 10 %) suivie de l’insuffisance rénale (12 %). Le composant monoclonal était de type Ig G dans 56 % des cas. 47 % des patients entaient classés haut risque. Une chimiothérapie d’induction était administrée à tous les patients. Un traitement de support par les biphosphonates, antalgiques et radiothérapie était donné respectivement dans 87 %, 81 % et 13 % des patients.
La radiothérapie était donnée à visée antalgique chez les 13 % des patients et décompressive chez 5 % des patients. L’évolution était marquée par régression de la douleur dans 60 % des patients avec disparition de la symptomatologie neurologique chez les deux patients ayant une compression médullaire.
Conclusion. Le traitement du myélome multiple ne relève pas seulement d’un traitement par une chimiothérapie spécifique suivie d’une intensification par autogreffe mais aussi du traitement de support. Ce dernier reconnaît à l’heure actuelle des grands progrès et une attention particulière dans l’ensemble de la prise en charge pour assurer une meilleure qualité de vie aux patients.
![]() This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License
This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License