Virologie
MENUPollution chimique et immunité innée antivirale : des liaisons dangereuses ? Volume 22, numéro 1, Janvier-Février 2018
Introduction
En 2005, le Dr Christopher Wild a proposé le concept d’exposome, une notion qui englobe l’ensemble des facteurs environnementaux auxquels est exposé un organisme de sa conception à sa mort : molécules chimiques présentes dans l’environnement, alimentation, ondes et radiations, interactions sociales, etc. Tous ces facteurs se combinent aux déterminants génétiques et épigénétiques hérités pour modeler le développement d’un organisme et son évolution au cours de la vie. Ce concept est particulièrement important en épidémiologie et en santé humaine dans la mesure où le déclenchement de nombreuses pathologies est directement lié à des facteurs environnementaux. À ce titre, les polluants chimiques sont une composante essentielle de l’exposome et c’est pour englober l’ensemble de ces molécules qu’un autre concept a été proposé, celui de toxome [1]. Nous serions ainsi exposés à plus de 80,000 substances chimiques naturelles ou artificielles dont les effets potentiels sur l’organisme sont très largement méconnus. Pour pallier cette lacune, plusieurs projets ont récemment été lancés en Europe, aux États-Unis et en Asie pour étudier de façon globale et par des méthodes à haut débit les effets potentiels du toxome sur différentes fonctions cellulaires [1].
Les travaux qui évaluent l’impact du toxome sur l’organisme se concentrent en priorité sur les effets cancérigènes, mutagènes et reprotoxiques (substances « CMR ») des polluants chimiques qui sont de loin les mieux documentés. Ces études sont à la base de la réglementation internationale sur les produits chimiques dangereux pour la santé qui est appliquée notamment dans le milieu professionnel, pour les biens manufacturés, les produits d’usage domestique et l’alimentation. Pourtant, le système immunitaire est certainement l’une des composantes de l’organisme les plus sensibles à l’environnement puisque sa fonction première est précisément de détecter les agressions extérieures pour orchestrer une réponse adaptée. L’idée que des polluants chimiques influencent la réponse immunitaire et le développement des infections virales n’est pas nouvelle, et plusieurs études ont permis d’étayer cette hypothèse aussi bien chez les animaux que chez l’homme. Par exemple, les insecticides de la classe des néonicotinoïdes ont, à des doses bien inférieures à la dose létale, des effets immunosuppresseurs démontrés chez les abeilles. Ces molécules augmentent ainsi la susceptibilité des insectes aux infections virales, ce qui contribuerait significativement à l’effondrement des populations d’abeilles constaté depuis le début des années 90 et la mise sur le marché des néonicotinoïdes [2]. De nombreux polluants chimiques ont également un impact avéré sur le système immunitaire des mammifères marins [3]. Du fait de leur position en haut de la chaîne alimentaire et de leur adaptation au milieu marin, ces animaux accumulent certains polluants dans leurs graisses, ce qui leur confère un rôle de sentinelles du milieu marin. En induisant un état d’immunosuppression, des polluants chimiques tels que les métaux lourds ou les dioxines pourraient favoriser la propagation de certains agents infectieux, et notamment l’incidence de certains morbillivirus qui déciment régulièrement les populations de phoques et de cétacés. Chez l’homme enfin, il a pu être établi que la pollution de l’air par le dioxyde d’azote (NO2), l’ozone (O3), les particules fines ou les composés aromatiques polycycliques, augmente très significativement la susceptibilité aux infections virales respiratoires ainsi que la gravité des symptômes associés [4]. Plusieurs études ont notamment établi un lien fort entre le niveau de pollution atmosphérique et le nombre d’hospitalisations liées à des infections virales respiratoires.
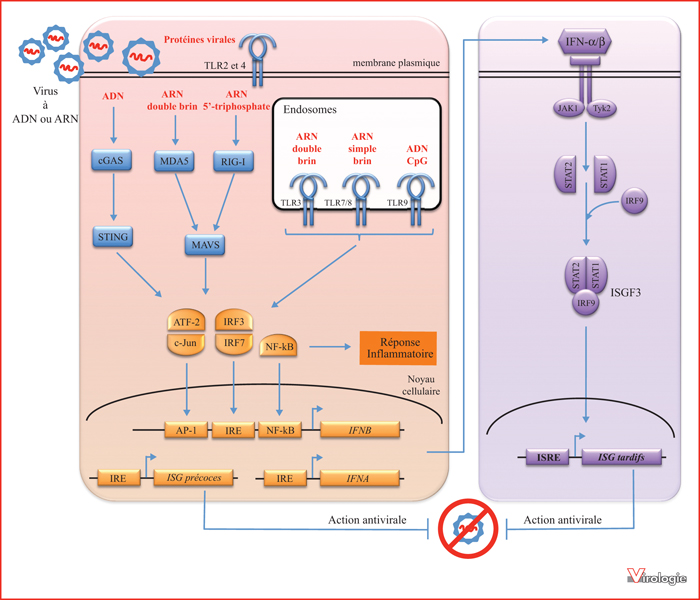
Les polluants chimiques tels que les dioxines peuvent agir sur les réponses immunitaires innées et adaptatives, et impacter la plupart des populations cellulaires impliquées : cellules épithéliales, monocytes, cellules dendritiques, neutrophiles, lymphocytes T et B, cellules NK, etc [5]. Certaines de ces molécules altèreraient notamment une composante essentielle de l’immunité innée antivirale : la réponse interféron de type I (IFN-I). Les IFN-I sont des cytokines produites par la plupart des cellules dès lors qu’elles sont infectées par un virus, ou simplement au contact d’un virus pour certaines d’entre elles, et qui induisent de façon locale et/ou globale un état de résistance en induisant un large ensemble de gènes antiviraux (figure 1). Les IFN-I jouent également un rôle clé dans le déclenchement et/ou le maintien de nombreuses pathologies auto-immunes et inflammatoires comme le lupus érythémateux disséminé, le diabète de type I, la polymyosite ou le Syndrome de Gougerot-Sjögren. En altérant la réponse IFN-I, les polluants chimiques pourraient avoir des effets sous-estimés sur la susceptibilité aux infections virales et le déclenchement de pathologies auto-immunes et inflammatoires. L’objet de cette synthèse bibliographique est de dresser un bilan des interactions connues entre pollutions chimiques et réponse IFN-I, et de présenter certaines pistes qui mériteraient d’être explorées dans le futur.
Les interférons et la réponse immunitaire innée antivirale
Les IFN-I constituent un ensemble de cytokines qui peuvent être subdivisées en cinq groupes : IFN-α, IFN-β, IFN-ε, IFN-κ et IFN-ω [6]. Les IFN-α et β sont les plus étudiés en raison notamment de leur rôle prépondérant dans la réponse immunitaire innée antivirale. Chacun de ces IFN-I est codé par un seul gène, à l’exception des IFN-α qui sont produits à partir de 13 gènes paralogues. Les IFN-I se fixent à leur récepteur membranaire, IFNAR1/2c, ce qui entraîne la phosphorylation des facteurs de transcription STAT1 et STAT2 par les tyrosines kinases JAK1 et TYK2 (figure 1). Une fois phosphorylés, STAT1 et STAT2 s’assemblent en homo ou hétérodimères qui, en association avec IRF9 pour les dimères STAT1/2 ou STAT2/2, activent plus de 300 gènes cibles : les ISG (Interferon-Stimulated Genes). Les produits de ces gènes, tels que MxA ou la tetherin, sont spécialisés dans l’inhibition spécifique d’une étape du cycle viral, ce qui confère aux IFN-I des propriétés antivirales exceptionnelles. Les IFN-I jouent également un rôle essentiel à l’interface entre réponse immunitaire innée et adaptative, ces cytokines contribuant en effet à l’activation, la sélection et l’amplification des lymphocytes T et B spécifiques de l’agent infectieux.
La production d’IFN-I est déclenchée par des motifs moléculaires associés aux pathogènes ou PAMPs (« Pathogen-Associated Molecular Patterns »), et des motifs moléculaires associés aux dommages tissulaires ou DAMPs (« Damage-Associated Molecular Patterns »). Ces PAMPs et DAMPs correspondent à des structures moléculaires présentes spécifiquement dans certains lipides, sucres, acides nucléiques ou protéines, et signalent la présence d’un pathogène ou de cellules endommagées dans le microenvironnement [7]. Ce sont donc de véritables « signaux de danger » pour la cellule. Différentes classes de récepteurs cellulaires, appelés PRR (“Pattern Recognition Receptors”), participent à la reconnaissance des PAMPs et des DAMPs. Les principaux PRR impliqués dans l’induction de la réponse IFN-I sont les récepteurs 2, 3, 4, 7, 8 et 9 de la famille Toll (TLR2/3/4/7/8/9), les récepteurs cytosoliques de la famille RLR (« RIG-Like Receptors ») qui reconnaissent les ARN viraux, et un ensemble hétérogène de récepteur cytosoliques à l’ADN tels que cGAS ou IFI16 (figure 1). À l’exception de TLR2 et 4, les PRR impliqués dans la réponse antivirale reconnaissent essentiellement des acides nucléiques. Une fois activés, ils activent des cascades de signalisation qui convergent toutes vers NF-κB, AP-1 et les facteurs de transcription de la famille IRF (« Interferon Regulatory Factors »), notamment IRF3 et IRF7. Alors que NF-κB et AP-1 contrôlent principalement la réponse inflammatoire, les facteurs IRF3 et 7 se fixent sur les promoteurs de certains ISG pour induire une réponse antivirale précoce. Parallèlement, ils activent la transcription des gènes IFN-I, seuls ou en s’associant à NF-κB et AP-1 dans le cas de l’IFN-β. Une fois sécrétés, les IFN-I activent de manière autocrine et paracrine une seconde vague d’ISG, via le récepteur IFNAR1/2c et la cascade de signalisation JAK/STAT, pour renforcer la réponse antivirale innée au niveau local. Par ailleurs, cette synthèse d’IFN-I entraîne l’expression de chimiokines permettant le recrutement et l’engagement de leucocytes impliqués dans les réponses innées et adaptatives.
Les récepteurs de la famille des Toll, ou TLR (Toll-like Receptor), jouent un rôle central dans l’induction des IFN-I [7]. Ce sont des protéines transmembranaires dont le domaine extracellulaire permet la reconnaissance des PAMPs, alors que le domaine intracellulaire recrute différents adaptateurs qui assurent la signalisation en aval du récepteur, notamment Myd88 pour TLR2/4/7/8/9 et TRIF pour TLR3/4 et potentiellement TLR2. Ces adaptateurs permettent ensuite l’activation d’ubiquitines ligases et de kinases, notamment TBK1 et IKK-ε, qui conduisent à l’activation des IRF3/5/7. Outre la détection de pathogènes présents à l’extérieur de la cellule ou dans les endosomes, les TLR sont impliqués dans la détection de virus ou de bactéries intracellulaires présents dans le cytosol grâce aux mécanismes d’autophagie. Celle-ci permet en effet un transfert plus ou moins spécifique d’éléments du cytoplasme vers la lumière des endosomes, là où pointe le domaine de reconnaissance des TLR. Parmi les principaux TLR impliqués dans la réponse antivirale, TLR3 est exprimé par les cellules dendritiques conventionnelles, ou cDC, les macrophages et les cellules épithéliales et endothéliales de certains tissus, notamment dans les voies respiratoires. Il est localisé à la membrane plasmique ou dans les membranes des endosomes en fonction du type cellulaire et de l’état d’activation des cellules, et reconnaît les ARN bicaténaires. Les récepteurs TLR7, 8 et 9 sont principalement localisés dans les voies endosomiales. Alors que TLR7 et 8 reconnaissent les ARN monocaténaires, TLR9 est un récepteur spécifique des motifs CpG présents dans l’ADN. Si TLR8 est fortement présent dans les monocytes, l’expression de TLR7 et 9 est plus spécifique des cellules lymphoïdes, notamment des lymphocytes B et des cellules dendritiques plasmacytoïdes ou pDC. Ces dernières, bien que minoritaires dans la circulation puisqu’elles représentent moins de 1 % des leucocytes du sang périphérique, jouent un rôle clé dans la production d’IFN-I. Une fois activées, elles produisent en effet 1,000 à 10,000 fois plus d’IFN-α que les autres cellules. À ce titre, elles sont désignées sous le terme d’IPC pour « Interferon Producing Cells » [8]. Enfin, et comme mentionné ci-dessus, TLR2 et 4 peuvent induire l’expression des IFN-I. Ils sont cependant à part dans la mesure où ils ne reconnaissent pas des acides nucléiques mais différents composants des membranes et/ou parois des bactéries, champignons et parasites ainsi que des ligands endogènes comme les protéines de choc thermique (HSP). En outre, TLR2 et 4 répondent à certaines protéines virales, notamment des glycoprotéines d’enveloppe. À ce titre, ces deux TLR semblent jouer un rôle significatif dans la réponse à certaines infections virales. Ils sont notamment exprimés par les cellules de la lignée myéloïde (monocytes du sang périphérique, macrophages résidents des tissus, cellules microgliales, etc), les granulocytes et les cellules épithéliales et endothéliales de différents tissus.
Les récepteurs RLRs constituent l’autre grande famille de PRR impliqués dans la reconnaissance des virus. Elle se compose de trois membres : MDA5 qui reconnaît les ARN bicaténaires de grande taille, RIG-I qui s’active en présence d’ARN bicaténaires ayant une extrémité bi- ou tri-phosphate (3P-RNA), et enfin LGP2 dont le rôle principal semble être de réguler l’activation de RIG-I. Une fois activés, MDA5 comme RIG-I se lient à l’adaptateur MAVS présent à la membrane des mitochondries, ce qui permet ensuite le recrutement des kinases TBK1/IKK-ε et la phosphorylation d’IRF3. Ces récepteurs sont exclusivement cytosoliques et sont donc impliqués dans la reconnaissance des ARN viraux au sein des cellules infectées. Enfin, de nombreux récepteurs intracellulaires, tels que IFI16, LRRFIP1, DHX9, DHX36 ou DDX41, détectent la présence d’ADN dans le cytosol, ce qui est un signal de danger caractéristique de l’infection par des virus à ADN mais aussi de différents stress cellulaires, énergétiques ou génotoxiques. Un système particulièrement remarquable est formé par l’enzyme cGAS et l’adaptateur STING. La protéine cGAS possède un domaine de liaison à l’ADN qui déclenche son activation et la synthèse d’un dinucléotide cyclique, le cGAMP. Cette molécule joue alors le rôle de messager secondaire en se liant à la protéine STING qui, une fois activée, recrute TBK1 et induit la synthèse des IFN-I. Contrairement aux TLRs dont l’expression est limitée aux leucocytes du sang périphérique et à certains tissus qui sont des points d’entrée pour les pathogènes, les récepteurs cytosoliques aux ARN et ADN sont exprimés par la grande majorité des cellules pour permettre une réponse locale rapide aux infections ou aux dommages tissulaires. Enfin, il est important de noter que les IFN-I augmentent l’expression de nombreux PRRs, favorisant ainsi la détection des agents infectieux et l’activation de la réponse immunitaire innée.
Les dioxines et le récepteur AhR
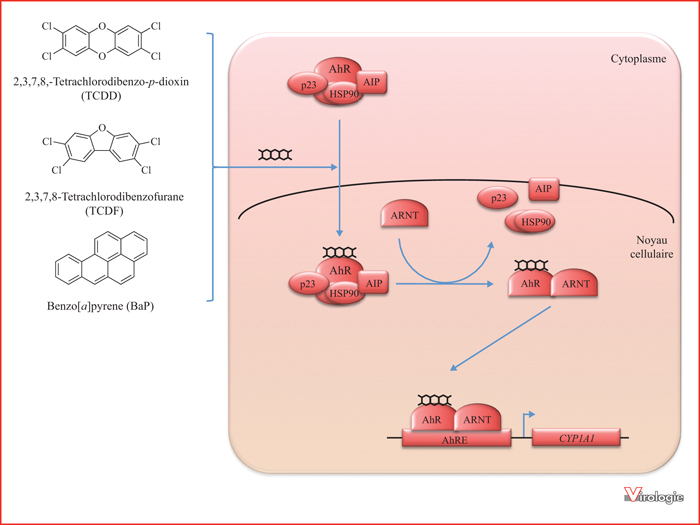
Parmi les polluants chimiques qui font l’objet d’une surveillance accrue, les polychlorodibenzo-p-dioxines (PCDD ou simplement dioxines) ont un impact avéré sur la santé et l’environnement. Ces molécules extrêmement toxiques sont produites par la combustion accidentelle (ou l’incinération sauvage) de matériaux contenant du chlore, mais aussi lors de la fabrication d’herbicides et de certaines matières plastiques. La plus toxique de ces molécules est la 2,3,7,8-Tetrachlorodibenzo-p-dioxine ou TCDD (figure 2). Présentes dans l’agent orange utilisé comme défoliant pendant la guerre du Vietnam, les dioxines sont aussi à l’origine de la catastrophe de Seveso en 1976. Très lipophiles, elles s’accumulent dans la chaîne alimentaire et persistent dans l’organisme pendant des années. Ces composés sont ainsi classés parmi les polluants organiques persistants (POP) majeurs. Outre leur toxicité aiguë, elles pourraient impacter le système reproducteur sur plusieurs générations [9] et ont été associées au développement de cancers [10] et de certaines malformations [11], mais ce dernier point est contesté. Par ailleurs, les dioxines sont d’importants perturbateurs des réponses immunitaires innées et adaptatives, et leurs effets immunosuppresseurs sont assez bien documentés [12, 13].
Les nombreux travaux visant à identifier les mécanismes responsables de l’activité des dioxines sur l’organisme ont conduit à l’identification du récepteur AhR (Aryl Hydrocarbon Receptor) [12, 13]. Ce facteur de transcription appartient à la superfamille bHLH/PAS (basic helix-loop-helix Per-Arnt-Sim). À l’état basal, AhR est associé à des HSP90, à la protéine co-chaperone p23, et à AIP (AhR Interacting protein) qui maintiennent AhR dans un état inactif et empêchent sa dégradation par ubiquitination (figure 2). La fixation du TCDD à AhR entraîne un changement de conformation qui démasque un motif d’adressage au noyau. Une fois dans le noyau, AhR s’associe au cofacteur ARNT (AhR Nuclear Translocator) et se fixe sur l’élément de réponse AhRE (AhR Response Element) présent dans le promoteur de nombreux gènes, en particulier des facteurs de détoxification comme les cytochromes P450 (CYP1A1, CYP1A2 et CYP1B). Outre le TCDD et les autres polychlorodibenzo-p-dioxines, il a été montré qu’AhR est un récepteur pour de très nombreux polluants, notamment les hydrocarbures aromatiques halogénés comme les polychlorodibenzofuranes (PCDF), notamment le 2,3,7,8-Tetrachlorodibenzofurane (TCDF ;figure 2), et les hydrocarbures aromatiques polycycliques comme le benzo[a]pyrène (BaP ;figure 2). Ces polluants ne sont pas fabriqués volontairement par l’homme, mais sont produits par la combustion incomplète de dérivés pétroliers ou de charbon de bois pour le BaP ou de matières plastiques chlorées comme le PVC pour les PCDF. Il est à noter qu’AhR est également activé par différents produits naturels exogènes trouvés dans l’alimentation (quercétine, indol-3-carbinol, etc.), ainsi que par des molécules endogènes, notamment des dérivés du tryptophane comme le 6-formylindolo[3,2-b]carbazole (FICZ) ou la kynurénine, la bilirubine ou les acides gras à chaîne courte oxydés comme la lipoxine A4. À ce titre, AhR jouerait non seulement un rôle clé dans la réponse aux xénobiotiques, mais aussi dans un nombre important de mécanismes de régulation endogènes, ce qui serait en réalité sa fonction première [14, 15]. En particulier, l’étude de souris AhR-/- a permis de montrer que l’engagement d’AhR par des ligands endogènes comme la kynurénine participe au rétrocontrôle négatif des réponses immunitaires innées et adaptatives [12, 13]. Il a d’ailleurs été démontré que la kynurénine produite par les pDC activées a une action tolérogène et immunosuppressive notamment en transformant le lymphocyte T helper en T régulateurs [16].
Plusieurs interactions entre AhR et des facteurs de transcription ayant un rôle clé dans la réponse IFN-I ont été mises en évidence. Notamment, il a été montré qu’AhR interagit et régule l’activité des facteurs de transcription STAT1 et NF-κB [17, 18]. Dans les macrophages stimulés par le LPS via TLR4, AhR s’associe directement à STAT1 pour inhiber NF-κB, bloquant ainsi la production d’IL-6 et la réponse inflammatoire [18]. Dans ces mêmes cellules, AhR se lie également au facteur de transcription Sp1 pour réprimer l’induction de l’histidine décarboxylase en réponse au LPS, inhibant ainsi la synthèse d’histamine et d’IL-6 [19]. Outre NF-κB, Sp1, et les protéines STATs, AhR interfère également avec la voie de signalisation TBK1/IRF3, avec pour conséquence un blocage de la production d’IFN-β en réponse à différents PAMPs viraux [20]. En effet, dans des fibroblastes de souris AhR-/-, la phosphorylation de TBK1 et d’IRF3 ainsi que la production d’IFN-β sont fortement augmentées en réponses à divers infections virales ou à des activateurs des voies MAVS et STING. Dans ces mêmes cellules, la réplication des virus de la stomatite vésiculaire ou de la grippe est réduite. Des résultats comparables ont été obtenus en traitant des fibroblastes de souris sauvages avec un inhibiteur spécifique d’AhR, le CH-223191, ou avec des inhibiteurs d’IDO (indoleamine 2,3-dioxygénase), l’enzyme qui catalyse la synthèse de kynurénine à partir du tryptophane [20]. De même in vivo, la synthèse d’IFN-β en réponse au virus de la grippe est augmentée et le titre viral réduit dans les souris AhR-/- par rapport aux souris sauvages [20]. Des résultats identiques sont obtenus en inhibant AhR avec le CH-223191 [20]. Ces résultats démontrent le rôle de régulateur négatif exercé par AhR sur la réponse immunitaire innée antivirale, et le rôle joué par ses différents ligands naturels endogènes. TIPARP, un membre de la famille des poly(ADP-ribose)polymérases (PARP), est l’un des facteurs induits par AhR. Cette protéine jouerait un rôle clé dans la régulation négative de la réponse immunitaire innée antivirale en inactivant TBK1 par ADP-ribosylation [20].
In vivo, il est établi que les dioxines, et en particulier la TCDD, augmentent la morbidité et la mortalité associées à différentes infections infections virales [5]. Même à des doses extrêmement faibles, de l’ordre d’une seule injection allant de 0,01 à 10 μg/kg [21, 22], la TCDD altère la réponse immunitaire au virus de grippe chez la souris et augmente très significativement la mortalité des animaux, même si les effets observés varient grandement en fonction du protocole expérimental et de la lignée de souris utilisée [5]. De même, des souris exposées à la TCDD présentent une sensibilité accrue au coxsackievirus B3 [23]. In vitro, il a également été montré que ce polluant organique augmente la réplication du VIH dans différentes lignées cellulaires [5]. La TCDD stimulerait entre autres la production de TNF-α, lequel activerait de façon autocrine l’expression du facteur de transcription NF-κB et l’expression du provirus [24]. Enfin, il est établi que la TCDD ou d’autres ligands d’AhR augmentent également la réplication du cytomégalovirus humain, à la fois in vivo et in vitro, et serait capable de réactiver le virus d’Esptein-Barr (EBV) sous forme latente [25, 26]. Dans le cas d’EBV, des interactions directes entre AhR et des facteurs viraux tels que EBNA3 semblent impliquées [5]. Chez la souris, la mortalité associée à l’herpèsvirus II (HSV-II) est augmentée par une injection hebdomadaire de TCDD [27]. Enfin, il a été montré que la TCDD augmente in vitro la réplication du BHV-1 (Bovine Herpesvirus 1), un pathogène majeur pour la filière bovine, ce qui semble avoir un effet sur la prévalence de cette infection chez les bovins [5].
En conclusion, les effets de la TCDD et des dioxines sur la réplication virale sont clairement établis, au moins dans des conditions expérimentales, mais restent complexes. Le récepteur AhR a plusieurs rôles bien identifiés dans la réponse immunitaire et serait le médiateur des effets de composés endogènes comme la kynurénine mais aussi de polluants comme la TCDD. Les effets de la TCDD sur les infections virales peuvent ainsi s’expliquer par l’action d’AhR à la fois sur les réponses innées et adaptatives, mais aussi par l’interaction plus ou moins directe d’AhR avec des protéines et/ou des séquences promotrices virales. Les effets spécifiques de ces polluants sur la réponse innée antivirale restent encore peu documentés malgré le rôle bien établi d’AhR sur la production d’IFN-I. Les études à venir permettront sans doute une meilleure évaluation de l’impact des dioxines sur la réponse IFN-I, ainsi que les éventuelles conséquences sur le plan épidémiologique.
Les perturbateurs endocriniens
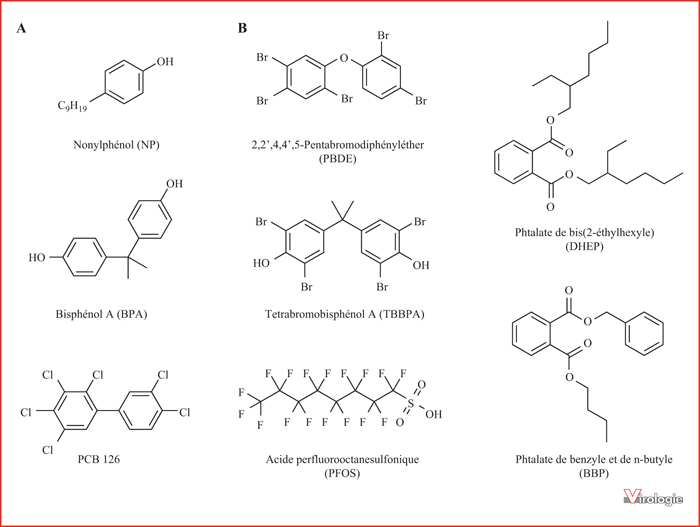
Physiologiquement, il a été montré que les hormones sexuelles régulent la réponse immunitaire innée via les récepteurs aux estrogènes (ER) alpha et bêta [28]. C’est le cas notamment de l’hormone féminine 17β-estradiol ou E2 qui augmente la production d’IFN-α et de TNF-α dans les pDC en réponse à des ligands de TLR7, 8 ou 9 [29]. Les perturbateurs endocriniens sont des substances chimiques qui, en se liant aux récepteurs ER-α/β comme agonistes ou antagonistes, perturbent le fonctionnement de ce système hormonal. Certaines de ces molécules agiraient également de façon indirecte sur les récepteurs aux estrogènes via notamment AhR, des interactions physiques et fonctionnelles ayant été mises en évidence entre ces différents facteurs [12, 13]. Les perturbateurs endocriniens ont des effets délétères sur l’organisme, notamment sur la reproduction, certaines fonctions métaboliques, le système nerveux et l’apparition de cancers. Plusieurs études montrent également un effet des perturbateurs endocriniens sur la réponse immunitaire, et plus particulièrement sur la réponse IFN-I avec des effets variables d’un type cellulaire à l’autre. Parmi ces polluants organiques, on trouve les alkylphénols qui sont largement utilisés dans la fabrication de nombreux produits domestiques (détergents, lubrifiants, résines, parfums, retardateurs de flammes, etc). Certains de ces composés (ou produits de leur dégradation), comme le nonylphénol (NP) et le 4-octylphénol (4-OP), ont en effet des propriétés estrogènomimétiques (figure 3). Dans les pDC, le NP et le 4-OP augmentent la production de TNF-α, et parallèlement répriment la production d’IL-10 et des IFN-I à la fois in vitro et in vivo[30]. Les travaux réalisés montrent que les effets du NP et du 4-OP sur les pDC dépendent en partie de l’engagement des récepteurs aux estrogènes, mais pas uniquement. D’autres récepteurs comme AhR ou le récepteur des androgènes NR3C4 pourraient également être impliqués [31].
Le bisphénol A (BPA) est utilisé comme durcisseur dans la fabrication des plastiques (figure 3). Il a été montré que cette molécule induit à des concentrations nanomolaires l’expression de différents gènes de l’immunité innée, y compris l’IFN-β, dans des monocytes/macrophages purifiés à partir de moelle osseuse de souris [32]. La liaison du BPA au récepteur ER-α serait responsable de ce phénomène. Dans ces cellules, de même que dans la lignée cellulaire THP-1 ou des monocytes primaires humains, le BPA induit également l’activation de STAT1 mais aussi l’expression de NLRP3, un composant de l’inflammasome [32]. Ce complexe ayant un rôle central dans la production de cytokines pro-inflammatoires, le BPA augmenterait ainsi la réponse cellulaire à des ligands pro-inflammatoires de NLRP3. Il a également été montré in vivo chez la souris qu’une exposition in utero et post-natale au BPA augmente à l’âge adulte la perméabilité de l’épithélium intestinal et altère ses fonctions immunologiques, favorisant ainsi les réponses inflammatoires [33]. Chez des animaux ayant subi le même traitement périnatal, la réponse inflammatoire induite par le virus de la grippe au niveau pulmonaire semble en revanche inhibée, mais sans conséquence mesurable sur la charge virale ou la survie des animaux [34]. Des animaux exposés de la même façon au BPA voient également leur réponse au virus de Theiler perturbée, avec une réponse inflammatoire accrue et une atteinte neurologique exacerbée dans ce modèle de sclérose en plaque [35]. Enfin, il a été montré que le BPA, tout comme le 17β-estradiol, inhibe in vitro la réplication du virus de la grippe dans des cellules épithéliale nasales primaires [36]. Cet effet qui est limité aux cellules d’origine féminine et dépend de l’expression du récepteur ER-β reposerait cependant sur une inhibition du métabolisme cellulaire plutôt que sur une modulation de la réponse innée antivirale.
Les polychlorobiphényles (PCB) sont une autre classe de perturbateurs endocriniens (figure 3). Ils ont été massivement utilisés comme isolants électriques dans des transformateurs et condensateurs, mais aussi comme fluides caloporteurs. Dès 1970, il a été montré que les PCB augmentent la mortalité de canards infectés par le virus de l’hépatite [37]. Des souris ayant reçu des PCBs per os sont également plus sensibles à l’herpèsvirus 1 (HSV-1), au virus de la grippe et au virus de l’ectromélie, un poxvirus d’origine murine [38, 39]. Enfin, si plusieurs études épidémiologiques ont montré les effets immunomodulateurs de ces polluants organiques persistants sur la faune aquatique et les mammifères marins en particulier [3], les effets directs des PCB sur l’immunité innée antivirale et la réponse IFN-I en particulier restent à étudier. Cependant, certains PCB ont un mode d’action similaire à celui de la TCDD et se lient à AhR, et devraient avoir des effets immunitaires de même nature.
Les matériaux du quotidien
Les retardateurs de flamme bromés sont utilisés comme ignifugeants dans de nombreux matériaux d’ameublement et de construction, et sont considérés comme des polluants organiques persistants dont l’utilisation est très réglementée. Les polybromodiphényléthers (PBDE) sont les plus utilisés, et des effets sur le foie, le système thyroïdien, le système nerveux et la reproduction ont été mis en évidence (figure 3). Plusieurs études montrent également un impact de ces composés sur la réponse immunitaire innée et la réplication de certains virus. In vitro, le PBDE augmenterait la production de cytokines inflammatoires par les leucocytes humains stimulés au LPS [40]. Chez des souris infectées par le coxsackievirus B3, l’administration d’une dose de PBDE par voie orale (20 mg/kg) augmente significativement la charge virale dans le foie et inhibe l’expression de la chimiokine MCP1 [41]. Chez des souris traitées pendant un mois, il a été montré que le tétrabromobisphénol A (TBBPA), un autre retardateur de flamme (figure 3), augmente la réplication du virus respiratoire syncytial humain (hVRS) ainsi que la réponse inflammatoire [42]. Si les PBDE sont sans effet dans ce modèle basé sur le traitement d’animaux adultes, des souriceaux nés de femelles exposées aux PBDE pendant la gestation répliquent le hVRS à des niveaux plus élevés que des animaux contrôles [43]. S’il est difficile d’extrapoler ces résultats à l’homme ou aux animaux dans leur environnement naturel, ces études ont le mérite d’alerter sur un possible lien entre retardateurs de flamme et susceptibilité aux infections virales.
Les perfluoroalkyles (PFAS) tels que l’acide perfluorooctanesulfonique (PFOS) ou l’acide perfluorooctanoïque (PFOA) sont des tensioactifs, largement utilisés pendant des années comme imperméabilisants, également listés comme polluants organiques persistants (figure 3). Plusieurs études montrent des effets immunosuppresseurs dans des modèles animaux à des doses comparables à celle de travailleurs exposés. Les mécanismes d’action potentiels incluent la prolifération des peroxysomes, les dysfonctionnements mitochondriaux et le stress oxydatif, les effets sur les hormones stéroïdiennes, y compris la progestérone, les œstrogènes et la testostérone, la perte des jonctions communicantes entre cellules et une perturbation des fonctions thyroïdiennes [44]. Dans un modèle d’infection par le virus de la grippe, l’exposition à des doses relativement faibles de PFOS (25 μg/kg) pendant 21 jours entraîne une perte de poids plus prononcée et une surmortalité par rapport aux animaux contrôles [45]. De nombreuses études épidémiologiques suggèrent également qu’un taux élevé de PFAS pourrait impacter la réponse à certains vaccins comme ceux de la rubéole et des oreillons et la protection associée [44]. Enfin, chez les enfants exposés in utero au PFOS, il a été montré une plus grande susceptibilité à diverses infections, notamment d’origines virales [46]. À ce jour, l’effet potentiel des PFAS sur la réponse innée antivirale et la production d’IFN-I n’a pas encore été documenté.
Les phtalates, qui sont utilisés comme additif dans différents matériaux plastiques, sont également des perturbateurs endocriniens et leur présence dans l’environnement domestique est corrélée avec le développement d’asthme (figure 3). Ils agiraient sur différents récepteurs, notamment les PPAR-α et γ (« Peroxisome Proliferator-Activated Receptor »), et différents récepteurs hormonaux tels que ER-α/β et NR3C4 (Androgen Receptor). Les phtalates peuvent influencer la production cytokinique dans les PBMCs humains, avec des effets stimulateurs ou inhibiteurs variables en fonction des cytokines étudiées et de la nature des phtalates testés [47]. Plus spécifiquement sur la réponse immunitaire innée antivirale, Kuo et al. ont montré que le phtalate de bis(2-éthylhexyle) (DEHP) et le phtalate de n-butyle et de benzyle (BBP) inhibent la production d’IFN-I dans les pDC humaines stimulées par un ligand de TLR9 [48]. De plus, au contact de pDC traitées par le DEHP ou le BBP, les lymphocytes T CD4+ voient leur production d’IFN-γ diminuée alors que la production d’IL-13 augmente, ce qui correspond à un basculement du profil cytokinique de Th1 vers Th2. L’ensemble de ces effets des phtalates sur la biologie des pDC pourrait sensibiliser les individus aux infections virales tout en favorisant le développement d’asthme, de réaction allergiques et pathologies inflammatoires chroniques telles que le lupus [49].
Les pesticides (insecticides, herbicides, fongicides)
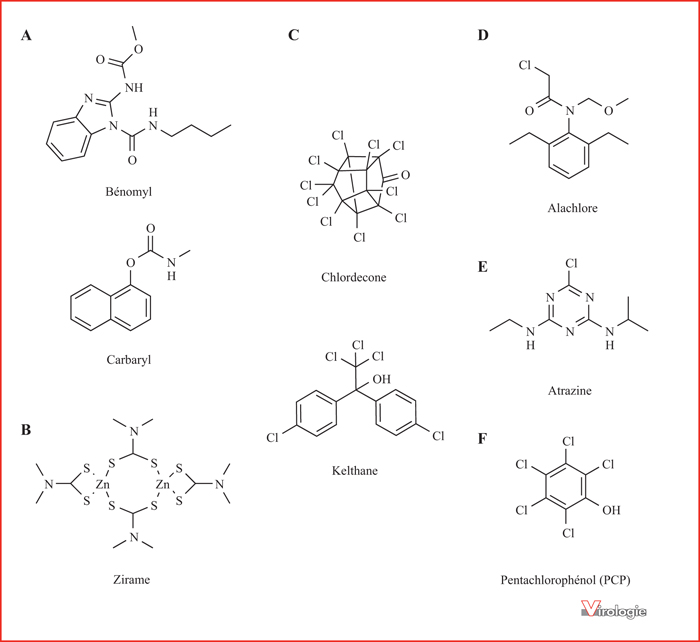
Il a été montré que plusieurs pesticides, insecticides ou herbicides agissent sur la réponse immunitaire innée antivirale (figure 4). Igarashi et al. ont testé les effets d’un large éventail de polluants organiques, dont différents pesticides, sur l’activation de macrophages de souris par des ligands de TLR2 ou TLR4 [50]. En utilisant le facteur de transcription NF-κB, le TNF-α et la synthèse de NO comme marqueurs d’activation, ils ont montré une forte inhibition des voies TLR2 et TLR4 par le bénomyl et le zirame (fongicides de la famille des carbamates et dithiocarbamates, respectivement) et le chlordécone et le Kelthane (des insecticides organochlorés). En utilisant un gène rapporteur comprenant le promoteur de l’IFN-β, ils ont démontré les effets inhibiteurs du bénomyl, du Kelthane, du chlordécone, de l’alachlore (herbicide de la famille des chloroacétamides) et surtout du zirame [51].
Le bénomyl appartient à la famille des carbamates qui comprend de nombreux produits insecticides dont le mode d’action repose sur l’inhibition de l’acétylcholinestérase (figure 4). Un autre membre de cette famille de pesticides est le carbaryl (1-naphthyl methylcarbamate), un contaminant des eaux de surface et des nappes phréatiques. In vitro, il bloque la synthèse de NO et la production d’IFN-β dans des macrophages de souris stimulés par le LPS [52] et favorise le réplication du virus de la varicelle [53]. In vivo, il a été montré que l’exposition au carbaryl de xénopes adultes ou de têtards entraîne une inhibition de la réponse immunitaire au ranavirus FV3 (« Frog Virus 3 »), notamment une baisse de la production d’IFN-I [54]. Chez des xénopes adultes ayant été exposés pendant trois semaines à du carbaryl au stade larvaire, on observe également une augmentation faible mais significative de la charge virale et une immunosuppression. In vitro, cette même molécule inhibe la synthèse d’IFN-I dans une lignée de cellules de poisson en réponse à l’infection par le Goldfish Virus-2 [55].
La simazine est un herbicide de la famille des triazines qui inhibe la photosynthèse. Comme précédemment, il a été montré que la simazine a des effets inhibiteurs sur la synthèse d’IFNs et de TNF-α par des macrophages stimulés au LPS [56]. L’atrazine, un autre herbicide de la famille des triazines (figure 4), inhibe également la réponse immunitaire du xénope au FV3. Ainsi, on observe une inhibition de la synthèse d’IFN-I et de TNF-α chez les têtards traités, ainsi qu’une plus forte mortalité suite à l’infection par le FV3 [57].
Enfin, il a été montré récemment que l’administration per os de pentachlorophénol (PCP) (figure 4), un pesticide utilisé dans le traitement de différents matériaux comme le bois ou la pâte à papier, induit l’expression de nombreux ISGs ainsi que les IFN-I dans le foie des souris traitées [58]. Plusieurs gènes impliqués dans la réponse au stress oxydatif dépendant de Nrf2 sont également induits, ce qui pourrait traduire la métabolisation du PCP en composés producteurs de radicaux libres. Cependant, des effets inverses ont été décrits dans les macrophages de souris traités au LPS où le PCP inhibe l’induction du promoteur de l’IFN-β. Le PCP étant un perturbateur endocrinien bien caractérisé, sa liaison aux récepteurs aux estrogènes pourrait expliquer cette inhibition de la réponse IFN-I [51].
Conclusion et perspectives
Un faisceau concordant de données expérimentales montre que différentes familles de polluants organiques pourraient agir sur la réponse IFN-I. La plausibilité biologique de ces effets est assez forte dans la mesure où ces polluants se lient à des récepteurs comme AhR et ER-α/β dont les effets sur le système immunitaire sont bien établis. Cependant, les études disponibles sont en nombre limité et de nombreuses questions doivent encore être adressées, laissant envisager une sous-évaluation de ce problème. À ce jour, les travaux réalisés se basent principalement sur des modèles cellulaires in vitro et l’utilisation d’animaux de laboratoire pour les études in vivo (souris, rats, xénopes). Il est donc difficile de déterminer si les effets observés sont transposables à l’homme, aux animaux domestiques ainsi qu’à la faune sauvage. Les animaux utilisés comme modèles, et notamment les rongeurs, présentent en effet certaines spécificités métaboliques qui peuvent conduire à minorer (ou majorer) l’immunotoxicité de certains polluants organiques. Par ailleurs, et malgré de vrais efforts dans la conception des protocoles expérimentaux, il est complexe de mimer expérimentalement les effets d’une exposition chronique à des polluants pendant des semaines, voir des années. De même, il reste difficile d’estimer à quelles concentrations les polluants organiques doivent être testés in vitro car certains polluants peuvent s’accumuler spécifiquement dans certains organes ou tissus, et présenter des concentrations locales élevées. Enfin, les études réalisées à ce jour sur la réponse IFN-I ne prennent pas en compte les « effets cocktails », c’est-à-dire des mécanismes de synergies entre polluants organiques présents à des doses très faibles. Il serait donc particulièrement pertinent de tester, au regard des données épidémio-toxicologiques, différents polluants seuls ou en combinaison sur la réponse IFN-I sur différentes populations de cellules immunitaires primaires et en particulier les pDC qui sont spécialisées dans la production d’IFN-I. Enfin, il faudrait étendre l’ensemble de ces études aux interférons de type III (IFN-III ou IFN-λ) découverts plus récemment. En effet, les interférons de type III sont induits et signalent par des mécanismes très proches des IFN-I, et participent également à la réponse antivirale.
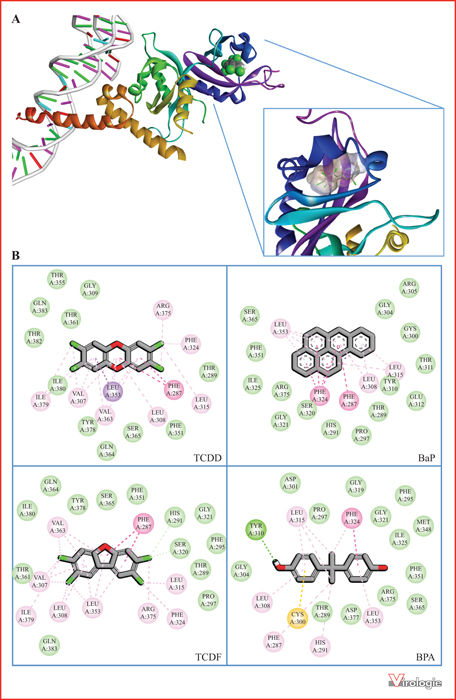
À l’avenir, une étape essentielle sera de compléter ces travaux par des études épidémiologiques, à la fois chez l’homme et sur la faune, pour établir d’éventuelles corrélation entre niveaux de polluants organiques détectés in vivo, réponse IFN-I mesurée ex vivo et propagation des infections virales. Il faudrait de même rechercher si des corrélations existent entre pollution et développement de maladies auto-immunes impliquant les IFN-I. Il est également indispensable de mieux comprendre le mode d’action de ces composés sur la réponse innée antivirale : liaison à AhR pour lequel nous ne disposons pas encore de structure du site de liaison mais seulement de modèles par homologie (figure 5), aux récepteurs aux estrogènes, induction d’un stress oxydatif ou dommages à l’ADN, etc. Enfin, si plusieurs polluants organiques semblent capables d’augmenter la morbidité et la mortalité associées à certaines infections virales, les mécanismes mis en jeu sont probablement multiples : altérations des réponses immunitaires innée et adaptatives, modification du métabolisme à l’échelle cellulaire et de l’organisme, effets sur le microbiote, etc. Dans un environnement pollué qui fragilise les individus et les rend plus sensibles aux infections virales, quelle place joue l’inhibition de la réponse IFN-I ? Cette inhibition de la réponse innée antivirale par l’environnement ne favoriserait-t-elle pas dans certains cas l’émergence de nouveaux virus ? En combinant des études épidémiologiques et l’analyse des effets immunomodulateurs des polluants grâce à des tests in vitro à haut débit, il sera possible de clarifier ces questions. À terme, ces études pourraient déboucher sur une réglementation et un étiquetage des produits chimiques prenant en compte leurs effets sur la réponse immunitaire.
Remerciements
Ce travail a reçu le soutien financier de l’Agence nationale pour la recherche (Programme ChemInnate), de Campus France (programme CEDRE) et du Conseil national de la recherche scientifique libanais.
Liens d’intérêts
les auteurs déclarent ne pas avoir de lien d’intérêt en rapport avec cet article.
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International