e-VEGF-IMMUNO-actu
MENUModèle prédictif des effets du micro-environnement tumoral sur la concentration tumorale de VEGF pendant les traitements anti-VEGF Volume 10, numéro 1, Mai 2015
Cet article du JNCI soulève, une fois de plus, une question qui nous préoccupe depuis longtemps : est-il possible d’utiliser le dosage des isoformes de VEGF pour prévoir la réponse d’un patient à un traitement anti-angiogénique ? L’approche est inhabituelle puisqu’il s’agit d’un travail de modélisation mathématique.
Les méthodes de biologie des systèmes peuvent aider à la compréhension de phénomènes complexes comme celui de l’anti-angiogenèse. Des modèles mathématiques et informatiques peuvent générer et vérifier des hypothèses biologiques et ainsi participer au développement de stratégies anti-angiogéniques plus efficaces [1, 2, 3]. De plus, ces modèles peuvent être prédictifs et aider à l’identification de populations qui répondront mieux à un traitement particulier.
Les auteurs ont développé un modèle moléculaire multi-compartiments de la dynamique de la répartition du VEGF dans l’organisme, basé sur les données expérimentales d’affinité et de cinétique des mouvements moléculaires des agents pro-angiogéniques et d’anticorps anti-VEGF. Ce modèle est un outil prédictif de la distribution du VEGF dans l’organisme et des effets de l’administration systémique d’un anti-VEGF comme le bevacizumab et l’aflibercept. Le modèle a été appliqué à des observations cliniques [4, 5, 6].
Méthodes
Le modèle représentant l’organisme dans son ensemble comprend trois compartiments :
– un compartiment « tissus normaux » ; le tissu musculaire strié a été choisi comme représentatif,
– un compartiment sanguin,
– et un compartiment tumoral.
Les compartiments tissus normaux et tumoraux sont eux-mêmes composés de parenchyme, de cellules endothéliales et d’un espace interstitiel (figure 1A).
Sont prises en compte les interactions moléculaires entre les deux isoformes principales de VEGF (VEGF121 et VEGF1165), les récepteurs R1 et R2 du VEGF et les corécepteurs neuropilines (NRP1 et NRP2) (figure 1B). Dans cette étude, nous avons introduit les interactions entre VEGF et ses deux récepteurs solubles sVEGFR1 et –R2 et l’α-2-macroglobuline (α2M), la sécrétion de VEGF par les cellules endothéliales et les modifications de perméabilité entre le secteur vasculaire et la tumeur. La tumeur modélisée est celle d’une tumeur du sein d’un volume de 33 cm3 (notre modèle est applicable à toute tumeur solide caractérisée). Les éléments quantitatifs du modèle sont basés sur les connaissances expérimentales disponibles des caractéristiques des différentes interactions moléculaires mises en jeu.
Le modèle comprend 154 équations différentielles ; il calcule, en fonction du temps, les concentrations des différents composants étudiés dans les différents compartiments envisagés. Il prédit le niveau de VEGF dans les 3 compartiments modélisés et la distribution de VEGF dans ses formes libres, liées aux récepteurs et à la matrice extracellulaire. Les niveaux de VEGF libre et de VEGFR1 dans l’interstitium et dans le plasma calculés sont donnés dans le tableau 1 et correspondent aux données expérimentales disponibles. Le modèle mathématique a été appliqué pour prédire les effets d’un anticorps anti-VEGF neutralisant comme le bevacizumab. Les constantes de cinétique du bevacizumab ont été utilisées mais celles d’autres agents pourraient aussi bien l’être. On suppose que l’un des indicateurs de l’efficacité du traitement est la réduction du niveau de VEGF dans l’interstitium tumoral. On calcule les variations de concentration de VEGF après un traitement de 3 semaines ; une variation inférieure à 1 correspond à un effet thérapeutique (diminution de la concentration de VEGF tumoral) ; à l’inverse, un facteur supérieur à 1 traduit un effet contre-thérapeutique.
Résultats
Concentration de VEGF dans l’interstitium tumoral
En faisant l’hypothèse d’une faible perméabilité entre le secteur vasculaire et l’interstitium tumoral (10−7 cm/s), le modèle prédit une concentration de VEGF libre dans la tumeur de 26 pM (1 125 pg/mL). Pour une perméabilité plus élevée (10−5 cm/s) plus réaliste [7], la concentration de VEGF libre dans la tumeur sera de 13 pM (585 pg/mL). Le VEGF plasmatique est d’environ 2 pM chez les patients atteints d’une tumeur [8]. Le niveau de VEGF libre tumoral calculé sera donc 7 à 13 fois plus élevé que le niveau plasmatique du VEGF. Ces valeurs calculées sont compatibles avec les données expérimentales et cliniques bien que très peu de mesures fiables de la concentration de VEGF tumoral soient disponibles, si ce n’est dans les liquides d’ascite et d’épanchement pleural qui ne sont pas réellement représentatifs. Quelques études rapportent les taux de concentrations plasmatiques ou sériques. La concentration de VEGF tumoral est environ 10 fois plus élevée que celle mesurée dans le plasma ou le sérum (figure 2) et donc tout à fait en accord avec les valeurs estimées à partir de notre modèle mathématique (13 fois plus élevées dans la tumeur que dans le plasma).
Isoforme prédominante dans l’interstitium tumoral
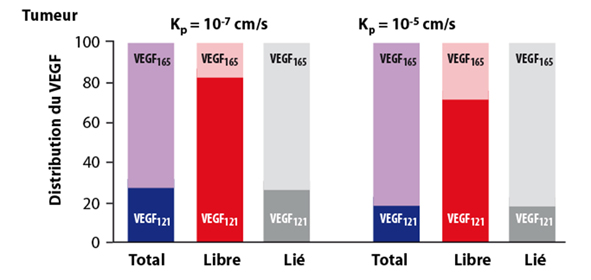
À partir de données expérimentales [9, 10, 11, 12], nous avons configuré notre modèle pour que les isoformes VEGF121 et VEGF165 soient sécrétées en quantités équivalentes par les cellules tumorales [6]. Le modèle prédit pourtant que l’isoforme VEGF121 représente 71 % à 81 % du VEGF libre dans la tumeur selon le degré de perméabilité entre la tumeur et le secteur vasculaire (figure 3). Cette discordance entre sécrétions tumorales et concentrations intra-tumorales vient des différentes constantes d’association entre VEGFs et glycosaminoglycanes (GAG). VEGF165 se lie aux GAG dans la matrice extracellulaire et aux membranes basales [13], alors que VEGF121 ne peut pas être séquestré par la matrice extracellulaire ni par les membranes basales ; cette isoforme représente donc la forme du VEGF libre majoritaire dans la tumeur.
Ces valeurs sont compatibles avec les mesures expérimentales et cliniques qui montrent que le VEGF165 n’est pas l’isoforme prédominante dans les tumeurs. Poon et al. ont rapporté que le VEGF165 représente 27 % du VEGF total dans le cytosol tumoral chez des patients atteints de carcinome hépatocellulaire [14, 15]. Dans le cancer de l’ovaire [16], le VEGF165 représente 24 % à 31 % du VEGF dans le lysat tumoral.
VEGF libre dans l’interstitium tumoral après administration de bevacizumab
De manière contre-intuitive, les taux plasmatiques de VEGF augmentent après un traitement par bevacizumab [17, 18, 19]. Notre modèle explique ce résultat par la dynamique des transports entre les différents compartiments du VEGF, de l’anticorps anti-VEGF et du complexe VEGF-anticorps [4]. Le modèle calcule également que la concentration de VEGF dans la tumeur diminue immédiatement après traitement par un anti-VEGF [4]. La déplétion du VEGF tumoral vers le secteur plasmatique pourrait intervenir dans l’effet thérapeutique du bevacizumab. Il est aussi possible que le VEGF induise la croissance tumorale en activant des récepteurs au VEGF des cellules tumorales, ces derniers récepteurs n’étant pas impliqués dans l’angiogenèse [20, 21]. De plus, le VEGF peut augmenter le pool intracellulaire de VEGFR1 et VEGFR2 par signalisation intracrine [22, 23].
Le modèle prédit que les propriétés spécifiques de la tumeur et de son environnement participent aux variations de VEGF libre intra-tumoral après traitement anti-VEGF [6]. Nous avons modifié la densité des récepteurs du VEGF et de ses corécepteurs dans les cellules tumorales et calculé comment ces variations modifient la réponse au traitement anti-VEGF. Le modèle prédit que la réponse (diminution) du VEGF tumoral au traitement anti-VEGF est « robuste » c’est-à-dire qu’elle varie peu pour des valeurs différentes d’expression des récepteurs VEGFR1 et R2 (figure 4A).
Après traitement anti-VEGF, les taux de VEGF dans la tumeur dépendent également de la proportion des isoformes de VEGF sécrétées par les cellules tumorales. Dans le modèle mathématique utilisé, la quantité de VEGF121 sécrétée a été fixée à différents niveaux entre 0 et 100 % pour déterminer comment cette spécificité de sécrétion tumorale affecte le niveau de VEGF libre dans la tumeur après traitement anti-VEGF. Les simulations sont rapportées dans la figure 4B. Dans tous les cas, le taux calculé de VEGF libre dans la tumeur diminue après traitement anti-VEGF. Il faut remarquer que dans le cas de tumeurs qui ne sécrètent que du VEGF165 et ont un taux d’expression de NRP élevé, le taux de VEGF libre tumoral n’est pas modifié par le traitement anti-VEGF.
La concentration de VEGF intra-tumorale dépend évidemment de la capacité de ces cellules à sécréter du VEGF. Nous avons modifié, dans le modèle, la sécrétion tumorale de VEGF autour de son niveau basal (déterminé expérimentalement) en gardant une proportion des deux isoformes de 50:50. Une fois de plus de façon contre-intuitive, le modèle prédit une augmentation des taux de VEGF libre dans la tumeur après traitement, et ce, surtout dans les tumeurs qui sécrètent peu de VEGF (figure 4C). Nos simulations indiquent dans quelles conditions le VEGF tumoral diminue et identifient les conditions pour lesquelles les concentrations de VEGF plasmatiques et tumoraux augmentent après traitement anti-VEGF (figure 5A). Ce comportement apparemment paradoxal dépend directement du trafic du VEGF et du complexe VEGF-anticorps entre les différents compartiments et de la liaison VEGF/anti-VEGF. On observe deux phases temporelles distinctes (figure 5B).
Immédiatement (pendant les 15 premières heures) après injection de l’anti-VEGF, l’anticorps se fixe au VEGF libre plasmatique, entraînant une déplétion de celui-ci (phase 1 dans la figure 5B, première ligne schéma central). Le médicament anti-VEGF diffuse dans le compartiment tissulaire et tumoral où il se lie au VEGF, entraînant une diminution de la concentration de VEGF dans le liquide interstitiel des tissus sains et tumoraux (phase 1 dans la figure 5B, première ligne schémas de droite et de gauche).
Deux possibilités pour la deuxième phase temporelle (> 15 heures) : dans la première (phase 2A), le complexe anti-VEGF/VEGF tumoral est transporté vers le compartiment sanguin (phase 2A dans la figure 5, schéma de droite). En raison des fortes concentrations de complexe VEGF/anticorps dans le plasma, le sens de la réaction de liaison entre VEGF et anti-VEGF s’inverse, la concentration de VEGF plasmatique augmente au-delà de sa valeur prétraitement. Dans la phase 2B, le VEGF plasmatique augmente au-dessus de sa valeur prétraitement et le VEGF tumoral peut également augmenter au-delà de ses valeurs avant traitement. L’augmentation du VEGF tumoral est due à l’extravasation du complexe anti-VEGF/VEGF du plasma vers la tumeur combiné à un découplage de la liaison VEGF-anticorps dans la tumeur. Les variations résultent des différences de concentration entre VEGF libre, anti-VEGF libre, complexe VEGF-anti-VEGF dans la tumeur et dans le sang.
Il y a peu de données cliniques et expérimentales à confronter avec le modèle mathématique. Chez la souris, les résultats diffèrent selon les études [22, 23]. Chez l’homme, les niveaux de VEGF tumoral après administration du traitement anti-VEGF n’ont pas été mesurés. Ce paramètre devrait pourtant être primordial pour prédire l’effet du traitement sur la tumeur. Notre système de modélisation permet, à partir d’hypothèses simples et vérifiées, de mieux prévoir les effets du traitement et de mieux comprendre les mécanismes impliqués.
En résumé, on explique très simplement la possibilité d’une augmentation des concentrations de VEGF plasmatique et tumoral après traitement par un anti-VEGF par des équations qui décrivent les réactions biochimiques et les transports de molécules dans les différents compartiments.
Discussion
Limites du modèle
Le modèle ne prend pas en compte le rôle éventuel d’autres isoformes du VEGF, comme le VEGF189 qui intervient également dans l’angiogenèse [24] ou comme le VEGFxxxb, faiblement exprimé, qui pourrait être anti-angiogénique [25, 26, 27] ou faiblement angiogénique [28]. Nous ne disposons pas d’assez de données expérimentales sur ces isoformes pour les incorporer au modèle mathématique. De plus, les plaquettes sont des sources connues de VEGF dont nous n’avons pas tenu compte dans notre modèle [29, 30] ; elles sont également capables de séquestrer le bevacizumab [31]. Le compartiment « tissus sains » du modèle a été caractérisé à partir de données disponibles sur le muscle strié. Ce tissu représente une part importante du poids du corps et ses capacités de sécrétion et de captage du VEGF sont connues. Enfin, bien que le bevacizumab associé à une chimiothérapie induise en général une réduction de la taille de la tumeur, nous avons fixé, dans notre modèle, un volume de tumeur constant de 33 cm3. Toutefois, une simulation de modification du volume de la tumeur n’indique pas que celle-ci a une influence majeure sur les concentrations de VEGF plasmatique ou tumoral. Une tumeur 100 fois plus volumineuse (3 300 cm3) ne modifierait la concentration de VEGF tissulaire et tumoral que de 1 % alors que la concentration plasmatique de VEGF serait multipliée par 1,5. C’est pour ces raisons que nous avons exclu le volume de la tumeur comme élément déterminant majeur du modèle que nous proposons.
Pertinence clinique
Fortes concentrations de VEGF dans la tumeur
Le modèle prédit des concentrations de VEGF libre 7 à 13 fois plus élevées dans l’interstitium tumoral que dans le plasma. Ces valeurs, en accord avec les données cliniques disponibles, impliquent que la signalisation du VEGF dans les cellules endothéliales dépend plus des récepteurs du VEGF situés sur la face abluminale (orientée vers l’interstitium) que des récepteurs luminaux (vers le sang). Nos résultats soulignent l’importance du VEGF interstitiel et minorent celle du VEGF plasmatique. Les effets d’un traitement anti-VEGF pourraient être donc plus liés à la déplétion du VEGF interstitiel qu’à celle du VEGF circulant.
Implication de la prédominance de l’isoforme VEGF121
Le modèle prédit que le VEGF121 est l’isoforme prédominante dans l’intersitium tumoral. Cette donnée est probablement importante à considérer dans le développement de stratégies anti-VEGF. Des études avaient déjà montré que le ciblage de cette isoforme a des effets thérapeutiques majeurs [5]. Des données expérimentales avaient également montré que les tumeurs de la souris qui sur-expriment le VEGF121 recrutent plus de néo-vaisseaux [32] et ont un volume vasculaire plus important que celles qui expriment le VEGF165 ou le VEGF189 [33]. Ces études et notre modèle soulignent le fait que le VEGF121 est un régulateur clé de l’angiogenèse tumorale.
Implication de l’augmentation des concentrations de VEGF après administration d’un anti-VEGF
Notre modèle révèle que selon le micro- environnement tumoral, le traitement par un anti-VEGF peut, soit augmenter légèrement la concentration intra-tumorale de VEGF, soit ne pas la modifier. La prise en compte des propriétés de ce micro-environnement pour des types de tumeurs particuliers nous a permis de mieux comprendre pourquoi certaines tumeurs répondent mieux aux anti-VEGF que d’autres. Cet élément pourrait être précieux pour une meilleure interprétation des données cliniques, surtout dans le cas de résultats négatifs dans certains groupes de patients et pour aider à la définition de futurs essais cliniques. Un pas de plus serait alors fait vers une stratification des patients entre probables répondeurs et non-répondeurs en fonction de paramètres du micro-environnement de la tumeur et vers un traitement plus personnalisé. Un exemple important est celui de l’utilisation d’un anti-VEGF chez des patientes atteintes de cancer du sein pour lequel la FDA a révoqué son accord dans cette indication. Comme on le voit dans la figure 2, le niveau médian de VEGF libre dans le liquide interstitiel tumoral est de 20 pM avec toutefois des écarts de concentrations allant de 1,7 pM à 320 pM [30]. Les valeurs les plus faibles correspondent à des tumeurs sécrétant peu de VEGF (figure 4C) ; le traitement anti-VEGF induirait alors une augmentation du VEGF tumoral après traitement anti-VEGF. Cet exemple souligne l’importance des prédictions de notre modèle mathématique qui indique que le traitement anti-VEGF peut, dans certaines conditions, avoir des effets non seulement contre-intuitifs, mais aussi contre-productifs dans certaines sous-populations atteintes du même type de cancer. La concentration du VEGF121 a été explorée comme un biomarqueur prédictif dans certaines études rétrospectives [34, 35]. De plus, le niveau d’expression de VEGFR et de NRP pourrait également être un biomarqueur prédictif dans les cancers du sein [36] et de l’estomac [37].
Conclusion
Notre modèle est fondé sur des mécanismes moléculaires et biochimiques simples et sur des lois d’échanges entre 3 compartiments (tissus sains, tumeur et sang) ; il permet de mieux comprendre la dynamique de distribution de VEGF dans l’organisme. Les prédictions du modèle sont en accord avec les résultats obtenus avec les traitements anti-VEGF. D’autres travaux seront bien entendu nécessaires pour vérifier la validité de ce modèle dans différents types de cancer, dans les cancers primitifs et dans les métastases et dans différentes populations de malades de façon à améliorer une personnalisation des traitements. Dans cette attente, notre travail peut aider le clinicien à prévoir les différentes réponses possibles des tumeurs au traitement anti-VEGF.
Liens d’intérêts : L’auteur déclare ne pas avoir de lien d’intérêt en rapport avec cet article.