Médecine thérapeutique / Pédiatrie
MENUNouvelles thérapeutiques dans les leucémies aiguës de l’enfant et de l’adolescent Volume 22, numéro 2, Avril-Mai-Juin 2019
Introduction
Dix à 15 % des enfants ayant une leucémie aiguë lymphoblastique (LAL) rechutent, dont deux tiers précocement, et 2 à 3 % des patients sont réfractaires dès la première ligne thérapeutique [1, 2].La survie à long terme après une rechute médullaire varie de moins de 30 % pour les rechutes précoces à 40 à 60 % pour les rechutes tardives.La survie sans événement à cinq ans baisse ensuite considérablement chez les patients en deuxième ou troisième rechute à 27 % et 15 % respectivement [3, 4].Les rechutes après une allogreffe de cellules souches hématopoïétiques (CSH) sont souvent incurables.Le site de la rechute (médullaire vs. extramédullaire), la durée de la première rémission et les anomalies cytogénétiques/moléculaires intrinsèques sont des facteurs pronostics importants [5].Quant aux LAM de novo, la survie sans événement et la survie globale demeurent non optimales à environ 60 et 70 %, respectivement. Le faible taux de rattrapage en cas de rechute avec une survie globale de l’ordre de 33 % nécessite d’intervenir dès la première ligne thérapeutique [6].
Les traitements conventionnels sont associés à une toxicité aiguë et durable qui peut gravement affecter la qualité de vie des patients. Des décès liés au traitement surviennent chez environ 3 à 4 % des enfants ayant une LAL de la lignée Bet les risques sont encore plus élevés chez les patients recevant un traitement de rechute, en raison de la toxicité cumulée.Des séquelles à long terme surviennent dans une proportion importante de patients, souvent plusieurs années après l’administration des médicaments. Enfin, le risque de cancer secondaire est loin d’être négligeable chez les patients les plus lourdement traités.
Il est primordial d’introduire de nouveaux médicaments en association à la chimiothérapie pour en diminuer l’intensité, voire à la place de celle-ci, et de diminuer le nombre de procédures d’allogreffe de CSH grevées d’une mortalité et d’une morbidité importantes. Le tableau 1 rassemble la plupart des nouvelles stratégies pour cibler les cellules leucémiques et les nouveaux médicaments, à l’essai ou déjà proches de la pratique courante. Ceci est expliqué plus en détail dans le texte ci-après.
Cibler les anomalies oncogénétiques des cellules leucémiques
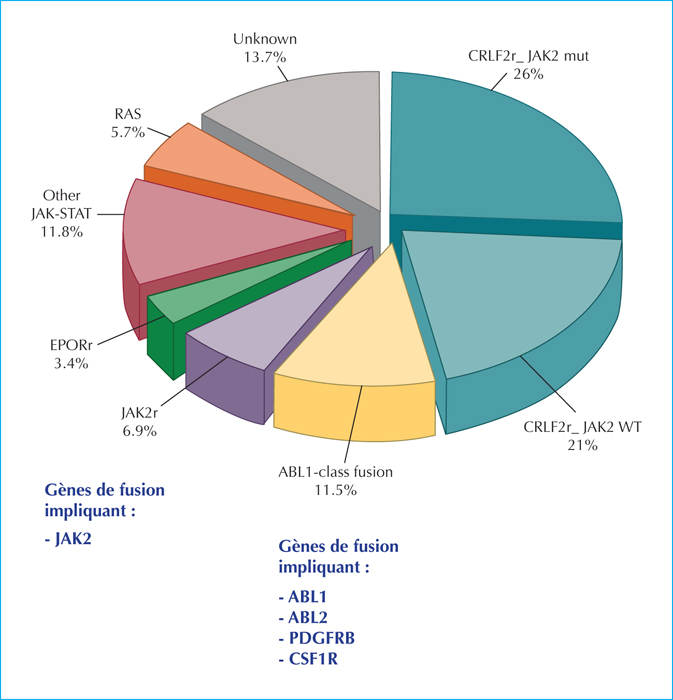
Une fois éliminés les classiques anomalies de nombre chromosomique et les réarrangements les plus communs dans les LAL de la lignée B (LAL-B), il restait 25 à 30 % de LAL historiquement non classables par la biologie, appelées « B autres ». Cette proportion variait avec l’âge : de 10 % des cas des LAL-B dans le groupe pédiatrique dit de risque standard à environ 35 % dans le groupe de haut risque et chez les adolescents/jeunes adultes [7]. Ce groupe de LAL-B est dorénavant mieux démembré et regroupe un certain nombre d’altérations de gènes impliqués dans le développement des cellules B, ou qui dérégulent des récepteurs de cytokines et les voies de signalisation par des kinases [8].Pour identifier ce groupe, il est fait appel à un panel de techniques de biologie moléculaire sophistiquées. La figure 1 montre la répartition de ces sous-types. Il existe suffisamment d’arguments fondamentaux et in vitro qui font penser que cibler ses anomalies pourrait être bénéfique chez les patients.
Dans les LAL de la lignée B « Philadelphie-like »
La signature « Philadelphie-like » (sans la fusion BCR-ABL1 ou chromosome Philadelphie) est un facteur pronostique défavorable chez les enfants et les adolescents ayant une LAL-B. La survie sans événement à cinq ans est inférieure à 60 %. Dans le protocole français actuel de phase III pour le traitement des LAL-B de l’enfant de 1 à 18 ans (appelé CAALL F-01, NCT02716233), il a été décidé de cibler les patients appartenant au groupe LAL avec des anomalies de fusion impliquant ABL1, ABL2, PDGFRB, CSF1R, en échec d’induction ou ayant un taux élevé de maladie résiduelle à l’issue de celle-ci. Un amendement récent y autorise l’ajout de l’imatinib (inhibiteur de tyrosine kinase) chez ces patients à haut risque. En effet, l’expérience de l’Imatinib ajouté à la chimiothérapie intensive existe déjà dans les LAL pédiatriques avec fusion BCR-ABL1. De plus, des études de cas montrent la faisabilité et l’efficacité précoce de l’ajout d’inhibiteurs de tyrosine kinase avec de la chimiothérapie dans les LAL-B « Philadelphie-like » [9, 10].
Dans les LAL de la lignée B avec anomalie de JAK
La famille JAK code pour quatre tyrosine kinases (JAK1, JAK2, JAK3, TYK2) impliquées dans la signalisation JAK-STAT. Des mutations surviennent dans environ 10 % des cas de LAL-B pédiatriques à haut risque. Elles sont associées à des délétions d’IKZF1 et des altérations de CDKN2A/B, rendant le pronostic plus sombre. Les mutations JAK2 sont également associées à des réarrangements CRLF2 (Cytokine Receptor-Like Factor 2), qui codent pour un récepteur thymique de la lymphopoïétine stromale. La dérégulation de CRLF2 se produit dans 5 % à 7 % des LAL-B de l’enfant, et plus fréquemment chez les patients trisomiques (50 % à 60 % des cas). La surexpression de CRLF2 est associée à l’activation de la voie JAK-STAT dans des lignées cellulaires et des progéniteurs B primitifs, responsable de leur prolifération. Il a été démontré que le ruxolitinib, un inhibiteur de JAK2, réduit la charge tumorale dans des modèles de xénogreffes murins contenant la protéine BCR-JAK2 [t(9;22)(p24;q11.2)], et a donné des résultats prometteurs dans le traitement in vitro de cellules leucémiques modifiées, JAK2 mutées et CRLF2 réarrangées [11]. Des cas patients sont signalés avec succès.Un essai précoce de phase I/II pédiatrique est en cours pour tester cette molécule dans ces situations.
Dans les LAM
FLT3 (CD135) est un récepteur transmembranaire tyrosine kinase de type III de la même famille que les récepteurs c-KIT, CSF1R et PDGFR. La voie de signalisation FLT3 joue un rôle critique dans l’hématopoïèse ; elle s’exprime sur les cellules souches/progéniteurs hématopoïétiques CD34+, et son expression de surface est perdue pendant la différenciation cellulaire. Lorsque FLT3 est activé, il phosphoryle des cibles en aval, STAT5, SHIP et SHP-2, et envoie des signaux par des voies oncogènes critiques telles que Ras/Raf/MAPK et PI3K/Akt/mTOR. Les mutations de FLT3 sont l’une des altérations génétiques les plus courantes dans les LAM chez les adultes et les enfants. Les enfants atteints de LAM avec duplication en tandem (ITD) de FLT3 ont une survie sans événement à quatre ans de 30 % lorsqu’ils sont traités par chimiothérapie conventionnelle [12].De nombreux inhibiteurs de FLT3 ont été développés et testés dans les LAM de l’adulte depuis plusieurs années et chez l’enfant plus récemment [13] : midostaurine, lestaurtinib et sorafénib (première génération ; le sorafénib ayant une activité inhibitrice pan-kinase beaucoup plus large) ; quizartinib et crenolanib (deuxième génération) ; gilteritinib (troisième génération, beaucoup plus sélectif sur FLT3). Tous ont été testés et ont donné des résultats divers mais aucun n’est encore utilisé à grande échelle dans des protocoles de phase III (seulement au cas par cas ou sur de petites populations de patients).
Immunothérapie
Anticorps monoclonaux nus ou conjugués
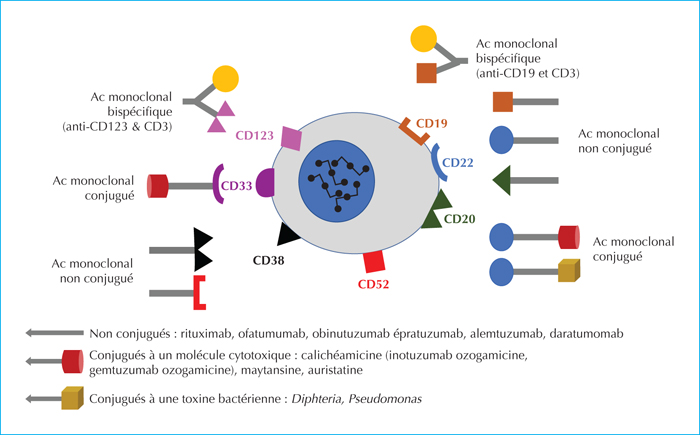
Il s’agit d’utiliser des anticorps monoclonaux plus ou moins humanisés, capables de cibler des clusters de différenciation (CD), qui sont des antigènes spécifiques situés à la surface des cellules d’intérêt. Il faut que la liaison au CD soit suivie d’un effet, soit responsable d’un signal significatif pour la cellule, soit provoquant une internalisation de la combinaison CD/anticorps, mécanisme d’import qu’il est possible d’utiliser pour délivrer une molécule toxique à l’intérieur de la cellule (figure 2). Il faut choisir des CD suffisamment restreints aux cellules leucémiques afin d’obtenir un effet maximum sur les celles-ci et le moins d’effets indésirables sur les cellules normales.
Cibler CD20
Le rituximab est le premier anticorps monoclonal anti-CD20 utilisé depuis les années 1990 pour cibler spécifiquement les lymphocytes B dans les pathologies auto-immunes et les proliférations explosives dues à l’EBV. L’efficacité de l’association du rituximab à de la chimiothérapie intensive dans les lymphomes diffus de type Burkitt ou B à grandes cellules est déjà bien démontrée chez l’adulte et chez l’enfant. Dans les LAL de l’adulte, l’association du rituximab à de la chimiothérapie conventionnelle augmente significativement les chances de survieet ce ceci a été reproduit à plus grande échelle dans l’étude du groupe français GRAALL en 2015 [14]. L’incidence globale des effets indésirables graves n’était pas différente entre les deux groupes avec et sans rituximab. Chez l’enfant, les courbes de survie étant nettement supérieures avec de la chimiothérapie conventionnelle, il n’a pas pu être démontré que l’adjonction de rituximab donnait un avantage supérieur en termes de survie. De nombreux autres anticorps anti-CD20 existent mais ne sont pas testés dans les LAL-B actuellement.
Cibler CD22
CD22 est une lectine de type immunoglobuline transmembranaire. C’est un co-récepteur qui module la signalisation du récepteur des cellules B, augmente le flux de calcium et conduit à l’endocyctose.De plus, il est impliqué dans l’homéostasie et la survie des cellules B périphériques et la progression du cycle cellulaire induite par le récepteur B [15]. Le CD22 est exprimé sur les cellules B en cours de maturation, mais pas sur les cellules souches, les cellules B immatures ni les plasmocytes. En tant qu’antigène restreint aux cellules B, CD22 est approprié pour l’immunothérapie. Son endocytose rapide en fait une cible idéale pour les toxines immunoconjuguées qui peuvent exercer leur cytotoxicité à l’intérieur la cellule cible.Le CD22 est fortement exprimé dans plus de 90 % des cas de LAL de la lignée B chez l’enfant.
L’épratuzumabest un anticorps IgG1 anti-CD22 humanisé dirigé contre le troisième domaine extracellulaire (épitope B) du CD22. Alors que l’épratuzumab ne provoque aucune apoptose directe ni de toxicité dépendante du complément in vitro, il existe des preuves de cytotoxicité dépendante des anticorps in vivo et d’une activité biologique par modulation du récepteur des cellules B [16]. Bien que l’épratuzumab induise une internalisation rapide du complexe anticorps/antigène, les cellules effectrices porteuses de récepteurs Fc gardent suffisamment de possibilités de se lier au complexe et de provoquer une activité cytotoxique. L’épratuzumab est le premier anticorps monoclonal ayant passé avec succès les essais de phase I et II dans les rechutes de LAL-B pédiatriques [17]. Bien que le médicament n’ait pas amélioré les taux de rémission complète, il a augmenté le nombre de patients atteignant des maladies résiduelles négatives comparativement aux témoins historiques. En outre, il n’a pas été pourvoyeur de toxicité supplémentaire en combinaison avec une chimiothérapie intensive. Sa capacité à réduire le niveau de maladie résiduelle en association avec de la chimiothérapie conventionnelle en consolidation chez les enfants présentant une rechute de LAL-B de risque standard a débuté dans un protocole européen de phase III (INTREALL standard risk 2010, NCT01802814) mais cet anticorps n’est plus disponible pour le moment.
L’inotuzumab (INO) est un anticorps monoclonal humanisé lié de façon covalente à un dérivé semi-synthétique de la calichéamicine.Cette immunoglobuline de type IgG4 possède des propriétés intéressantes : il s’agit de l’isotype avec la plus grande demi-vie, elle possède une affinité faible pour le complément et elle est capable d’induire une réponse immunitaire cellulaire via les lymphocytes T cytotoxiques. La calichéamicine est un puissant agent cytotoxique, naturellement produit par un actinomycète [18]. L’INO se lie au CD22 à la surface des lymphocytes B et le complexe INO-CD22 est internalisé en 30 minutes dans le compartiment endosomal de la cellule. Après fusion de l’endosome et du lysosome, la calichéamicine est libérée dans le compartiment intracellulaire par un mécanisme d’acidification entraînant l’hydrolyse du linker acetyl butyrate. Elle est responsable de cassures double brins de l’ADN et entraîne l’arrêt du cycle cellulaire en phase G2/M et la mort cellulaire par apoptose.Les études précliniques ont montré que le degré d’expression du CD22 sur les lignées cellulaires dérivées de LAL n’était pas corrélé à l’efficacité de l’INO [19].
La dose nécessaire et suffisante a été définie dans les essais de phase I/II chez l’adulte. L’administration hebdomadaire a permis de réduire la fréquence des toxicités hépatiques et notamment la survenue d’une maladie veino-occlusive hépatique au cours de procédures d’allogreffe de CSH après INO (11 % vs. 23 %). L’étude INO-VATE ALL, un essai de phase III multicentrique dans les LAL-B de l’adulte, a randomisé l’INO en monothérapie contre la chimiothérapie conventionnelle laissée au choix de l’investigateur [20]. Des réponses ont été obtenues chez 80,7 % des patients du groupe INO vs. 29,4 % pour les patients du groupe chimiothérapie. Quarante et un pour cent des patients du groupe INO ont pu accéder à une allogreffe de CSH contre seulement 11 % dans le groupe chimiothérapie. Des toxicités hématologiques ont été rapportées de façon plus fréquente dans le groupe chimiothérapie. À l’inverse, les toxicités hépatiques étaient plus fréquemment décrites dans le groupe INO, principalement biologiques avec des cytolyses hépatiques et des hyper-bilirubinémies. Onze pour cent des patients ont développé une maladie veino-occlusive contre seulement 1 % dans le groupe chimiothérapie. Le risque semblait plus important lorsque les patients avaient déjà reçu une allogreffe de CSH ou lorsque le conditionnement de greffe associait deux alkylants. Quelques données pédiatriques existent dans la littérature. Les résultats obtenus chez 51 patients âgés de moins de 21 ans ayant reçu de l’INO en traitement compassionnel de leur LAL-B en rechute/réfractaire ont été publiés récemment [21]. Trente-six pour cent des patients étaient en réponse complète et 31 % en réponse incomplète (ORR 67 %) ; 71 % des patients répondeurs avaient une MRD négative (< 10-4). Vingt et un patients ont pu accéder à une allogreffe de CSH. Les effets secondaires les plus fréquemment rapportés étaient des neutropénies fébriles (16 %), des infections (29 %) et des toxicités hépatiques avec une augmentation des transaminases. Aucune maladie veino-occlusive n’a été mentionnée pendant les cycles d’INO. En revanche, 52 % des patients ayant reçu une allogreffe de CSH secondairement ont développé une maladie veino-occlusive, et deux patients en sont décédés. La survie sans événement à un an était de 23,4 % et la survie globale à 36 % après l’INO.
Cibler CD38
Daratumomab est un anticorps monoclonal humain IgG1κ qui se lie avec une grande affinité à un épitope unique de CD38. Cette immunothérapie ciblée attaque les cellules tumorales qui surexpriment CD38, une glycoprotéine transmembranaire, dans diverses affections hématologiques malignes. Le daratumomab induit la lyse des cellules tumorales exprimant le CD38 par des mécanismes de cytotoxicité dépendante du complément, dépendante des anticorps et à médiation cellulaire grâce à l’activation des protéines du complément, des cellules NK et des macrophages [22]. CD38 est exprimé dans de nombreuses affections hématologiques malignes, dont les LAL et les LAM.CD38 est exprimé sur une grande proportion de cellules tumorales de façon comparable chez les enfants et les adultes, et suffisamment pour induire tous les types de cytotoxicité attendue dans toutes les lignées cellulaires [23]. Cet avantage thérapeutique a été confirmé in vivo dans 23 modèles de xénogreffes de cellules de lignées tumorales ou de cellules leucémiques lymphoblastiques de patients chez la souris adulte par rapport à des animaux témoins. Ceci a été observé aussi dans des sous-ensembles agressifs de LAL de lignée T très immatures.Un protocole international de phase II teste actuellement le daratumomab en association avec de la chimiothérapie conventionnelle chez des enfants atteints de LAL-B ou T en rechute/réfractaire.
Cibler CD33
L’antigène de surface cellulaire CD33 est présent chez plus de 80 % des patients atteints de LAM. Comme il est absent sur les CSH pluripotentes, il constitue une cible intéressante pour de l’immunothérapie. Les premières études portant sur le gemtuzumab ozogamicine (GO), un anticorps IgG4 kappa anti-CD33 humanisé lié lui aussi à la calichéamicine, antibiotique toxique quand il se lie à l’ADN, ont montré une activité en monothérapie chez des enfants et des adultes atteints de LAM (réponse globale de 28 à 30 %) [24]. Les essais de phase II ont démontré son efficacité et sa tolérance en association avec de la chimiothérapie.Des enfants, des adolescents et des jeunes adultes âgés de 0 à 29 ans (1 022 évaluables) ayant une LAM de novo ont été inclus dans un essai dans lequel ils recevaient soit une chimiothérapie standard de cinq cycles, soit la même chimiothérapie avec deux doses de GO (3 mg/m2/dose) [25]. GO a considérablement amélioré l’EFS à trois ans (53,1 % contre 46,9), mais pas la survie globale à trois ans (69,4 % contre 65,4 %). Bien que le taux de rémission n’ait pas été amélioré, le risque de rechute diminuait significativement chez l’ensemble des patients ayant reçu du GO. Malgré une augmentation de la mortalité toxique après rémission, la survie sans maladie semblait meilleure dans le groupe GO.GO est actuellement testé en première ligne dans un protocole franco-britannique de phase III (Myechild01, NCT02724163), de façon randomisée, chez des enfants jusqu’à 18 ans ayant une LAM de novo.
Immunothérapie adoptive
Anticorps bispécifiques
CD19 est une glycoprotéine de co-stimulation transmembranaire exprimée par les cellules B normales et malignes à tous les stades de maturation sauf par les plasmocytes. En cytométrie de flux, son expression de surface va de 93 à 100 % ce qui la rend très attractive comme cible. L’inhibition de CD19 sur les cellules B non malignes provoque une aplasie B avec une hypo- voire une agammaglobulinémie. Ceci est censé être transitoire puisque les cellules souches n’expriment pas le CD19 [26].
Blinatumomab est une protéine simple chaîne non immunogène comprenant une partie variable qui reconnaît CD19 et une autre qui reconnaît CD3, le tout relié par un amino-acide glycine-sérine flexible. C’est le premier médicament de la classe des anticorps bispécifiques engageant les cellules T (BiTEs).La cytotoxicité des anticorps monoclonaux dits classiques dépend d’anticorps ou de complément pour tuer une cellule et requiert des cellules immunitaires exprimant des récepteurs Fc comme les cellules NK et les macrophages. Ils sont incapables d’activer directement des cellules T. Les anticorps bispécifiques ont la capacité de se fixer directement sur les cellules leucémiques et les lymphocytes T, induisant une réponse anti-tumorale indépendante du processus de présentation d’un peptide antigénique à une cellule T effectrice. Le lymphocyte T arrimé va d’une part détruire la cellule B par perforation et d’autre part participé à l’expansion rapide d’une population lymphocytaire activée [27]. La demi-vie du blinatumomab est très courte, de l’ordre de 2,11 heures, probablement du fait de sa petite taille et de l’absence de fragment Fc. L’administration de ce médicament doit se faire par voie intraveineuse continue pour obtenir une bonne exposition thérapeutique. La concentration efficace est obtenue en 24 heures et reste constante tant que la perfusion est poursuivie. La pénétration dans le système nerveux n’est pas très bien connue, probablement faible, ce qui nécessite de réaliser une prophylaxie neuro-méningée par de la chimiothérapie, mais probablement suffisante pour être responsable de la neurotoxicité observée. Dans un essai randomisé de phase III chez des adultes ayant une LAL de la lignée B en rechute réfractaire, le blinatumomab améliore significativement la survie globale par rapport à de la chimiothérapie conventionnelle (7,7 mois vs. 4 mois) ; 34 % des patients du groupe blinatumomab atteignent une rémission complète contre 16 % du groupe chimiothérapie [28].Dans un autre essai ouvert de phase II s’intéressant à des patients adultes ayant une LAL de la lignée B en rémission mais avec une maladie résiduelle élevée supérieure à 1.10-3, 78 % ont obtenu une réponse moléculaire complète [29]. Les essais internationaux de phase I/II chez des enfants ayant une LAL-B en rechute/réfractaire avec blastose médullaire supérieure à 25 % ont permis de définir la dose de 5 μg/m2/jour en intraveineuse continue durant les sept premiers jours (syndromes de relargage cytokinique trop importants à des doses de départ supérieures) puis 15 μg/m2/jour les semaines suivantes [30]. À l’issue de deux cycles de 28 jours, 39 % des 70 enfants ayant reçu ce schéma ont obtenu une réponse et la moitié d’entre eux ont une maladie résiduelle indétectable. La toxicité est gérable, principalement hématologique, neurologique et hépatique. L’aplasie lymphocytaire B (aplasie B) nécessite une supplémentation en immunoglobulines polyvalentes. L’essai RIALTO qui a fait suite avec des enfants ayant le même profil de LAL mais pouvant avoir un peu moins de maladie médullaire a montré un taux de réponse supérieur à 60 %, avec 80 % de réponses moléculaires complètes dans ces cas [31]. Moins le patient est blastique, plus il a de chance de répondre et dans ce cas, ceci intervient rapidement durant le premier cycle de 28 jours. Quand la LAL résiste au blinatumomab, cela pourrait être dû à une trop grande blastose par rapport à la capacité de recrutement des lymphocytes T, à une incapacité à recruter des cellules T dans les tissus en cas de localisation extra-hématopoïétique ou enfin à des mécanismes bien décrits de perte de l’expression de CD19 à la surface des cellules leucémiques [32]. Un essai pédiatrique européen de phase III est actuellement en cours dans les premières rechutes à haut risque de LAL-B (IntreALL HR 2010, NCT03590171) randomisant le blinatumomab versus de la chimiothérapie conventionnelle en consolidation de la seconde rémission complète, espérant démontrer que le nombre de patients ayant une maladie résiduelle négative au moment de l’allogreffe de CSH qui suit sera plus important dans le groupe blinatumomab, ce qui pourrait augmenter l’efficacité de l’allogreffe avec une meilleure survie.
Contrairement aux hémopathies de la lignée B, le développement d’anticorps bispécifiques dans les LAM a été limité par l’absence d’antigènes tumoraux d’intérêt jusqu’à peu de temps. CD123, la chaîne alpha du récepteur de l’interleukine 3, est normalement exprimée sur certaines cellules endothéliales, les monocytes, les cellules dendritiques plasmacytoïdes, les basophiles et les progéniteurs myéloïdes.CD123 est surexprimé de façon significative dans une grande proportion (40 à 93 %) de patients atteints de LAM. Il est aussi un marqueur de cellules souches leucémiques quiescentes et est par contre très faiblement ou exprimé de façon négligeable dans les progéniteurs CD341 sains. Le développement préclinique d’un anticorps bispéficique CD123/CD3 est en cours.
CAR T cells
Une nouvelle classe d’immunothérapie est en train de révolutionner la prise en charge des LAL-B en rechute/réfractaire.
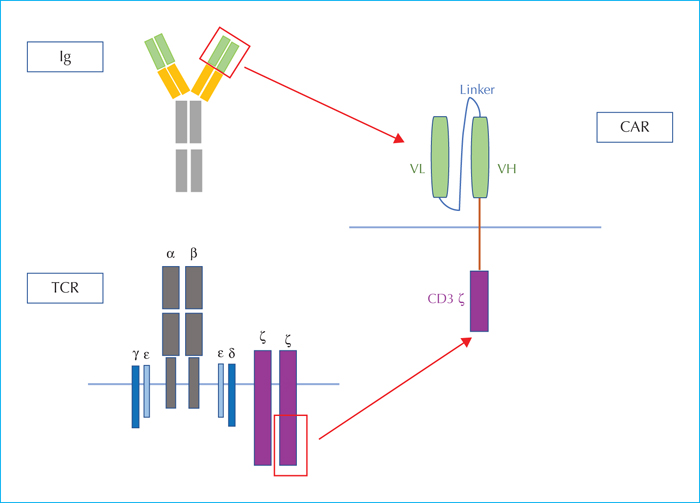
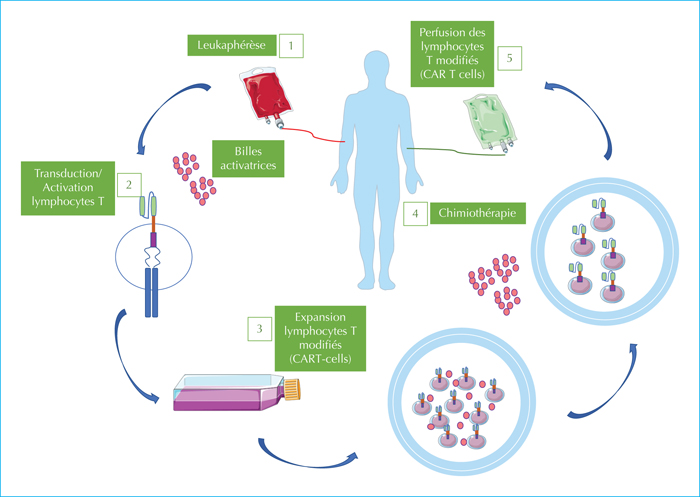
Cette immunothérapie cellulaire adoptive consiste en l’injection de lymphocytes T autologues ou allogéniques modifiés génétiquement pour exprimer un récepteur antigénique chimérique : le CAR (Chimeric Antigen Receptor). Ce récepteur antigénique reconnait une cible de façon indépendante de sa présentation par le complexe majeur d’histocompatibilité. Le concept de CAR a été développé par Gross dès 1989 [33]. Il se compose de trois domaines : un domaine de liaison extracellulaire qui se lie à l’antigène cible ; un domaine transmembranaire ; un domaine de signalisation intracellulaire d’un lymphocyte T qui transmet le signal d’activation. Le domaine extracellulaire est issu de la combinaison de chaînes protéiques venant de la région variable d’une chaîne lourde et d’une chaîne légère d’immunoglobuline (scFv) reliées par un linker de petite taille. Le domaine intracellulaire contient la sous-unité zêta du CD3 (composant du récepteur T) et une ou plusieurs autres molécules de costimulation permettant l’activation et la transmission du signal d’activation du TCR (figure 3). La fabrication des CAR T-cells repose sur l’utilisation de lymphocytes T du patient ou d’un donneur sain recueillis par aphérèse, activés, dans lesquels est introduit un vecteur (lentivirus ou rétrovirus) portant une construction génique contenant le CAR. Les cellules transduites sont amplifiées avant d’être injectées au patient. Le produit final a un statut de médicament « living drug » bien que constitué de cellules vivantes (figure 4). Le choix de la cible reconnue par le récepteur chimérique doit être le plus spécifique possible de la cellule tumorale afin de limiter l’action de la cellule CAR T à un type cellulaire déterminé. Dans les LAL-B, le CD19 représente ainsi un antigène cible presque idéal puisque exprimé dans la plupart des formes de la maladie et restreint à la lignée B dont l’absence peut être palliée par des injections d’immunoglobulines polyvalentes.
Depuis l’initiation des CAR T-cells anti-CD19, plusieurs générations ont été développées. La première génération, sans effet clinique thérapeutique, contient uniquement le domaine de liaison à l’antigène, le domaine transmembranaire et la sous-unité zêta du CD3. Les seconde et troisième générations contiennent la sous-unité zêta du CD3 et une ou plusieurs molécules de costimulation CD28 ou 4-1BB. La quatrième génération est capable d’induire la sécrétion de cytokines suite à la reconnaissance de l’antigène [34, 35]. Les constructions des générations successives ont permis d’améliorer la prolifération cellulaire et ainsi d’augmenter leur efficacité clinique. Les modalités d’administration ont également été modifiées. Initialement, les patients recevaient les cellules T modifiées sans chimiothérapie préalable. Cependant, plusieurs études de phase précoce ont montré l’intérêt d’une chimiothérapie de lymphodéplétion (de type cyclophosphamide plus fludarabine) préalable à la réinjection des CAR T-cells [36, 37]. Le processus de fabrication de ces cellules, assurant la purification des lymphocytes T, leur modification génétique et leur expansion dans le respect des règles de bonne pratique nécessite une durée totale de deux à trois semaines.
Les deux premiers patients atteints de LAL-B CD19+ en rechute et ayant reçu une injection de CAR T-cells anti-CD19 ont été rapportés en 2013 : une réponse complète a été obtenue dans les deux cas, un patient est considéré comme guéri car à plus de six ans du traitement, le second a rechuté à deux mois de l’injection sous forme d’une LAL CD19 négatif. Depuis ces premiers cas cliniques, quatre essais ont été publiés évaluant la faisabilité, l’efficacité et la toxicité des CAR T-cells anti-CD19 chez l’enfant et l’adulte jeune (tableau 2). L’essai multicentrique international ayant regroupé le plus grand nombre de patients rapporte l’efficacité du tisagenlecleucel(CAR T-cells de deuxième génération anti-CD19) chez 97 patients [38]. Soixante-dix-neuf patients ont reçu une injection, dont 61 % après une allogreffe de CSH. Une réponse complète a été obtenue chez 82 % d’entre eux dont 98 % de maladie résiduelle négative. Dix-neuf patients ont rechuté dont 13 sont décédés. La probabilité de survie sans rechute à 18 mois de l’injection est de 66 %, la probabilité de survie globale à 18 mois est de 70 %. Huit patients ont été allogreffés en rémission complète, huit ont reçu un traitement complémentaire autre qu’une allogreffe. Ces très bons résultats obtenus chez des patients réfractaires/ en rechute et lourdement prétraités ont conduit à l’approbation du tisagenlecleucel par la FDA aux États-Unis en août 2017 et l’obtention de l’AMM en Europe en août 2018 dans les indications suivantes : LAL-B réfractaires, LAL-B en deuxième rechute ou plus, LAL-B en première rechute post-allogreffe de CSH. Cependant malgré un taux de réponse très élevé, il existe des rechutes post CAR T-cells de deux types : CD19+ et CD19-. Les rechutes CD19+ sont caractérisées par la présence du CD19 à la surface des lymphoblastes et par un manque de persistance des CAR T-cells. Les rechutes CD19- sont à l’origine de lymphoblastes n’exprimant plus le marqueur CD19, ce qui les rend capables d’échapper à la reconnaissance par les CAR T-cells malgré leur persistance. Ces deux situations nécessitent des prises en charge alternatives. Concernant les rechutes CD19-, des essais cliniques ont été publiés rapportant l’efficacité de l’utilisation de CAR T-cells ciblant un autre antigène de surface, CD22, exprimé également sur la majorité des lymphoblastes. Vingt et un patients ont ainsi été traités, dont 17 après échec d’immunothérapie anti-CD19. Parmi les 15 patients ayant reçu une dose de CAR T-cells supérieur à 1.106/kg, 11 ont obtenu une réponse complète avec une durée médiane de rémission de six mois. Huit patients ont rechuté après une durée médiane de six mois par perte partielle ou totale de l’antigène CD22 [39]. L’utilisation de CAR T-cells bispécifiques anti-CD19/CD22, c’est-à-dire ciblant les deux antigènes simultanément ou de manière séquentielle, est déjà expérimenté en clinique. Ils permettraient de limiter le phénomène d’échappement de la cellule leucémique par perte de l’antigène de surface. Plusieurs essais sont en cours avec des résultats encourageants [40].
La toxicité induite par les CAR T-cells est un des facteurs limitant leur utilisation à plus grande échelle. Il existe une toxicité non spécifique, induite par la chimiothérapie ou l’immunodépression : cytopénies, infections... Mais il existe également une toxicité spécifique à l’immunothérapie : le syndrome de relargage cytokinique, la survenue d’événements neurologiques et l’aplasie B. Le syndrome de relargage cytokinique est dû à l’activation des lymphocytes T génétiquement modifiés en réponse à leur mise en contact avec l’antigène cible. Il se traduit par un relargage de cytokines inflammatoires : IL-6,IL-1, IFN G, IL-5, IL-10, GM-CSF qui conduit cliniquement à une fièvre élevée, des frissons, associées à une instabilité hémodynamique jusqu’à une défaillance multiviscérale. Il survient dans 76 à 100 % des cas dans les jours/semaines qui suivent l’injection de CAR T-cells anti-CD19. Il est réversible dans la majorité des cas mais peut être sévère dans 13 à 47 % des cas. Sa prise en charge est symptomatique et spécifique par l’utilisation de tocilizumab en cas de sévérité (anticorps monoclonal anti-récepteur de l’IL-6) mais repose surtout sur la gestion coordonnée des défaillances d’organe entre le service d’hématologie clinique et un service de réanimation [41]. Sa sévérité est corrélée à la charge tumorale avant injection. La survenue de symptômes neurologiques peut aller de céphalées à un syndrome confusionnel jusqu’au coma ou à un état de mal épileptique dans le mois qui suit l’injection. Ils sont rapportés dans 13 à 49 % des cas et la plupart du temps réversibles [42]. Ils sont dus à une activation endothéliale pouvant conduire à une augmentation de la perméabilité de la barrière hémato-encéphalique. Il est parfois en lien avec la sévérité du syndrome de relargage cytokinique. L’aplasie B a lieu systématiquement après un traitement par CAR T-cells anti-CD19. Elle représente l’effet « on target-off tumor » car l’antigène CD19 est présent de façon physiologique à la surface des lymphocytes B. Sa durée est le reflet indirect de la persistance des CAR T-cells. Elle est prise en charge par des injections d’immunoglobulines polyvalentes. Afin de réduire le risque de toxicité aiguë sévère ou chronique, différentes approches sont étudiées. L’utilisation de CAR inductibles ou de CAR d’expression transitoire permettrait de déclencher le signal d’activation à la demande ou de stopper le signal en cas de toxicité trop importante en injectant une molécule complémentaire en cours de procédure [43].
Les LAL-T ont un pronostic très défavorable lors de la rechute ou en cas de maladie réfractaire. Les cibles potentielles à leur surface sont également présentes à la surface des lymphocytes T : CD5, CD7… La déplétion en lymphocytes T n’est pas substituable et conduit à une immunodépression sévère. De plus, les lymphocytes T modifiés pour exprimer le récepteur chimérique expriment également ces cibles à leur surface, ce qui conduit à une lutte fratricide. Pour pallier ces difficultés plusieurs stratégies peuvent être mises en place. Les CAR T-cells peuvent être modifiés par édition du génome pour ne plus exprimer ces cibles, ce qui empêche cette lutte fratricide et permet leur expansion [44]. D’autres cibles plus spécifiques du clone leucémique, tels que le CDR3, peuvent être utilisées mais nécessitent une approche personnalisée de la construction du CAR pour chaque patient [45]. Des CAR T-cells ciblant des molécules de surface présentes dans les LAM sont en cours de modélisation. Aucun marqueur des myéloblastes n’est spécifique. Le CD33 est un marqueur présent sur 87 % des myéloblastes mais aussi sur les progéniteurs myéloïdes normaux. Le CD123 est présent sur 78 % des myéloblastes mais aussi sur les progéniteurs et cellules hématopoïétiques matures des cellules de la lignée myéloïde. De nombreux essais précliniques ont rapporté une activité in vitro et in vivo des CAR T-cells avec des cibles variées sur des blastes myéloïdes, permettant d’éradiquer la leucémie dans des modèles murins [46]. Mais la toxicité hématologique induite après injection de ces CAR T-cells a conduit à l’utilisation de CAR T-cells anti-CD33 d’expression transitoire par l’incorporation de gènes suicides. Cette approche permettrait la mise en rémission avant un traitement de consolidation par allogreffe de CSH.
Malgré ces résultats très favorables obtenus dans les LAL-B, il est nécessaire de permettre une meilleure accessibilité à ce « médicament vivant ». Les difficultés induites par le recueil de lymphocytes T chez des patients lourdement traités peuvent conduire à un échec de production des CAR T-cells. Il peut être donc nécessaire d’utiliser des cellules T issus de donneurs sains afin de disposer rapidement de cellules modifiées génétiquement pour exprimer le récepteur chimérique sans être limité par le nombre de lymphocytes du patient. Les CAR allogéniques sont une alternative et permettent d’avoir à tout moment des cellules disponibles (« off the shelf »). Cependant les CAR allogéniques nécessitent une inactivation de leur TCR endogène afin de réduire le risque de réaction du greffon contre l’hôte. Actuellement, un essai international de phase I a rapporté les résultats obtenus chez 6 enfants traités par une injection d’UCART19 (CAR allogéniques anti-CD19) suivis par une allogreffe de CSH chez les 5 patients mis en rémission [47].
Rétablir l’apoptose
Le vénétoclax est un inhibiteur puissant, sélectif et disponible par voie orale d’une petite molécule de BCL-2. Il se lie à BCL-2 avec une affinité 500 fois plus élevée que les autres membres de la famille BCL-2, y compris BCL-XL et BCL-w. Antagoniser ces protéines peut améliorer la réponse aux chimiothérapies ou déclencher l’apoptose directement dans certaines cellules tumorales. Vénétoclax a démontré son efficacité dans divers modèles de tumeurs murines de LAL [48]. Tous les modèles portant la translocation t(4;11) sont particulièrement sensibles au vénétoclax, peut-être en raison d’une transcription directe de BCL-2 par la protéine de fusion MLL-AF4.L’expression de BCL-2 est également régulée à la hausse par TCF3-HLF, le produit de fusion de la translocation t(17;19)(q22;p13). Les LAL avec TCF3-HLF forment un sous-type très rare de LAL associé à un pronostic extrêmement mauvais en première ligne [49]. Les échantillons de LAL avec TCF3-HLF sont résistants à plusieurs médicaments conventionnels utilisés dans les schémas d’induction et de consolidation mais sont sensibles au vénétoclax ex vivo et in vivo. Dans la LAM, le vénétoclax en monothérapie (800 mg/jour) a été bien toléré et a montré une activité dans une étude de phase II comprenant 32 patients adultes atteints de LAM récidivante/réfractaire ou nouvellement diagnostiqués chez des patients inaptes à recevoir de la chimiothérapie intensive [50]. L’âge moyen était de 71 ans, le plus jeune avait 19 ans. Dix-neuf pour cent des patients ont obtenu une réponse objective. La durée médiane de réponse était de 48 jours. Une étude de phase I/II a évalué le vénétoclax (600 mg et 800 mg/jour) en association avec de la cytarabine à faible dose chez des patients âgés de plus 65 ans et n’ayant jamais reçu de traitement contre leur LAM [51]. Une faible dose sous-cutanée de cytarabine (20 mg/m2) a été administrée du premier au dixième jour de chaque cycle de 28 jours. Dix-huit patients ont été recrutés pour la phase I. Dans tous les groupes traités par vénétoclax, le taux de réponse global était de 44 %. La dose quotidienne de 600 mg/jour de vénétoclax a été choisie comme celle recommandée en association avec la cytarabine à faible dose. Une autre étude de phase Ib en cours évalue le vénétoclax en association avec un agent hypométhylant, l’azacitidine ou la décitabine, chez des patients âgés de plus 65 ans, non admissibles à un traitement standard, atteints de LAM de novo qui n’ont jamais été traités [52]. Le vénétoclax a été administré quotidiennement aux doses de 400, 800 ou 1 200 mg avec de la décitabine ou de l’azacitidine. L’âge médian était de 75 ans (65 à 85 ans). Les données préliminaires sur l’efficacité ont révélé un taux de réponse global de 62 %. La dose maximale tolérée n’a pas été atteinte, avec des profils d’innocuité similaires à chaque palier de dose de vénétoclax. La dose recommandée pour la phase 2 en association avec des agents hypométhylants est de 400 mg par jour. Un essai de phase I/II est actuellement ouvert pour des enfants ayant des leucémies aiguës en rechute/réfractaires, et d’emblée en première ligne si LAL-B avec réarrangement TCLF3-HLF.
Changer l’expression des gènes – Cibles épigénétiques
L’azacitidine est un analogue de la cytidine qui a été développé dans les années 1960.Ceci a fait suite à l’élucidation du mécanisme de réexpression des gènes par déméthylation de l’ADNet par des données indiquant que l’hyperméthylation des régions promotrices des gènes suppresseurs de tumeur est souvent associée au cancer.Il a été démontré que les analogues de la cytidine comme l’azacitidine induisent la différenciation cellulaire et inhibent la méthylation de l’ADN nouvellement synthétisé. L’azacitidine inverse les changements épigénétiques des cellules malignes en permettant de rétablir la fonction normale des gènes essentiels à la différenciation et au contrôle du cycle cellulaire. Une étude de phase I a traité 37 enfants atteints de leucémie aiguë âgés de 2 à 18 ans en monothérapie pour établir la dose maximale tolérée. L’azacitidine a été administrée pendant 5 jours tous les 14 jours en bolus IV à partir de 2 mg/m2. La dose maximale tolérée se situait entre 150 et 200 mg/m2[53]. D’autres études ont été menées pour évaluer l’association de l’azacitidine avec la chimiothérapie chez des enfants atteints de LAM. En 1988, il a été signalé un taux de RC de 85 % chez 68 enfants atteints de LAM non traitées auparavant avec une dose comprise entre 150 et 200 mg/m2 en association avec de l’étoposide, de la cytarabine, de la daunorubicine et de la 6-thioguanine [54]. Une étude randomisée de phase II a été menée auprès de 41 sujets atteints de LAM qui n’ont pas répondu à un traitement d’induction classique avec une répartition aléatoire des patients soumis à un traitement par l’amsacrine et l’étoposide avec ou sans azacitidine. Le groupe recevant de l’azacitidine (n = 19) a présenté un taux de réponse significativement plus élevé que dans le groupe sans azacitidine (RC 53 % vs. 18 % p = 0,03) [55].
La décitabine est un analogue nucléosidique de la 2’-désoxycytidine dans lequel le carbone #5 de la base nucléosidique a été modifié en azote. Le mécanisme d’action de la décitabine est l’hypométhylation de l’ADN par inhibition irréversible des ADN méthyltransférases. Le traitement par décitabine conduit à la réexpression de gènes suppresseurs de tumeur menant à la différenciation cellulaire, l’apoptose et la sénescence. Les données préliminaires d’une étude de phase I/II chez 10 enfants âgés de 2 à 16 ans atteints de LAM ont permis de montrer que la pharmacocinétique de la décitabine correspondait aux profils pharmacocinétiques connus chez les adultes [56].
Conclusion
L’essor des nouvelles thérapeutiques ciblées offre de nombreux espoirs pour traiter les enfants et adolescents atteints de leucémies aiguës réfractaires ou en rechute. Néanmoins, outre les problèmes de coûts de ces innovations thérapeutiques, leur place respective reste à déterminer aux côtés des chimiothérapies conventionnelles, dès la phase initiale pour les leucémies les plus à risque de rechute, ou uniquement à la rechute pour les leucémies aiguës semblant répondre favorablement aux traitements conventionnels.
Liens d’intérêts
BB : interventions avec contrat concernant le blinatumomab dont Amgen SAS est propriétaire. MED déclare n’avoir aucun lien d’intérêt en rapport avec l’article.Points à retenir
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International