Hépato-Gastro & Oncologie Digestive
MENUPrévention de la neutropénie sous chimiothérapie en cancérologie digestive Volume 26, supplément 1, Octobre 2019
De façon générale, la prescription d’une chimiothérapie cytotoxique expose à un risque de toxicité hématologique et, en particulier, de neutropénie. Celle-ci peut se compliquer d’une infection susceptible de mettre en jeu le pronostic vital du patient. La neutropénie fébrile est un effet indésirable majeur des chimiothérapies cytotoxiques. Ce type d’effet indésirable impacte la prise en charge de la maladie en termes de morbidité, de mortalité, de qualité de vie, de report de cures et de réduction de doses de chimiothérapie. Tous les médicaments anti-cancéreux et tous les schémas de chimiothérapie anti-cancéreuse ne sont pas associés au même risque de neutropénie. Les nouvelles classes d’anti-cancéreux du type « thérapies ciblées » telles que les anticorps monoclonaux thérapeutiques (panitumumab, bévacizumab…) et les petites molécules inhibitrices de tyrosine kinase (imatinib, sorafénib…) ne présentent pas ou peu de risque de toxicité hématologique.
Le risque de neutropénie sévère chimio-induite dépend de facteurs liés aux médicaments cytotoxiques mais également de facteurs liés au patient. Pour un même médicament ou un même schéma de chimiothérapie, il existe une variabilité inter-individuelle et également intra-individuelle associée à la survenue d’une neutropénie. Les facteurs de variabilité sont par exemple des variations du métabolisme du médicament liées à des polymorphismes fonctionnels de gènes qui codent des enzymes impliquées dans le métabolisme du médicament. Des facteurs plus généraux tels que le sexe, l’âge et l’état nutritionnel sont également des facteurs de variabilité des effets toxiques des médicaments et, en particulier, du risque de toxicité hématologique. L’altération du fonctionnement d’organes impliqués dans l’élimination des métabolites actifs des médicaments telles que des altérations de la fonction hépatique ou rénale intervient également dans cette variabilité.
Les schémas de chimiothérapies cytotoxiques prescrits en cancérologie digestive sont généralement moins hémato-toxiques que ceux prescrits dans le lymphome ou le cancer du sein. Toutefois, il est constaté ces dernières années une augmentation de la prescription de schémas plus hémato-toxiques tels que le FOLFIRINOX. Parallèlement, la gestion du risque de toxicité, en particulier hématologique, lié à la prescription des fluoropyrimidines (5-FU et capécitabine) contenu dans la grande majorité des schémas de chimiothérapie prescrits en cancérologie digestive, a été bouleversé par la généralisation récente de la recherche d’un déficit en dihydropyrimidine déhydrogénase (DPD). L’apport de la pharmacogénétique dans l’analyse de polymorphismes génétiques de gènes codant des enzymes du métabolisme de médicaments anti-cancéreux se développe également. Notamment, la recherche du variant allélique UGT1A1*28 du gène qui code l’UGT1A1 qui, à l’état homozygote, est associé à un risque augmenté de neutropénie induite par l’irinotécan. En pratique clinique quotidienne, deux grandes stratégies de gestion et de prévention du risque de neutropénie sévère chimio-induite sont mises en œuvre. L’une repose sur des adaptations de doses initiales ou secondaires des médicaments prescrits avec le risque de perdre en dose-intensité, sachant que la relation doses-intensité et efficacité des schémas de chimiothérapies cytotoxiques prescrits en cancérologie digestive n’est pas établie. L’autre stratégie est le recours en prophylaxie primaire ou secondaire à un Granulocyte-Colony Stimulating Factor (G-CSF) dont le bénéfice est démontré en termes de diminution du risque de neutropénie fébrile chimio-induite. Dans tous les cas, la gestion du risque de neutropénie imputable à la prescription d’une chimiothérapie nécessite une bonne connaissance des profils de tolérance des médicaments prescrits et des facteurs de risque liés au patient comme prérequis indispensable à la mise en œuvre de l’une ou l’autre voire des deux stratégies de gestion et prévention de ce risque. Il faut signaler que peu de données spécifiques à la cancérologie digestive ont été rapportées dans le cadre de la gestion de la neutropénie chimio-induite.
Définition de la neutropénie chimio-induite
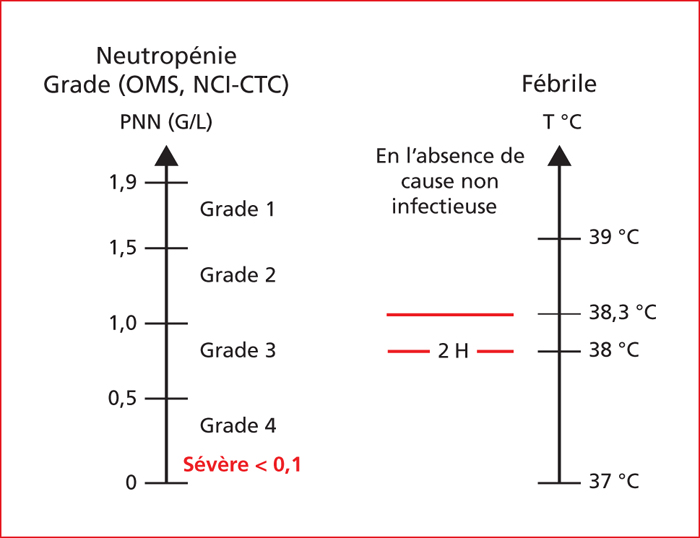
Les critères de définition de la neutropénie chimio-induite fébrile ou non sont représentés sur la figure 1. Elle est définie au moyen des critères de la classification NCI CTCAE (Common Terminology Criteria for Adverse Events) d’évaluation des toxicités de la chimiothérapie qui est régulièrement actualisée [1]. La neutropénie fébrile est définie par une température orale supérieure à 38,3 ̊C lors d’une prise ou par une température supérieure à 38,0 ̊C mesurée à deux reprises pendant un espace de temps de deux heures et un nombre absolu de polynucléaires neutrophiles inférieur à 500/mm3 mesuré ou attendu [2]. Sa gravité est conditionnée par les risques d’infection sévère qu’elle génère qui parfois peut être létale. Dans ce contexte, outre la nature du germe responsable de l’infection à laquelle est associée un risque de mortalité variable (18 % en cas de germe Gram-négatif et 5 % en cas de germe Gram-positif), les principaux facteurs de risque de sévérité d’une infection sont une mucite ou une hémorragie associée, un dispositif médical, un traitement antibiotique récent et un traitement immunosuppresseur associé [3]. L’index pronostique de MASCC (Multinational Association of Supportive Care in Cancer) permet d’évaluer le risque de mortalité par neutropénie fébrile chimio-induite et de discuter d’une éventuelle prise en charge ambulatoire (tableau 1)[4].
La survenue d’une neutropénie fébrile est une urgence médicale pour laquelle une antibiothérapie probabiliste adaptée est indiquée sans délai. Une antibiothérapie précoce, probabiliste et adaptée est associée à une diminution de la mortalité de cette complication qui est passée de 65 % à 5 %. Une bactériémie est documentée dans environ 20 % des cas de neutropénie fébrile à partir de laquelle une adaptation de l’antibiothérapie sera nécessaire.
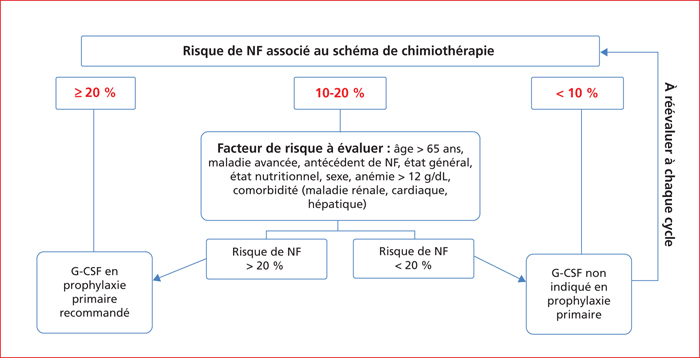
Le risque et le pronostic d’une neutropénie fébrile sont corrélés à l’intensité et à la durée de la neutropénie. La sévérité de la neutropénie associée à l’incidence de la neutropénie fébrile est liée à l’intensité de la chimiothérapie. Les schémas de chimiothérapie sont classés en trois groupes en fonction du risque de neutropénie fébrile auquel ils sont associés : le groupe à faible risque est défini par un risque de neutropénie fébrile inférieur à 10 %, le groupe à risque intermédiaire est défini par un risque compris entre 10 et 20 %, le groupe à risque élevé est défini par un risque supérieur à 20 % [5]. La neutropénie fébrile est une urgence médicale pour laquelle une antibiothérapie probabiliste adaptée est indiquée sans délai
L’incidence des neutropénies sévères chimio-induites en cancérologie digestive
Les prévalences des neutropénies sévères de grade 3/4 ou fébriles varient selon les schémas prescrits. La liste des principaux schémas prescrits en cancérologie digestive associés à leur risque respectif de neutropénie de grade 3/4 et fébrile est rapportée dans le tableau 2.
En cas de prescription d’un schéma du type LV5FU2 ou de capécitabine à visée adjuvante dans le cancer colorectal, les prévalences des neutropénies de grade 3/4 et de neutropénies fébriles sont respectivement de 5 % et inférieur à 1 % [6, 7]. Pour les schémas du type FOLFOX ou FOLFIRI, les prévalences sont respectivement de 20 à 50 % et de 1 à 7 % [8]. Pour les schémas de trithérapie de type FOLFIRINOX et FOLFOXIRI, les prévalences sont respectivement de 30 à 50 % et de 3 à 9 % [9, 10]. Les schémas de chimiothérapies utilisés en cancérologie digestive sont associés à un risque de neutropénie de grade 3/4 de 5 à 50 % et de neutropénie fébrile de 1 à 9 %
Les neutropénies fébriles surviennent dans 80% des cas à l’issue de la première cure. Par ailleurs, dans ces études, 75 % des patients traités avaient des profils étiquetés à faible risque de neutropénie sévère. L’ajout des thérapies ciblées (cétuximab, bévacizumab, panitumumab et aflibercept) à ces différents schémas dans le traitement du cancer colorectal n’augmente pas ou peu le risque de neutropénie sévère. Parmi les autres schémas prescrits, le schéma DCF indiqué dans le cancer de l’estomac métastatique et le schéma VP16-sel de platine indiqué dans les carcinomes neuroendocrines indifférenciés sont ceux associés aux plus fortes incidences de neutropénies sévères. Les neutropénies fébriles surviennent dans 80 % des cas à l’issue de la première cure
Les facteurs de risque clinico-biologiques de neutropénie sévère chimio-induite
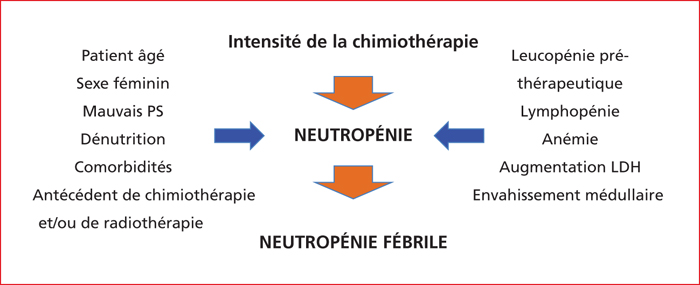
En plus de la composition et de la dose-intensité du schéma prescrit, des facteurs clinico-biologiques augmentent le risque de survenue d’une toxicité chimio-induite sévère et en particulier hématologique. Les principaux facteurs cliniques identifiés sont un âge avancé, un état général altéré, le sexe féminin, un état de dénutrition, un syndrome de masse tumorale important, des comorbidités et un antécédent de neutropénie sévère. Une lymphopénie, une cholestase, des LDH élevées, une hypo-albuminémie et une diminution du débit de filtration glomérulaire sont des facteurs biologiques de risque de neutropénie sévère [11, 12]. Les facteurs cités ne sont pas spécifiques des cancers digestifs bien qu’ils soient fréquemment observés dans ces cancers, en particulier à un stade avancé. Les principaux facteurs de risque de neutropénie chimio-induite sont résumés dans la figure 2. Le risque de neutropénie sévère dépend du type et de la dose-intensité de la chimiothérapie, mais aussi de paramètres cliniques et biologiques
Les facteurs pharmacogénétiques associés au risque de neutropénie
Des facteurs génétiques affectant le métabolisme des médicaments expliquent en partie la variabilité inter-individuelle de leur profil de tolérance. C’est le cas de polymorphismes génétiques des gènes codant la DPD et l’UGT1A1 qui sont respectivement des enzymes impliquées dans le métabolisme des fluoropyrimidines et de l’irinotécan.
DYPD et 5-FU
Le 5-FU est métabolisé à plus de 80 % par la DPD qui intervient dans la première étape du catabolisme des bases pyrimidiques [13]. L’activité de la DPD varie d’un facteur compris entre 8 et 21 dans la population [14]. Une faible activité de la DPD est associée à une diminution du catabolisme du 5-FU avec pour corollaire une augmentation de ses métabolites actifs et un risque de toxicité sévère au 5-FU en particulier hématologique qui peut être létale [15]. Une diminution d’activité de la DPD est rapportée dans 40 à 60 % des cas de toxicité sévère au 5-FU. Les sujets présentant une diminution de l’activité de la DPD ont un risque accru de toxicité de grade 4 ou létale au 5-FU au minimum multiplié par 4. Parmi les nombreux polymorphismes du gène DPYD qui code la DPD, une minorité est associée à un déficit en DPD pouvant expliquer la survenue de toxicités précoces sévères sous fluoropyrimidines [16-18]. Dans la population occidentale, la fréquence de l’ensemble de ces polymorphismes associée à une diminution de l’activité de la DPD est d’environ 3 % à l’état hétérozygote et de 0,1 % à l’état homozygote. Peu d’études ont rapporté l’intérêt potentiel de la recherche d’un déficit en DPD avant la prescription de 5-FU [19]. En 2018, l’INCa (Institut National du Cancer) et la HAS (Haute Autorité de Santé) ont recommandé la recherche du déficit en DPD par la mesure de l’uracilémie avant tout traitement par fluoropyrimidines [20]. Une faible activité de la dihydropyrimidine déhydrogénase est associée à un risque de toxicité sévère au 5-FU en particulier hématologique
UGT1A1 et irinotécan
L’activité inter-individuelle de l’UGT1A1 est très variable et cette variabilité est en grande partie expliquée par des polymorphismes génétiques fonctionnels du gène qui code cette enzyme. La glucuroconjugaison hépatique du SN-38, métabolite actif de l’irinotécan, peut varier d’un facteur 18 entre les individus [21, 22]. Il existe au niveau du gène de l’UGT1A1 une répétition d’un di-nucléotide (TA) qui influence l’activité transcriptionnelle du promoteur (l’allèle sauvage ou UGT1A1*1 correspondant à six répétitions). L’allèle variant UGT1A1*28 comprenant sept répétitions du di-nucléotide TA est associé à un niveau de transcription plus faible du gène. Le génotype homozygote UGT1A1*28/UGT1A1*28 permet un diagnostic moléculaire de la maladie de Gilbert. Dans la population caucasienne, la fréquence de l’allèle UGT1A1*28 est de 40 % dont 10 à 15 % d’homozygotes [23]. L’allèle UGT1A1*28 est associé à une diminution de l’activité de glucuroconjugaison de l’UGT1A1 dont la conséquence est une capacité plus faible de glucuroconjugaison du composé SN-38 chez les sujets homozygotes et hétérozygotes comparée à celle des sujets homozygotes pour l’allèle sauvage [22]. Plusieurs études concordantes ayant inclus des patients traités par irinotécan ont montré un lien significatif entre l’allèle UGT1A1*28 et la survenue d’une neutropénie sévère [24, 25]. Les patients homozygotes pour l’allèle UGT1A1*28 ont un risque dix fois plus important de développer une neutropénie de grade 4 comparé aux patients ayant un autre génotype [25]. Le réseau national de pharmacogénétique a proposé des recommandations de prescription de l’irinotécan en fonction du polymorphisme UGT1A1*28[26]. Pour une dose d’irinotécan supérieure à 180 mg/m2 toutes les deux semaines d’intervalle, il est recommandé de diminuer les doses d’irinotécan de 25-30 % en cas de génotype homozygote pour l’allèle UGT1A1*28. Les doses peuvent être modifiées ultérieurement en fonction de la tolérance. Une autre stratégie est le recours à une prophylaxie primaire par G-CSF en cas de prescription d’irinotécan chez les patients homozygotes pour l’allèle UGT1A1*28. Les patients homozygotes pour l’allèle UGT1A1*28 ont un risque multiplié par dix de développer une neutropénie de grade 4
Stratégies de prévention de la neutropénie sévère
Deux stratégies de prévention du risque de neutropénie sévère sont possibles. La première est celle qui consiste à adapter les doses des médicaments à l’initiation du traitement en fonction des facteurs de risque de neutropénie et/ou secondairement en cas de neutropénie chimio-induite. La seconde repose sur la prescription de G-CSF en prophylaxie primaire ou secondaire (figure 3). Les deux stratégies sont parfois mises en œuvre de façon synchrone ou séquentielle.
La première stratégie d’adaptation des doses en cas de toxicité hématologique consiste à diminuer les doses-intensités de la chimiothérapie. Elle est la plus couramment adoptée en pratique dans la mesure où c’est elle qui a été adoptée dans la plupart des essais thérapeutiques de chimiothérapie, notamment, dans le cancer colorectal. Les protocoles de reports de cures et d’adaptation des doses varient selon les schémas de chimiothérapie. En l’absence de neutropénie fébrile sans facteur de risque de sévérité, un report de 7 à 15 jours est généralement préconisé à l’issue d’un premier épisode de neutropénie. En cas de récidive, une diminution des doses de chimiothérapie est proposée et, en cas d’association de plusieurs molécules, cela concerne en premier lieu le médicament le plus neutropéniant. En fonction des facteurs de risque associés et des objectifs du traitement, le recours à une prescription de G-CSF en prophylaxie secondaire sera discuté. Par exemple, chez un sujet jeune traité par FOLFIRINOX pour des métastases hépatiques synchrones d’un cancer du rectum potentiellement résécables, un maintien de l’intensité de dose du schéma FOLFIRINOX sera privilégié au moyen d’une prescription de G-CSF en prophylaxie secondaire (à l’issue d’un report de sept jours pour neutropénie de grade 3 après la première cure par exemple). Inversement chez un patient âgé multi-métastatique traité de façon palliative pour lequel les objectifs thérapeutiques incluent la préservation de la qualité de vie, il faudra plutôt privilégier des reports et des adaptations de doses de chimiothérapie. Chez un patient multimétastatique traité de façon palliative avec un objectif de préservation de la qualité de vie, on privilégiera plutôt des reports et des adaptations de doses de chimiothérapie
La prescription d’une forme rapide de G-CSF (filgrastim ou lenograstim) débute 1 à 2 jours après l’administration de la chimiothérapie et doit être poursuivie jusqu’à ce que le nadir du nombre de neutrophiles soit dépassé, soit en pratique pendant une durée de 5 à 10 jours selon le schéma de chimiothérapie [5, 27, 28]. Ce schéma d’administration évalué dans le cadre de schémas administrés toutes les 3 semaines peut être modifié et fractionné en cas de chimiothérapie administrée toutes les unes à deux semaines. L’administration unique de la forme retard peg-filgrastim couvre 12 jours. La prescription d’une forme rapide de G-CSF débute un à deux jours après l’administration de la chimiothérapie et doit être poursuivie pendant une durée de 5 à 10 jours
Peu de données spécifiques sont disponibles sur le recours aux G-CSF en prophylaxie primaire ou secondaire dans le traitement des cancers digestifs. Dans le traitement du cancer colorectal, le taux de recours au G-CSF en prophylaxie primaire concerne moins de 2 % des patients et en prophylaxie secondaire entre 10 et 20 % des patients [29, 30]. Une étude randomisée chez des patients traités par FOLFOX + bévacizumab ou FOLFIRI + bévacizumab pour un cancer colorectal a comparé un GCSF en prophylaxie primaire à un placebo et le résultat de cette étude est une diminution significative du taux de neutropénie fébrile en faveur du G-CSF (5,7 % versus 2,4 %) [31].
En France, la prescription de G-CSF associée aux chimiothérapies prescrites dans le cancer colorectal a été évaluée à partir des bases de données en santé à environ 5 % de l’ensemble des prescriptions de G-CSF [32].
Conclusion
Le risque de neutropénie sévère chimio-induite est très variable selon le schéma de chimiothérapie prescrit et le profil des patients. Une bonne connaissance de ces risques est un prérequis indispensable à la gestion de la neutropénie fondée sur le recours à des adaptations de doses et/ou au GCSF en prophylaxie. La recherche d’un déficit en DPD avant toute prescription de 5-FU contribue à l’amélioration de la gestion et de la prévention de ce risque.Take home messages
Liens d’intérêts
les auteurs déclarent n’avoir aucun lien d’intérêt en rapport avec l’article.
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International