Hépato-Gastro & Oncologie Digestive
MENUAvancées dans le traitement médical du cancer du pancréas Volume 26, numéro 8, Octobre 2019
Introduction
La très grande majorité des tumeurs malignes du pancréas sont des adénocarcinomes (90 %) [1]. L’adénocarcinome du pancréas (AP) est la tumeur digestive dont le pronostic est le plus défavorable, avec un taux de survie globale (SG) à 5 ans de 7 %-8 %, tous stades confondus [2]. La résection complète (marges R0) suivie d’une chimiothérapie adjuvante est le seul traitement permettant une survie prolongée (SG médiane > 2 ans) [1, 3]. Cependant, en raison de l’absence de symptôme spécifique au stade localisé et d’un fort potentiel invasif, associés au manque de biomarqueurs diagnostiques précoces et de méthodes efficaces de dépistage, seuls une minorité de patients peuvent accéder à la chirurgie et le diagnostic est le plus souvent réalisé à un stade non résécable, localement avancé (30 %) ou métastatique (50 %) [1, 3]. Pendant deux décennies, la gemcitabine a occupé la place d’unique standard thérapeutique du traitement médical de l’AP avancé [1, 3]. Depuis 2010, des avancées significatives ont été obtenues avec des associations plus efficaces de chimiothérapies, FOLFIRINOX (5-FU, acide folinique, irinotécan et oxaliplatine ; standard actuel en première ligne chez les patients ayant un performance status [PS] 0-1 et une bilirubine normale) et gemcitabine plus nab-paclitaxel (dont l’accès en pratique en France est limité par l’absence de remboursement du nab-paclitaxel) [1, 3]. En dépit de ces progrès, notre arsenal thérapeutique pour l’AP reste limité. Ces dernières années, la compréhension des mécanismes moléculaires et cellulaires de la carcinogenèse pancréatique s’est améliorée (en particulier, le rôle du microenvironnement tumoral) et de nouvelles approches et stratégies thérapeutiques ont émergé (développement des traitements pré-opératoires et de maintenance, essais cliniques avec les inhibiteurs de poly (ADP-ribose) polymérase [PARP], et premiers résultats de l’immunothérapie). Le chapitre du Thésaurus National de Cancérologie Digestive (TNCD) a été récemment réactualisé en 2018 pour tenir compte de ces avancées. Cette revue fait l’état de l’évolution des pratiques dans le traitement médical de l’AP.
L’épidémiologie : de plus en plus de nouveaux cas
L’AP est un problème de santé publique : il se positionne à ce jour au second rang des cancers digestifs en termes d’incidence après le cancer du côlon ; il est aussi la quatrième cause de décès par cancer dans les pays occidentaux [2]. Selon les projections les plus récentes, il deviendra la deuxième cause de décès par cancer aux États-Unis et en Europe au cours de la décennie 2020-2030, derrière le cancer du poumon [4]. En France, plus de 14 000 nouveaux cas ont été diagnostiqués en 2017 [5]. L’augmentation d’incidence de l’AP est plus marquée dans notre pays que dans les autres pays occidentaux : elle a doublé chez les hommes et triplé chez les femmes entre 1982 et 2012, avec un pourcentage de variation annuelle de respectivement +2,30 % et +3,60 %, sans explication épidémiologique claire [6]. Devant ces chiffres inquiétants, le cancer du pancréas a été reconnu comme une priorité par l’Institut National du Cancer (INCa) avec la promotion d’un PAIR (Programme d’Actions Intégrées de Recherche) consacré à ce cancer en 2017. L’augmentation d’incidence de l’adénocarcinome pancréatique est plus marquée dans notre pays que dans les autres pays occidentaux : elle a doublé chez les hommes et triplé chez les femmes entre 1982 et 2012
Le tabagisme est le principal facteur de risque environnemental d’AP et il augmente avec la durée d’exposition (risque relatif [RR] : 2-3) ; ce risque persiste même plusieurs années après l’arrêt et existe aussi pour le tabagisme passif [7]. Les autres facteurs de risque bien établis sont :
- –l’âge : l’âge médian au diagnostic d’AP est de 70 ans. L’augmentation actuellement observée du nombre absolu de nouveaux cas d’AP pourrait être expliquée en partie par le vieillissement de la classe des « baby boomers », atteignant l’âge à risque de développer un AP [7] ;
- –le diabète ancien : un diabète de type 2 évoluant depuis plusieurs années est associé à un risque augmenté (odds ratio [OR] : 1,90) [8]. Un diabète de découverte récente (deux-trois ans avant le diagnostic d’AP) est quant à lui considéré comme une manifestation paranéoplasique, liée à une dysfonction des cellules β et à une insulinorésistance induites par la tumeur [1] ;
- –l’obésité et le surpoids : l’épidémie d’obésité (640 millions d’adultes et 110 millions d’enfants et d’adolescents obèses en 2013), en particulier à l’adolescence [9], et le syndrome métabolique sont associés à la survenue de nombreux cancers dont l’AP [7] ;
- –la génétique : les cancers pancréatiques familiaux (CaPaFa, défini par la présence d’au moins deux cas confirmés d’AP chez des apparentés au premier degré [10]), représentent environ 10 % des AP. Le risque de développer un AP augmente avec le nombre d’apparentés atteints (RR de 2 à 32 selon qu’il y a respectivement un à trois cas atteints dans la famille) [1]. Une anomalie génétique n’est identifiée que dans environ 20 % des cas de CaPaFa ; les principales altérations génétiques décrites sont des mutations dans les gènes ATM, BRCA1/2, PALB2 et CDKN2A [1] ;
- –la pancréatite chronique : l’inflammation chronique observée dans la pancréatite chronique est un facteur promoteur de la carcinogenèse pancréatique (RR : 2-6) [11]. La pancréatite peut aussi être la conséquence d’une sténose tumorale des canaux pancréatiques, et une cause tumorale obstructive doit être systématiquement cherchée sur l’imagerie dans le bilan étiologique d’une pancréatite chronique ou d’une pancréatite aiguë non alcoolique non biliaire.
Les facteurs protecteurs connus sont l’atopie, le traitement par la metformine chez les patients diabétiques, et le groupe sanguin O [7]. D’autres facteurs sont encore débattus ; ainsi, le rôle délétère direct des multiples variants génétiques émergeant à la faveur du séquençage haut débit, de la consommation excessive d’alcool, du régime alimentaire et des toxiques environnementaux, de l’ethnie (africaine), de l’infection par Helicobacter pylori et de l’antécédent de gastrectomie restent à préciser. Il en est de même de l’effet protecteur de l’aspirine et de l’activité physique [7].
Au total, les facteurs de risque d’AP connus ne permettent pas d’expliquer complètement l’évolution épidémiologique préoccupante observée en France et dans le monde. Leur connaissance et l’identification de nouveaux facteurs de risque pourraient permettre d’ouvrir la voie à des stratégies de prévention et de définir une éventuelle population cible pour un dépistage. De larges cohortes à l’échelle nationale (E3N) et internationale/européenne (EPIC, PanGen-EU et Pan-C4) sont en cours pour préciser ces facteurs de risque constitutionnels et environnementaux.
Cancers du pancréas opérables/résécables : traitement adjuvant et premiers résultats des stratégies pré-opératoires
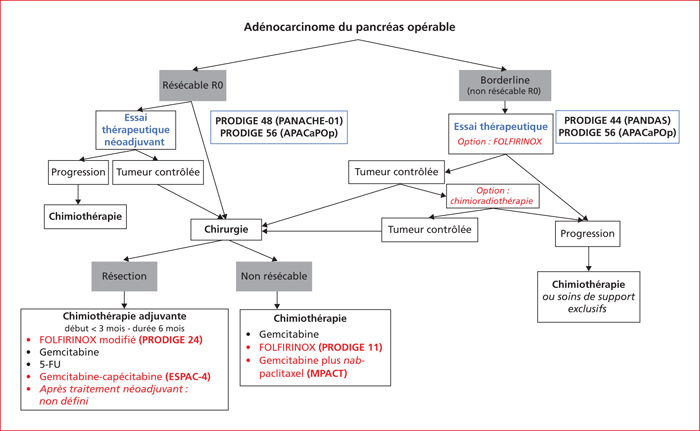
Seuls 15 % à 20 % des patients sont candidats à une résection chirurgicale. L’objectif de la chirurgie est de réaliser une résection en limites saines (marges R0) pour espérer qu’elle soit à visée curative [3]. La classification des tumeurs en fonction de leur caractère résécable d’emblée, borderline, localement avancé ou métastatique (classification du National Comprehensive Cancer Network, NCCN) est plus utile en pratique que la classification TNM actualisée en 2017 (tableau 1)[3]. Comme souligné dans la version 2018 du TNCD, il est indispensable afin de sélectionner au mieux les patients pour la chirurgie, de disposer d’un bilan récent d’imagerie (moins de quatre semaines) car l’évolution des AP peut être rapide et un délai plus long augmente le risque (> 20 %) de découverte per-opératoire de métastases [3]. Un bilan d’imagerie de plus de quatre semaines augmente le risque (> 20 %) de découverte per-opératoire de métastases
Le scanner thoraco-abdomino-pelvien doit être réalisé selon un protocole tri-phasique (sans injection, temps artériel tardif et temps veineux portal), en coupes fines (épaisseur ≤ 0,5-1 mm), et la standardisation du compte-rendu est recommandée [3, 12]. Le TNCD 2018 a introduit dans le bilan d’évaluation l’IRM hépatique avec séquences de diffusion en complément du scanner thoraco-abdomino-pelvien pour les tumeurs résécables, afin d’éliminer des métastases hépatiques de petite taille méconnues par le scanner (12 % des patients), sans retarder le geste chirurgical [3, 13]. De plus, la détermination précise de l’atteinte vasculaire en imagerie (base de la classification NCCN) peut être difficile, notamment pour distinguer une infiltration tumorale d’une zone de fibrose ou inflammatoire. L’imagerie doit donc être analysée rigoureusement en réunion de concertation pluridisciplinaire (RCP) en présence de radiologues, chirurgiens et oncologues/gastroentérologues expérimentés en maladie bilio-pancréatique [3]. Il est également rappelé dans le TNCD 2018 que la preuve cyto/histologique de malignité n’est pas systématique ni nécessaire avant la résection chirurgicale pour une maladie résécable d’emblée, et qu’une biopsie non informative ne doit pas retarder la résection chirurgicale en cas de forte suspicion clinique de cancer pancréatique [3]. Elle est en revanche indiquée en cas de doute avec une lésion bénigne (principalement, pancréatite auto-immune) ou si un traitement pré-opératoire est envisagé (dans le cadre d’essais cliniques ou en cas de tumeur borderline). Il faut faire une IRM hépatique avec séquences de diffusion en complément du scanner thoraco-abdomino-pelvien pour les tumeurs résécables, afin d’éliminer des métastases hépatiques de petite taille méconnues par le scanner (12 % des patients)
La définition des tumeurs borderline est anatomique et radiologique et fait référence à la résécabilité « technique » basée sur l’étendue de l’atteinte vasculaire (classification NCCN). Ces tumeurs présentent un risque élevé de marges chirurgicales positives (R1) et de récidive. Outre ces critères anatomiques, le concept d’AP borderline « biologique » basé sur des caractéristiques pathologiques ou moléculaires de la tumeur (CA19-9 élevé, syndrome inflammatoire, faible différentiation tumorale) et « clinique » (état général et nutritionnel, comorbidités du patient conditionnant son opérabilité) a été proposé mais nécessite une validation clinique plus poussée [14].
La majorité des patients opérés avec une intention curative pour une tumeur présumée résécable, ont en fait déjà une maladie micro-métastatique et développent des récidives locales ou à distance (environ 80 % dans les trois ans suivant la chirurgie), justifiant l’indication d’un traitement adjuvant chez tous les patients pouvant la recevoir, quel que soit le stade pTNM [3]. La monothérapie par gemcitabine pour six mois a été depuis 2007 le standard sur la base des études de phase III CONKO-001 [15] (gemcitabine supérieure à observation) et ESPAC-3 [16] (gemcitabine aussi efficace que le 5-FU bolus, mais moins toxique). L’ajout de thérapies ciblées (erlotinib, sorafénib) à la gemcitabine s’est révélé inefficace [1]. En 2017, l’étude de phase III ESPAC-4 a rapporté une augmentation de la SG médiane à 28 mois avec l’association gemcitabine plus capécitabine contre 25,5 mois avec la gemcitabine seule (hazard ratio [HR] : 0,82, p = 0,032) [17]. Cependant, cette étude a fait l’objet de critiques méthodologiques (en particulier, l’absence de scanner post-opératoire à l’inclusion) et n’a pas montré de bénéfice significatif sur la survie sans maladie (SSM) [3]. De ce fait, elle n’a pas été suivie d’un changement consensuel de pratique en France. En 2018, les résultats de l’étude de phase III PRODIGE 24 ont montré la supériorité la chimiothérapie par FOLFIRINOX modifié (5-FU 2 400 mg/m2 sans bolus, acide folinique 400 mg/m2, irinotécan 150 mg/m2 et oxaliplatine 85 mg/m2) pendant 6 mois (12 cycles) par rapport à la gemcitabine, sur la SSM (médiane : 21,6 mois contre12,8 mois, HR : 0,58, p < 0,0001) et la SG (médiane : 54,4 mois contre35 mois, HR : 0,64, p = 0,003) chez les patients PS 0-1 [18]. En revanche, l’étude de phase III APACT, présentée au congrès de l’ASCO 2019, qui a comparé l’association gemcitabine plus nab-paclitaxel à la gemcitabine en situation adjuvante, était négative pour son objectif principal (SSM en relecture centralisée) [19]. Sur la base des résultats de l’ensemble de ces études, le FOLFIRINOX modifié est la référence en situation adjuvante chez les patients PS 0-1 et en cas de non-éligibilité, une chimiothérapie par gemcitabine, 5-FU ou gemcitabine plus capécitabine, est à discuter au cas par cas (figure 1). Quelle que soit la chimiothérapie choisie, il est important de la réaliser en totalité (six mois) même si son initiation est retardée (mais avec un délai ne devant pas dépasser trois mois après la chirurgie) [3]. Le FOLFIRINOX modifié est la référence en situation adjuvante chez les patients PS 0-1 et en cas de non-éligibilité, une chimiothérapie par gemcitabine, 5-FU ou gemcitabine plus capécitabine, est à discuter au cas par cas
Environ 30 % des patients opérés d’un AP, même ceux ayant reçu une chimiothérapie adjuvante, développent une rechute précoce et décèdent dans l’année qui suit la chirurgie [3]. Cette évolution défavorable est principalement observée chez les patients atteints de tumeurs R1 ou N+ [20]. Ce constat a conduit à l’exploration de stratégies de traitement néoadjuvant (i.e. l’administration de chimiothérapie, seule ou suivie de chimioradiothérapie [CRT], avant la chirurgie). Son rationnel est de :
- –se donner un temps d’observation (4-6 mois) pour identifier les patients atteints d’une tumeur agressive, à l’évolution métastatique précoce, qui ne sont pas de bons candidats à la chirurgie ;
- –induire une réponse tumorale et ainsi augmenter les chances de résection R0 ;
- –traiter précocement une éventuelle maladie micrométastatique ;
- –tester la chimiosensibilité de la tumeur, ainsi que la tolérance du patient au traitement comme éléments de sélection pour la chirurgie [3].
La situation « néoadjuvante » des AP résécables d’emblée est à distinguer de celle des patients ayant une tumeur borderline ou localement avancée, dont seulement respectivement 60 % et 30 % pourront être secondairement opérés, et chez lesquels on doit utiliser le terme « d’induction » pour qualifier le traitement pré-opératoire. La situation « néoadjuvante » des tumeurs résécables d’emblée est à distinguer de celle des patients ayant une tumeur borderline ou localement avancée, dont seulement respectivement 60 % et 30 % pourront être secondairement opérés, et chez lesquels on doit utiliser le terme « d’induction » pour qualifier le traitement pré-opératoire
Les méta-analyses du début des années 2010, rassemblant des études très hétérogènes (patients avec AP résécables, borderline et localement avancé ; multiples protocoles de radiothérapie et chimiothérapie) et de petits effectifs et ne prenant pas en compte les associations FOLFIRINOX et gemcitabine plus nab-paclitaxel ultérieures à leur publication, ont été critiquées pour leur méthodologie [3]. Des méta-analyses plus récentes, consacrées aux patients ayant un AP résécable ou borderline[21] ou exclusivement borderline[22] ont suggéré une amélioration de la SG et des taux de résection R0 et N0 plus élevés chez les patients recevant un traitement pré-opératoire versus une chirurgie d’emblée. L’étude de phase III PREOPANC, présentée à l’ASCO 2018, a confirmé la faisabilité de cette stratégie et fourni une première évaluation prospective de son efficacité : 246 patients avec un AP résécable ou borderline ont été randomisés entre une CRT pré-opératoire à base de gemcitabine (36 Gy en 15 fractions avec gemcitabine concomitante, encadrée par deux cycles de gemcitabine) et une chimiothérapie adjuvante par gemcitabine pour quatre cycles, ou une chirurgie d’emblée et une chimiothérapie adjuvante par gemcitabine pour six cycles [23]. La SG médiane était de 17,1 mois avec la CRT préopératoire contre 13,7 mois (différence non significative) avec la chirurgie première. La SSM était plus longue avec le traitement pré-opératoire (9,9 mois contre 7,9 mois, p = 0,023). Parmi les patients opérés (72 % dans le groupe chirurgie immédiate et 62 % dans le groupe CRT), le taux de résection R0 était plus élevé chez ceux ayant reçu un traitement pré-opératoire (63 % contre 31 %). Chez ces patients réséqués R0, la différence de SG médiane était plus marquée : 42,1 mois dans le groupe avec CRT pré-opératoire contre 16,8 mois dans le groupe avec chirurgie d’emblée (p < 0,001). Des études sont en cours évaluant des stratégies pré-opératoires s’appuyant sur une chimiothérapie par FOLFIRINOX ou gemcitabine plus nab-paclitaxel. Ces stratégies néodjuvantes et d’induction ne sont pas dénuées de toxicités et elles doivent être réalisées dans le cadre de centres experts (tumeurs borderline) ou d’essais cliniques [3]. En France, l’étude de phase II randomisée PRODIGE 48 PANACHE 01 évalue chez les patients ayant une tumeur résécable d’emblée une chimiothérapie néoadjuvante par FOLFIRINOX ou FOLFOX versus chirurgie d’emblée, et l’étude de phase II randomisée PRODIGE 44 PANDAS pose la question de la CRT avec capécitabine après une chimiothérapie d’induction par FOLFIRINOX modifié chez des patients ayant une tumeur borderline.
Cancers du pancréas avancés : deuxième ligne, traitement d’entretien/maintenance et séquentiel
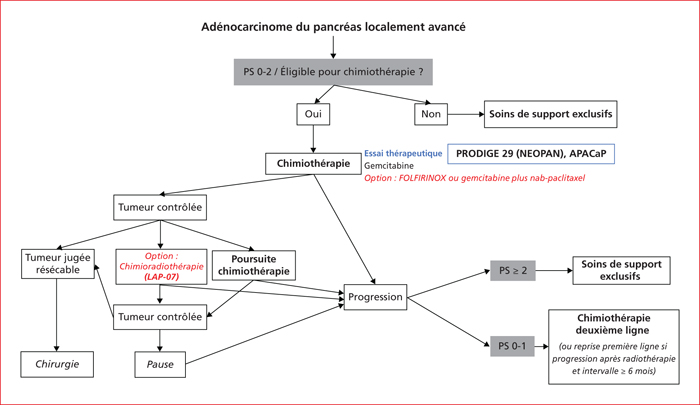
Concernant le traitement des AP localement avancés, le TNCD 2018 a intégré les résultats de l’étude LAP-07 publiés en 2016, qui n’avait pas montré de supériorité en terme de SG avec la CRT (54 Gy plus capécitabine) par rapport à la poursuite de la chimiothérapie initiale (gemcitabine ou gemcitabine plus erlotinib), mais dont une analyse secondaire indiquait que l’administration de la CRT était associée à un meilleur contrôle local et à un délai plus long avant reprise d’un traitement [24]. Sur la base de ces résultats, la CRT avec capécitabine de « clôture » est une option à discuter en RCP chez des patients sélectionnés (figure 2)[3]. La gemcitabine reste la chimiothérapie de référence dans les AP localement avancés, sur la base des études menées dans les AP « avancés », regroupant des patients atteints de tumeurs métastatiques et localement avancées [3]. L’ajout de l’erlotinib à la gemcitabine ne s’est pas avéré supérieur à la gemcitabine seule dans l’étude LAP-07 [24]. Au vu des données d’efficacité des associations FOLFIRINOX et gemcitabine plus nab-paclitaxel en situation métastatique et par extrapolation, elles ont été testées chez des patients atteints d’un AP localement avancé avec des résultats intéressants [3, 25]. Néanmoins, on ne dispose pas d’une validation prospective en comparaison avec la gemcitabine : l’étude LAPACT qui a évalué l’association gemcitabine plus nab-paclitaxel était une phase II monobras et les inclusions dans l’étude de phase III PRODIGE 29 NEOPAN évaluant le FOLFIRINOX sont en cours [3]. La chimioradiothérapie avec capécitabine de « clôture » est une option à discuter en réunion de concertation pluridisciplinaire chez des patients sélectionnés
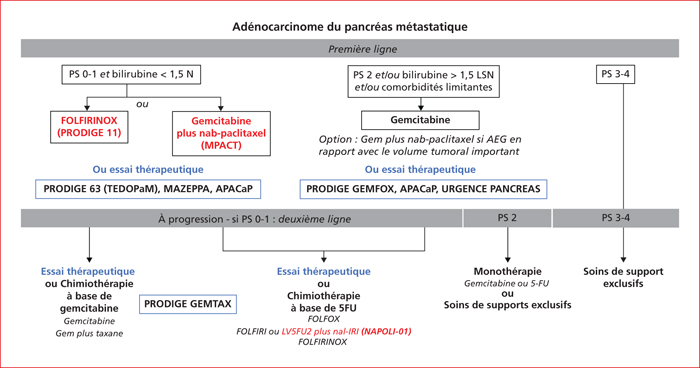
Comme mentionné précédemment, les associations de chimiothérapie FOLFIRINOX (étude PRODIGE 11, publiée en 2011 [26]) et gemcitabine plus nab-paclitaxel (étude MPACT, en 2013 [27]) ont été introduites comme nouveaux standards thérapeutiques de première ligne métastsatique dans le TNCD 2018 pour les patients ayant un PS 0-1 et une bilirubine normale [3]. La gemcitabine en monothérapie reste indiquée chez les patients PS 2, ayant une bilirubine augmentée et/ou des comorbidités limitantes, et les patients PS 3-4 relèvent de soins de support exclusifs (figure 3)[3]. L’étude de phase III PRODIGE GEMFOX ouvrira prochainement : elle comparera le FOLFOX à la gemcitabine en première ligne chez les patients ayant un AP métastatique et non éligibles au FOLFIRINOX.
Les données concernant la chimiothérapie de deuxième ligne dans les AP métastatiques restent limitées. Après progression sous gemcitabine, les associations de 5-FU avec un platine ou l’irinotécan ont été principalement étudiées [3]. L’association du nal-IRI (irinotécan nanoliposomal), avec le 5-FU et l’acide folinique a montré une amélioration de la SG (médiane : 6,1 contre 4,2 mois, p = 0,012) par rapport au 5-FU/acide folinique seul dans l’étude de phase III NAPOLI-01 [28]. Les données concernant l’association 5-FU et oxaliplatine sont plus controversées, deux études de phase III (CONKO-003 [29], positive et PANCREOX [30], négative) ayant montré des résultats opposés. Il n’existe pas de résultat d’étude prospective évaluant un traitement de deuxième ligne après progression sous FOLFIRINOX ou gemcitabine plus nab-paclitaxel [3]. L’étude de phase III PRODIGE GEMPAX, en cours d’ouverture, évalue l’association gemcitabine plus paclitaxel versus gemcitabine seule en deuxième ligne de traitement après échec d’une première ligne par FOLFIRINOX.
Après une période de contrôle tumoral sous FOLFIRINOX, la place des stratégies de traitement d’entretien, i.e. l’allègement de la chimiothérapie par arrêt de l’oxaliplatine ± de l’irinotécan par analogie à la stratégie OPTIMOX dans le cancer colorectal, ou de maintenance, i.e. l’introduction d’une nouvelle molécule en relai, reste à préciser. L’étude de phase II randomisée PRODIGE 35 PANOPTIMOX présentés à l’ASCO 2018 a évalué trois modalités de séquence thérapeutique de première ligne : (i) FOLFIRINOX pour 6 mois (schéma de référence de l’étude PRODIGE 11), (ii) chimiothérapie d’induction par FOLFIRINOX pour 4 mois suivi d’un traitement d’entretien par 5-FU et acide folinique (LV5FU2) et réintroduction du FOLFIRINOX à progression, ou (iii) traitement séquentiel FIRGEM alternant gemcitabine et FOLFIRI-3, qui avait donné des résultats préliminaires encourageants dans une étude de phase II [31]. Le taux de survie sans progression (SSP) à 6 mois, objectif principal de l’étude, était de 47,1 % dans le bras de FOLFIRINOX 6 mois, 44,0 % dans le bras entretien par LV5FU2 et 30,0 % dans le bras FIRGEM. Les toxicités de grade 3 et 4 étaient similaires entre les trois bras en dehors de la neuropathie, plus fréquente dans le bras avec traitement d’entretien (18,7 % contre 10,2 % dans le bras FOLFIRINOX 6 mois) probablement en rapport avec une exposition cumulée plus importante à l’oxaliplatine. Après une période de contrôle tumoral sous FOLFIRINOX, la place des stratégies de traitement d’entretien ou de maintenance reste à préciser
Ces résultats suggèrent que l’entretien par LV5FU2 après 4 mois de FOLFIRINOX en traitement de première ligne des AP métastatiques pourrait être une option efficace, méritant une évaluation en phase III, contrairement au schéma séquentiel FIRGEM. Une version « optimisée » du traitement séquentiel, alternant gemcitabine plus nab-paclitaxel et 5-FU, nal-IRI et acide folinique est à l’étude (phase II randomisée PRODIGE 61 FUNGEMAX).
Sous-types moléculaires : vers un intérêt clinique ? Inhibiteurs de PARP et mutations germinales BRCA1/2
Au cours des dernières années, les efforts de recherche se sont tournés vers une meilleure compréhension des mécanismes moléculaires impliqués dans l’AP ainsi que des interactions entre les cellules tumorales et leur microenvironnement (stroma), notamment avec les fibroblastes et les cellules immunitaires [1]. La cascade d’évènements moléculaires et cellulaires conduisant à la carcinogenèse pancréatique et le paysage des altérations des voies de signalisation portées par les cellules tumorales (au premier rang desquelles les mutations activatrices de KRAS présentes dans plus de 90 % des AP) ont été précisément décrits grâce à l’avènement des techniques d’analyse génomique et transcriptomique à haut débit [32]. Sur le modèle des cancers du sein ou du côlon, plusieurs équipes ont proposé d’établir une classification moléculaire des AP qui pourrait guider les décisions thérapeutiques. Ainsi, plusieurs classifications ont été publiées depuis 2011, convergeant vers l’existence d’au moins deux types moléculaires distincts de cellules tumorales (« basal », de mauvais pronostic et résistant au FOLFIRINOX, et « classical », plus favorable) et deux types de stroma (activé et normal) [32]. Néanmoins, ces classifications, si elles ont permis de révéler l’hétérogénéité moléculaire des AP, ne se sont pas traduites à ce jour par un impact sur les stratégies thérapeutiques et n’ont donc pas été introduites dans la pratique clinique de routine. Ceci s’explique par plusieurs limitations :
- –l’absence de consensus autour d’une classification (un consortium international s’est réuni en 2019 afin de proposer une classification moléculaire unique) ;
- –leur développement à partir d’échantillons tumoraux réséqués, soulevant la question de leur transposabilité aux AP avancés, qui représentent la majorité des patients ;
- –la difficulté d’accéder au matériel tumoral en quantité et en qualité suffisantes pour pouvoir être appliqué dans les contextes pré-opératoires et avancés ;
- –leur absence de valeur prédictive pour un ciblage thérapeutique spécifique.
Ces classifications, si elles ont permis de révéler l’hétérogénéité moléculaire des AP, ne se sont pas traduites à ce jour par un impact sur les stratégies thérapeutiques et n’ont donc pas été introduites dans la pratique clinique de routine
La plupart des thérapies dites « ciblées », reconnues efficaces dans d’autres localisations tumorales, se sont en effet révélées décevantes dans le traitement de l’AP [1]. De multiples études de phase II et III ont tenté d’améliorer les résultats de la gemcitabine par association avec d’autres agents, notamment les anti-angiogéniques, les agents ciblant le récepteur de l’EGF, de l’IGF, les voies de Hedgehog et des MAP kinases, et n’ont montré aucun bénéfice de SG par rapport à la gemcitabine seule, excepté pour l’association gemcitabine plus erlotinib, qui procurait un gain de SG statistiquement significatif mais cliniquement très modeste (< 1 mois) [1, 3].
Jusqu’en 2019, l’AP ne semblait donc pas un bon modèle pour les stratégies de traitement guidé sur le profil moléculaire, en raison de sa rapidité évolutive, de la difficulté d’accès au matériel tumoral en l’absence de métastase facilement biopsiable, et de la faible fréquence des anomalies « actionnables » [1, 33]. Cette vision a changé en 2019 avec la présentation des résultats de l’étude POLO chez les patients ayant un AP métastatiques dans le contexte d’une mutation germinale de BRCA. Les mutations germinales de BRCA1/2 sont la cause la plus fréquente de CaPaFa (4-17 % des familles) et prédisposent également aux cancers du sein, de l’ovaire et de la prostate [32]. Elles sont transmises sur un mode autosomique dominant à pénétrance incomplète ; l’allèle déficitaire est transmis de façon germinale à toutes les cellules de l’individu et le second allèle perd sa fonction suite à un deuxième événement génétique survenant uniquement dans certaines cellules, par mutation somatique, aussi désignée « perte d’hétérozygotie ». Du fait de la pénétrance incomplète, les mutations germinales de BRCA1/2 peuvent être retrouvées même en l’absence d’histoire familiale [32]. Les protéines BRCA sont impliquées dans la réparation de l’ADN par recombinaison homologue (RH). Leur perte de fonction est à l’origine d’une impossibilité pour la cellule à réparer les cassures de l’ADN par RH, et implique l’intervention de mécanismes alternatifs tels que la jonction d’extrémités non homologues ou la réparation par excision de base (REB), sources d’erreurs, entraînant une instabilité génétique et des aberrations chromosomiques [32]. De façon intéressante, les cellules déficitaires pour BRCA sont plus vulnérables aux traitements entraînant des cassures de l’ADN. Ainsi, les mutations de BRCA1/2 sont associées à une sensibilité importante aux chimiothérapies ciblant l’ADN (platines, mitomycine C), de même qu’aux inhibiteurs de PARP [32]. Ces derniers bloquent la REB, entraînant spécifiquement la mort des cellules déficitaires pour la réparation de l’ADN par RH, selon un principe de létalité synthétique [32]. La preuve du concept de cette stratégie est bien établie en clinique dans les cancers du sein et de l’ovaire BRCA-mutés. Sur la base de données de phase II encourageantes chez des patients porteurs d’une mutation germinale de BRCA2 ayant un AP chimio-réfractaire traité par olaparib, l’étude de phase III POLO a évalué, chez 154 patients (parmi 3315 patients screenés) ayant une mutation germinale de BRCA1 (30 %) ou BRCA2 (70 %) et une maladie contrôlée (stabilité : 50 % des cas, ou réponse tumorale : 50 %) après au moins 4 mois de chimiothérapie contenant un platine (FOLFIRINOX dans 84 % des cas, durée > 6 mois chez un tiers des patients), un traitement de maintenance par olaparib (voie orale, 300 mg × 2 par jour) versus un placebo (randomisation 3:2) [34]. La SSP (objectif principal) était doublée avec l’olaparib (7,4 mois contre 3,8 mois, HR : 0,53, p = 0,0038), sans amélioration significative de la SG (données non matures). Ces résultats constituent la première étude de thérapie ciblée positive dans l’AP et posent la question du diagnostic oncogénétique systématique dans l’AP (ou au moins chez les patients éligibles à une chimiothérapie à base de platine), avec les implications logistiques et d’organisation de la filière d’accès « urgent » (déjà en place pour les cancers de l’ovaire) que cela implique, pour identifier une population d’intérêt rare (environ 5 % des patients). L’étude de phase III POLO a évalué un traitement de maintenance par olaparib. C’est la première étude de thérapie ciblée positive dans l’adénocarcinome pancréatique
Par ailleurs, il est important de souligner que ces résultats ne peuvent pas pour le moment être extrapolés aux mutations somatiques de « BRCA-ness ». Par opposition aux mutations germinales, les mutations somatiques de BRCA1/2 ou d’autres gènes de réparation de l’ADN (notamment PALB2, ATM, RAD51), résultant en un phénotype « instable » ou « BRCA-like » plus ou moins marqué, ont été rapportés dans un nombre plus large de patients, et représenteraient jusqu’à 15 % des malades ayant un AP [32]. L’étude PRODIGE MAZEPPA, d’ouverture prochaine, posera la question du traitement de maintenance par olaparib chez des patients ayant une mutation somatique de « BRCA-ness » et une maladie contrôlée après quatre mois d’une chimiothérapie d’induction par FOLFIRINOX.
Immunothérapie : efficacité uniquement pour les tumeurs avec instabilité des microsatellites
Les immunothérapies ont révolutionné la prise en charge thérapeutique de certains cancers, notamment les mélanomes, les cancers du poumon et les tumeurs présentant une instabilité des microsatellites (MSI). Les inhibiteurs de checkpoints immunitaires (ICI) sont des anticorps monoclonaux ciblant des protéines impliquées dans la régulation négative de l’activité des lymphocytes T, qui permettent de contrôler la durée et l’amplitude des réponses immunitaires adaptatives. Les deux cibles principales sont la protéine cytotoxic T lymphocyte-associated protein 4 (CTLA-4), impliquée dans la phase d’activation des lymphocytes T au niveau des ganglions lymphatiques, et le récepteur programmed cell death-1 (PD-1) et son ligand PD-L1, impliqués dans la phase effectrice périphérique, au niveau de la tumeur [35]. Malgré leur efficacité dans de nombreux cancers, ces molécules ont jusqu’alors échoué dans l’AP [35, 36].
Pour comprendre l’échec de ces études, il convient de se pencher sur la théorie du « cycle cancer-immunité », qui définit trois conditions nécessaires à l’obtention d’une réponse immunitaire anti-tumorale efficace :
- –l’immunogénicité de la tumeur (présence de néoantigènes reconnus comme étrangers par le système immunitaire) ;
- –le recrutement à la tumeur de lymphocytes T anti-tumoraux ;
- –leur activité cytolytique [35].
À l’exception des tumeurs MSI et de rares tumeurs exprimant des néoantigènes de haute qualité (< 1-2 % des AP), l’AP appartient au groupe des tumeurs faiblement immunogène, avec un taux de mutations somatiques médian d’environ une mutation par mégabase [Mb] (contre plus de 400 par Mb dans certains mélanomes), ne produisant qu’occasionnellement des néoantigènes [35]. De plus, les AP font partie des tumeurs « froides », les lymphocytes T étant généralement absents ou exclus à la périphérie de la tumeur et ne pouvant entrer en contact direct avec les cellules tumorales [35]. En effet, ces tumeurs comportent un stroma fibreux abondant, qui constitue une barrière « chimique » ou « cytokinique » : il est infiltré par une densité élevée de cellules immunosuppressives, y compris des lymphocytes T régulateurs et des cellules inflammatoires myéloïdes (cellules suppressives dérivées de myéloïdes, macrophages M2), qui ont un impact pronostique négatif [35]. Ces cellules, dont le recrutement est induit par les fibroblastes et l’hypoxie intratumorale, libèrent des cytokines, dont le TGFβ, qui inhibent les lymphocytes T anti-tumoraux [35].En résumé, l’AP présente un microenvironnement unique qui est défavorable aux lymphocytes T anti-tumoraux et à l’activité des ICI nécessitant le développement de combinaisons thérapeutiques (vaccins, virus oncolytiques, combinaisons d’ICI, ciblage des cytokines et cellules immunosuppressives, de l’hypoxie, des fibroblastes, CAR-T cells), actuellement en cours d’exploration [35]. L’amélioration de la sélection des patients pour ces stratégies semble par ailleurs une condition importante pour leur succès. En effet, il faut plusieurs semaines avant que l’activité des immunothérapies ne s’exprime, et les patients atteints d’AP avancé en situation de progression tumorale rapide ne sont donc pas de bons candidats pour ces stratégies, ce qui peut expliquer en partie l’échec des études antérieures. Ainsi, l’étude de phase II PRODIGE 63 TEDOPaM propose une immunothérapie par vaccin polyantigénique de présentation HLA-A2 restreinte (OSE2101), seul ou en association avec le nivolumab (anti-PD-1), en traitement de maintenance chez des patients HLA-A2 positifs, stables ou répondeurs après quatre mois d’une chimiothérapie d’induction par FOLFIRINOX ; les patients progressifs d’emblée sous FOLFIRINOX ne sont pas inclus dans l’étude. Par ailleurs, l’identification de biomarqueurs prédictifs de réponse aux immunothérapies est un enjeu majeur, qui nécessite de s’appuyer sur des études ancillaires bien construites et la collaboration entre cliniciens et chercheurs. L’adénocarcinome pancréatique présente un microenvironnement unique qui est défavorable aux lymphocytes T anti-tumoraux et à l’activité des inhibiteurs de checkpoint immunitaire nécessitant le développement de combinaisons thérapeutiques
Une exception cependant à ce tableau négatif : les patients présentant une tumeur MSI. Les cellules tumorales MSI sont porteuses d’une déficience dans le système de réparation des mésappariements de l’ADN (mismatch repair, MMR ; gènes MLH1, PMS2, MSH2, MSH6). Ce système physiologique permet de corriger les erreurs que commet l’ADN polymérase lors de la réplication de l’ADN. Certaines régions de l’ADN, contenant des séquences nucléotidiques répétées (microsatellites), sont plus particulièrement exposées à ces erreurs. Dans les tumeurs MSI, en raison d’une perte d’expression ou d’activité, héréditaire (syndrome de Lynch) ou somatique (méthylation du promoteur), d’un des gènes du système MMR, des mutations s’accumulent dans le génome tumoral, en particulier au niveau des séquences microsatellitaires (phénotype MSI, diagnostiqué par PCR Pentaplex ou immunohistochimie des protéines MMR). Ces mutations, de type insertions/délétions, entraînent un décalage du cadre de lecture et conduisent à la synthèse de peptides très différents des peptides du soi (néoantigènes, protéines tronquées), qui, lorsqu’ils sont présentés par les protéines du complexe majeur d’histocompatibilité, sont fortement immunogènes. Ainsi, ces tumeurs sont particulièrement sensibles aux ICI. La première illustration a été obtenue dans les cancers colorectaux (CRC) MSI, avec les anticorps anti-PD-1 en monothérapie ou en association avec des anti-CTLA-4. Le spectre des tumeurs MSI sensibles aux ICI s’étend au-delà des cancers colorectaux, le phénotype MSI étant un marqueur prédictif de réponse aux anti-PD-1/PD-L1 pan-tumeur (reconnu ainsi dans l’AMM américaine du pembrolizumab), y compris dans les cancers du pancréas [37]. Cette sensibilité aux ICI justifie la recommandation américaine (ASCO) de déterminer le statut MSI chez tous les patients atteints d’AP avancé. Le phénotype MSI est un marqueur prédictif de réponse aux anti-PD-1/PD-L1 pan-tumeur, y compris dans les cancers du pancréas
Les soins de support : toujours plus !
Les soins de support occupent une place centrale dans la prise en charge de l’AP. Ils ont pour but d’améliorer la qualité de vie des patients et la tolérance des traitements anti-tumoraux. Ils comprennent le traitement des obstructions biliaire et/ou digestive, de la douleur, des troubles anxieux et dépressifs (chez le patient et son entourage), de la dénutrition et de la sarcopénie et des complications thromboemboliques [38].
La dénutrition est un problème fréquent (39 % toutes localisations tumorales et stades confondus ; source : enquêtes NUTRICANCER), particulièrement dans l’AP (environ 60 % des patients, tous stades confondus), et souvent sous-diagnostiqué. La dénutrition et la sarcopénie ont un impact négatif sur la qualité de vie et la survie des patients et sont associées à une augmentation du risque de complications post-opératoires, de toxicités de la chimiothérapie et de la radiothérapie, d’infections, ainsi qu’à des coûts des soins plus élevés et une diminution de l’efficacité des traitements [39]. La dénutrition et la sarcopénie ont un impact négatif sur la qualité de vie et la survie des patients
Un dépistage de la dénutrition et une prise en charge multidisciplinaire précoce (associant nutrition et activité physique adaptée) doivent être proposés chez tous les patients atteints d’AP, la dénutrition et la sarcopénie étant irréversibles aux stades tardifs [38, 39]. Ainsi les enjeux de la prise en charge nutritionnelle doivent être expliqués au patient dès l’annonce du diagnostic et l’état nutritionnel doit être réévalué régulièrement au cours du suivi.
Le diagnostic de dénutrition et l’évaluation de sa sévérité reposent sur des critères simples cliniques phénotypiques (perte de poids, indice de masse corporelle) et étiologiques (réduction des ingesta) et biologiques (albumine, syndrome inflammatoire) [38, 39]. Des outils évaluant la fonction et la densité musculaire peuvent être utilisés en complément comme l’imagerie (surface musculaire en coupe L3) et les tests fonctionnels de condition physique [39]. Un référentiel du TNCD dédié à la prise en charge nutritionnelle et d’activité physique adaptée est en cours de rédaction.
Les études multicentriques APACaP et PRODIGE 56 APACaPOp évaluent l’efficacité sur la qualité de vie de programme d’activité physique adaptée respectivement chez les patients atteints d’AP avancé et opéré.
Conclusion
Les avancées thérapeutiques dans l’AP sont lentes, mais des progrès significatifs ont été obtenus au cours de la décennie passée, des stades précoces aux formes avancées de ce cancer, et devraient se traduire à moyen terme par une amélioration de la SG à 5 ans et de la qualité de vie des patients. À côté de l’identification de nouvelles molécules ou voies thérapeutiques, l’amélioration de la rapidité d’accès aux soins, de l’expertise des équipes, l’identification de biomarqueurs pronostiques et prédictifs, la personnalisation des traitements en fonction de données individuelles, et le renforcement de la prise en charge de soins de support seront les garants des nouveaux progrès à venir.Take home messages
Liens d’intérêts
l’auteur déclare les liens d’intérêts vivants : Servier (interventions/boards), OSE Immunotherapeutics (essai clinique, congrès), Roche (interventions, financement recherche), AstraZeneca (essai clinique, boards), Amgen (interventions/boards), MSD (congrès, interventions), Novartis (boards).
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International