Hépato-Gastro & Oncologie Digestive
MENUPlace de la radiothérapie interne vectorisée dans le traitement des tumeurs neuroendocrines Volume 26, supplément 5, Décembre 2019
Introduction
Les tumeurs neuroendocrines (TNE) se caractérisent par la capacité à synthétiser, stocker et sécréter une variété de neuroamines et de peptides pouvant entraîner un syndrome sécrétoire. Les TNE proviennent majoritairement du tractus digestif et broncho-pulmonaire, et leur incidence a augmenté régulièrement au cours des trois dernières décennies [1]. Les TNE sont biologiquement et cliniquement hétérogènes. Le potentiel d’évolution métastatique et la capacité à générer un syndrome sécrétoire varient considérablement en fonction de la localisation de la tumeur primitive. À titre d’exemple, les TNE de l’intestin grêle ont un potentiel malin relativement élevé avec une progression souvent indolente, tandis que les TNE appendiculaires ou gastriques présentent habituellement un potentiel malin proche de zéro. Les TNE métastatiques de l’intestin moyen sécrètent souvent de la sérotonine et d’autres substances vasoactives, entraînant un syndrome carcinoïde typique, principalement caractérisé par des bouffées de chaleur, de la diarrhée et une cardiopathie valvulaire droite. Plus de 40 % des patients présentent une maladie métastatique au moment du diagnostic, ce qui justifie l’importance d’une bonne évaluation pré-thérapeutique. Au cours des dernières années, plusieurs nouvelles options thérapeutiques ont été validées par des essais randomisés. Les agents ciblés, y compris les analogues de la somatostatine (SSA), l’évérolimus et le sunitinib ont ainsi démontré leur efficacité.
Depuis 1992 dans le monde, et plus tardivement en France, une nouvelle thérapeutique a été évaluée dans les TNE : la radiothérapie interne vectorisée (RIV). Ce traitement correspond à une forme de radiothérapie systémique et permet l’administration ciblée de radionucléides dans les cellules tumorales exprimant des niveaux élevés de récepteurs de la somatostatine (SSTR). Pendant de nombreuses années, les preuves de l’effet anti-tumoral de la RIV n’ont été obtenues qu’à partir d’essais de phase II non randomisés ou d’études rétrospectives. L’essai randomisé de phase III NETTER-1 a finalement validé cette option thérapeutique en confirmant la faible toxicité de la RIV mais également son efficacité dans le contrôle tumoral et a permis d’obtenir une autorisation de prescription en France dans les TNE iléales métastatiques [2]. Des données intéressantes existent pour les TNE pancréatiques et pulmonaires. Dans cette revue, nous abordons l’efficacité clinique de la RIV dans les TNE gastro-entéro-pancréatiques et pulmonaires.
Récepteurs de la somatostatine et analogues de la somatostatine radiomarqués
Les effets de la RIV sont directement liés à la capacité de fixation des marqueurs sur les SSTR (SSTR1-5). Elle s’adresse donc aux TNE surexprimant fortement ces récepteurs. Les SSTR appartiennent à une famille de récepteurs couplés à la protéine G avec sept domaines transmembranaires. Les TNE sont caractérisées par la forte expression des SSTR. Alors que la prédominance du SSTR2 est observée dans la plupart des TNE gastro-entéro-pancréatiques, les TNE pulmonaires expriment de préférence le SSTR1. Les TNE de grade 1/2 expriment les SSTR plus souvent et à des niveaux plus élevés que les TNE de grade 3. Lors de la liaison aux récepteurs, les analogues de la somatostatine radiomarqués sont internalisés selon la dynamique normale de recyclage des récepteurs membranaires, et les produits de dégradation des peptides radiomarqués sont stockés dans des lysosomes, en intracellulaire, ce qui permet la libération et la rétention de la radioactivité à l’intérieur des cellules tumorales [3]. Ce mécanisme explique la faible toxicité de la RIV sur les cellules saines. Les effets de la radiothérapie interne vectorisée sont directement liés à la capacité de fixation des marqueurs sur les récepteurs de la somatostatine
Les analogues de la somatostatine radiomarqués sont constitués d’un radionucléide isotope, d’une molécule porteuse (dérivée de l’octréotide) et d’un chélateur qui les lie et stabilise le complexe. Les chélateurs couramment utilisés sont le DOTA (acide tétra-azacyclododécane-tétra-acétique) et le DTPA (acide diéthylènetriamine penta-acétique). Trois radionucléides (111In, 90Y et 177Lu) ont été conjugués aux analogues de la somatostatine et leurs différentes caractéristiques physiques confèrent des avantages spécifiques. Le 90Y et le 177Lu émettent des particules β avec une énergie plus élevée et des portées plus longues, ce qui se traduit par un plus grand potentiel thérapeutique. Grâce à l’émission de rayons γ, le 177Lu peut également être utilisé pour la dosimétrie et la surveillance de la réponse tumorale [4]. La radiothérapie interne vectorisée utilise des analogues de la somatostatine radiomarqués
Modalités de réalisation de la radiothérapie interne vectorisée et sélection des patients
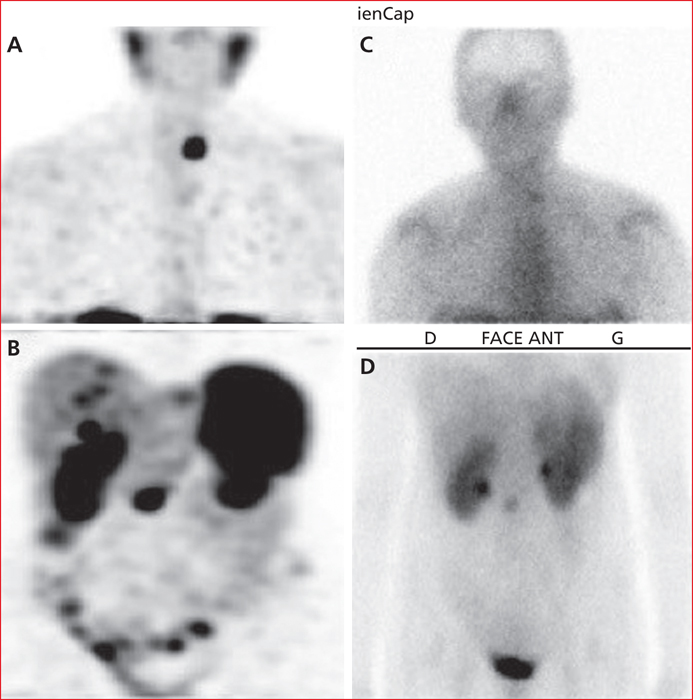
La RIV est la seule option thérapeutique validée dans les TNE pour laquelle il existe un marqueur prédictif de réponse : l’expression des SSTR. Des taux de réponse accrus ont été démontrés chez les patients ayant un degré plus élevé d’absorption des radiotraceurs lors de l’octréoscanner (figure 1). Un taux de réponse globale d’environ 60 % a été rapporté chez les patients ayant un grade 4 selon le score Krenning, correspondant à une absorption tumorale supérieure à celle de la rate et des reins. La fixation intense (SUV) supérieure à 16 au 68Ga-DOTATOC TEP-scanner est un marqueur prédictif de réponse tumorale élevée (sensibilité : 95 % ; spécificité : 60 %) [5]. L’efficacité de la RIV est corrélée au volume tumoral et à la localisation de la tumeur primitive (quantité de SSTR présents sur la cellule tumorale). Ainsi, les TNE avec un volume tumoral hépatique élevé sont considérées comme étant moins sensibles à la RIV [6]. De même, il est suggéré que les TNE pancréatiques répondent fréquemment à la RIV mais avec une rechute plus précoce que dans les TNE iléales.
Les modalités de traitement sont relativement standardisées en France avec un traitement réalisé par perfusion du radio-marqueur fractionnée en quatre cycles espacés chacun de huit semaines. L’administration concomitante d’acides aminés chargés positivement (lysine ou arginine) est systématiquement effectuée et réduit la toxicité rénale induite par la RIV. La réalisation de la RIV nécessite une fonction rénale relativement normale (taux de filtration glomérulaire > 50 mL/min), une fixation à l’octréoscanner des lésions (au moins une absorption de grade 2 selon le score de Krenning correspondant à une absorption égale ou supérieure au parenchyme hépatique normal) et une fonction médullaire normale. La radiothérapie interne vectorisée est la seule option thérapeutique validée dans les tumeurs neuroendocrines pour laquelle il existe un marqueur prédictif de réponse : l’expression des récepteurs de la somatostatine
Place dans le traitement des tumeurs neuroendocrines gastro-entéro-pancréatiques
Les études sur la place de la RIV dans les TNE gastro-entéro-pancréatiques ont principalement utilisé comme traceurs le 90Y-DOTATOC et 177Lu-DOTATATE.
90Y-DOTATOC
L’utilisation du 90Y-DOTATOC à la dose de 3,7 GBq/m2 chez 1 109 patients atteints d’une TNE gastro-intestinale (n = 387), pancréatique (n = 342), pulmonaire (n = 84) ou autres (n = 296) a montré un taux de réponse objective de 34 % selon les critères d’évaluation de réponse radiologique habituels RECIST. Chez les patients atteints d’une TNE intestinale et pancréatique, les taux de réponse objective étaient de 47 % et 27 %, respectivement. Dans l’ensemble de la population, la médiane de survie globale était de 95 mois [7]. La comparaison des essais cliniques et des séries rétrospectives concernant la RIV avec l’utilisation du 90Y-DOTATOC dans les TNE gastro-entéro-pancréatiques est impossible car les modalités de sélection des patients, les critères de fixation du traceur à l’imagerie pré-thérapeutique et les protocoles de perfusion diffèrent largement en fonction des études. Actuellement en France, sur les bases de l’étude NETTER-1, le traceur le plus utilisé est le 177Lu-DOTATATE.
177Lu-DOTATATE
Le 177Lu-DOTATATE est actuellement le radiopeptide le plus largement utilisé. Ce radiomarqueur a démontré une efficacité similaire à celle du 90Y-DOTATOC, tout en présentant une toxicité plus faible, notamment hématologique [8]. Dans une série de 310 patients traités pour une TNE gastro-entéro-pancréatique par quatre cycles de 7,4 GBq de 177Lu-DOTATATE, il a été mis en évidence un taux de réponse objective de 30 %. Un mauvais état général (Score de Karnofsky < 70 %) et une atteinte hépatique importante étaient associés à une mauvaise réponse au traitement. Ainsi les traitements par 177Lu-DOTATATE et 90Y-DOTATOC sont associés à des résultats médiocres lorsque le volume tumoral est élevé [8]. Dans une méta-analyse portant sur 473 patients traités par 177Lu-DOTATATE pour une TNE, les taux de réponse objective variaient entre 18 % et 44 % selon les critères RECIST, avec un taux moyen de contrôle de la maladie de 81 % [9].
Les études rétrospectives et de phase II du 177Lu-DOTATATE ont montré une survie sans progression médiane de 33 à 36 mois chez des patients présentant des TNE métastatiques de petite taille avec une progression tumorale documentée et/ou un symptôme carcinoïde non contrôlé [10]. C’est dans ce contexte que l’étude NETTER-1 (phase III randomisée) a évalué et positionné la place de la RIV très précocement dans la prise en charge des patients présentant une TNE du grêle métastatique [2]. Cette étude a comparé chez 229 patients atteints de TNE du grêle avancées, avec une fixation à l’octréoscanner et en progression sous analogue de la somatostatine (octréotide) à la dose de 30 mg par mois, le 177Lu-DOTATATE à l’octréotide retard à la dose de 60 mg par mois (double dose) (figure 2). Le principal critère d’évaluation de l’étude était la survie sans progression évaluée selon les critères radiologiques RECIST 1.1. Le traitement par 177Lu-DOTATATE a entraîné une réduction de 79 % du risque de progression ou de décès par rapport à l’octréotide à double dose (p < 0,0001). La survie sans progression médiane n’a pas été atteinte dans le groupe traité par RIV versus 8,4 mois dans le groupe témoin. De même, le traitement par RIV a été associé à un taux de réponse objective de 18 % versus 3 % avec l’octréotide (p < 0,0004). Ainsi et sur la base de ces données de phase III, le 177Lu-DOTATATE s’est positionné comme une nouvelle option thérapeutique dans les TNE du grêle en progression sous analogue de la somatostatine et a obtenu l’autorisation de mise sur le marché avec cette indication. Il est important de noter qu’un suivi à long terme est nécessaire afin d’évaluer l’impact de ce nouveau traitement sur la survie globale des patients. À ce jour, les premières données, réalisées lors des analyses intermédiaires suggèrent un bénéfice en survie globale dans le groupe traité par RIV (p = 0,004). Le 177Lu-DOTATATE est le radiopeptide le plus largement utilisé et le seul à avoir obtenu l’autorisation de mise sur le marché dans les tumeurs neuroendocrines du grêle en progression sous analogue de la somatostatine
Dans les TNE pancréatiques, les résultats ne sont pas confirmés par une étude de phase III. Une série rétrospective réalisée chez 68 patients pris en charge pour une TNE pancréatique et ayant reçu quatre cycles de 177Lu-DOTATATE à 8 GBq n’a montré aucun bénéfice en termes de survie chez les patients (n = 35) traités par RIV en première ligne [11]. En revanche, des signaux en faveur d’une efficacité sont identifiés car dans cette cohorte un taux de contrôle de la maladie de 85 % et un délai médian jusqu’à progression de 34 mois ont été observés [6]. Les TNE pancréatiques sont plus sensibles à la chimiothérapie cytotoxique que les autres TNE. Ainsi, la place de la RIV doit encore être évaluée par des études comparatives.
En résumé, la RIV s’est parfaitement positionnée précocement dans les TNE du grêle en progression sous analogues de la somatostatine et doit encore trouver sa place dans les TNE pancréatiques. La radiothérapie interne vectorisée doit encore trouver sa place dans les tumeurs neuroendocrines pancréatiques métastatiques
Place dans le traitement des tumeurs neuroendocrines pulmonaires
Plusieurs études ont évalué la RIV chez des patients atteints de TNE pulmonaires et ont rapporté des résultats similaires à ceux observés dans les TNE du grêle. Cependant, les indications sont limitées car de nombreuses TNE pulmonaires, en particulier les tumeurs carcinoïdes atypiques, expriment relativement peu de SSTR2 et sont donc inéligibles à cette forme de traitement [12]. Dans une étude portant sur 34 patients atteints de TNE bronchiques, le traitement par 177Lu-DOTATATE a été associé à un taux de réponse objective faible de 15 %. Les durées médianes de survie sans progression et de survie globale étaient de 19 et 49 mois, respectivement [13]. Récemment, l’activité des radiotraceurs (177Lu-DOTATATE et 90Y-DOTATOC) a été évaluée dans une série monocentrique de 114 patients avec TNE pulmonaire. Les durées médianes de survie sans progression et de survie globale étaient de 28 et 59 mois, respectivement. Une néphrotoxicité était plus fréquemment observée chez les patients ayant reçu du 90Y-DOTATOC [14]. Ainsi à ce jour, nous avons un faisceau d’arguments en faveur d’une efficacité de la RIV dans les TNE pulmonaires. Ces données plaident pour une phase III de validation dans cette situation.
Place du retraitement par radiothérapie interne vectorisée
Tous les patients traités par RIV présenteront une progression de la maladie à quelques mois voire quelques années. Dans l’étude NETTER-1, seulement 30 % des patients ont présenté une progression de leur maladie à 20 mois. La toxicité et l’efficacité du retraitement avec des cycles supplémentaires de RIV ont été évaluées dans plusieurs petites séries rétrospectives. Vingt-sept patients progressant après une réponse initiale au 90Y-DOTATOC ont été retraités par 177Lu-DOTATATE [15]. Le taux de contrôle de la maladie était de 70 % et aucune toxicité grave n’a été rapportée [15]. Plus récemment, une étude de phase II a porté sur le retraitement avec le 177Lu-DOTATATE à faible dose (jusqu’à 18,5 GBq administrés en 4-5 cycles) chez 26 patients qui ont progressé au moins 12 mois après le début du traitement par 90Y-DOTATOC. La survie sans progression médiane était de 22 mois et le taux de contrôle de la maladie était de 85 % [16]. Dans l’ensemble, le retraitement par RIV dans les TNE semble être associé à une faible toxicité, à une réponse tumorale plus faible et à une survie sans progression inférieure que lors du premier traitement par RIV. Le retraitement peut être rediscuté chez des patients ayant eu une très bonne tolérance du traitement initial et une réponse prolongée. Des études futures seront indispensables afin d’identifier la place d’un retraitement par RIV en comparaison aux traitements validés (thérapies ciblées, chimiothérapie…). Le retraitement par radiothérapie interne vectorisée est possible car peu toxique et associé de nouveau à un contrôle tumoral mais avec une efficacité qui semble moindre que lors du traitement initial
Tolérance de la radiothérapie interne vectorisée
La RIV est généralement bien tolérée. Dans l’étude NETTER-1, validant la RIV dans les TNE du grêle, 5 % des patients ont arrêté le traitement en raison d’une toxicité liée à la RIV.
Les effets secondaires aigus sont principalement des nausées, des vomissements, de la fatigue et des douleurs abdominales. Ces évènements indésirables sont majoritairement liés à la perfusion simultanée d’acides aminés. Une vigilance particulière doit être portée sur le risque de crise carcinoïde. Cet événement a été signalé dans une très petite minorité (1 %) de patients ayant reçu un traitement par RIV. Cette crise apparait habituellement dans les 48 heures suivant la première perfusion et est liée au relargage massif d’amines actives [17]. Une myélosuppression a été décrite et est causée par l’irradiation de la moelle osseuse. La moelle osseuse est particulièrement radiosensible et cette toxicité ne semble pas être associée à l’expression des SSTR dans les cellules myéloïdes. La myélosuppression se développe généralement quatre à six semaines après la perfusion, est généralement de grade 1/2 et est réversible. Des effets toxiques hématologiques de grade 3/4 ont été décrits chez des patients ayant reçu 90Y-DOTATOC et 177Lu-DOTATATE, respectivement [18]. La lymphopénie est la cytopénie sévère la plus souvent signalée. D’autres toxicités ont été rapportées, notamment un risque d’hépatotoxicité chez les patients présentant un envahissement hépatique majeur. Ainsi, comme indiqué plus haut, il est souhaitable d’envisager la RIV précocement dans la prise en charge de la maladie. La toxicité hématologique aiguë se développe généralement 4 à 6 semaines après la perfusion et est généralement de grade 1 ou 2
Les effets secondaires à long terme de la RIV peuvent inclure l’insuffisance rénale et les syndromes leucémiques ou myélodysplasiques. Les radiomarqueurs sont réabsorbés dans les tubules proximaux, peuvent s’accumuler dans l’interstitium rénal et provoquer des lésions rénales. Dans une grande série institutionnelle de 1 109 patients traités avec du 90Y-DOTATOC, 103 patients (9 %) ont présenté une toxicité rénale sévère [7]. L’administration concomitante d’acides aminés chargés positivement entraîne une réduction allant jusqu’à 40 % de l’absorption rénale. Malgré la protection rénale, la diminution médiane de la clairance de la créatinine est estimée à 4 % par an chez les patients ayant reçu un traitement par 177Lu-DOTATATE. Les facteurs de risque de néphrotoxicité sont le diabète et l’hypertension artérielle mal contrôlée. Le risque de néphrotoxicité grave (grade 3/4) n’a été observé que chez 1,5 % des patients. Dans l’ensemble, l’insuffisance rénale terminale à la suite d’une RIV est extrêmement rare. Des cas de leucémies aiguës et de syndromes myélodysplasiques ont été rapportés comme toxicité tardive de la RIV, avec une incidence estimée jusqu’à 2 %. L’âge supérieur à 70 ans, une cytopénie avant traitement, la présence de métastases osseuses, le nombre élevé de traitements antérieurs, l’utilisation préalable d’un alkylant et la radiothérapie augmentent le risque de syndrome myélodysplasique secondaire. Brieau et al. ont rapporté lors d’une étude monocentrique rétrospective réalisée dans une population de patients traités par RIV et préalablement par chimiothérapie à base d’alkylant un risque accru de toxicité hématologique tardive (20 % ; 4 patients sur 20) [19]. Le principal agent alkylant utilisé dans les TNE est le témozolomide. Le développement du syndrome myélodysplasique ou de la leucémie a été rapporté entre 30 et 70 mois après le traitement par RIV [19]. Ces résultats suggèrent une imputabilité de l’association entre les agents alkylants et la RIV car la même équipe a rapporté que seulement 1 % des patients atteints d’une TNE gastro-entéro-pancréatiques et traités par chimiothérapie alkylante sans RIV ultérieure ont développé un syndrome myélodysplasique. Cette différence entre les taux rapportés par Brieau et al. et les différentes études rétrospectives pourrait être liée à la réalisation d’une chimiothérapie première. Ces données sont en faveur d’un traitement par RIV antérieur à la chimiothérapie. L’insuffisance rénale et les syndromes leucémiques ou myélodysplasiques sont des effets secondaires décrits à long terme mais très rares (< 2 %)
Conclusion
La RIV présente une efficacité anti-tumorale dans les TNE avec un bénéfice en termes de taux de réponse objective et de survie sans progression. Le niveau de preuve varie en fonction de la localisation de la lésion primitive. L’essai NETTER-1, étude de phase III randomisée, a validé la place de la RIV précocement dans les TNE iléales. Dans les autres localisations, plusieurs études plaident pour une efficacité de la RIV mais sa place reste à définir. Des études futures seront utiles afin d’identifier la ligne thérapeutique optimale de la RIV par rapport aux autres thérapeutiques validées dans les TNE (chimiothérapie, évérolimus et sunitinib).Take home messages
Liens d’intérêts
l’auteur a été conférencier pour AAA.
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International