Hématologie
MENUProgression de la leucémie myéloïde chronique : des mécanismes moléculaires multiples mais une origine probablement commune, l’instabilité génétique ? Volume 20, numéro 6, Novembre-Décembre 2014
- Mots-clés : leucémie myéloïde chronique, progression, cellule souche, instabilité génétique
- DOI : 10.1684/hma.2014.0967
- Page(s) : 308-18
- Année de parution : 2014
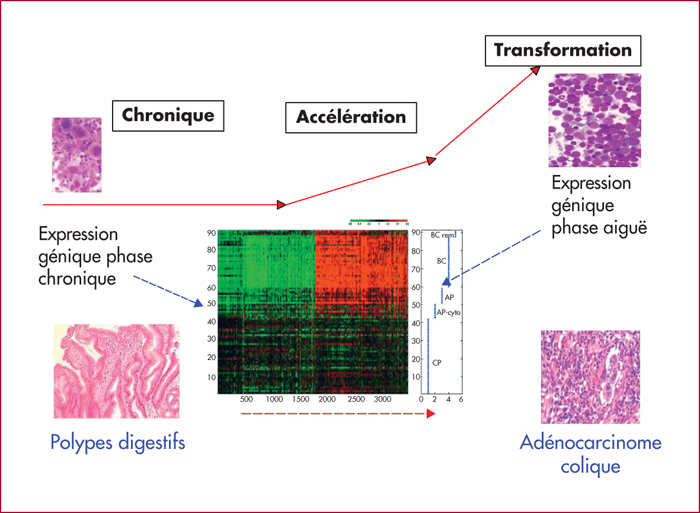
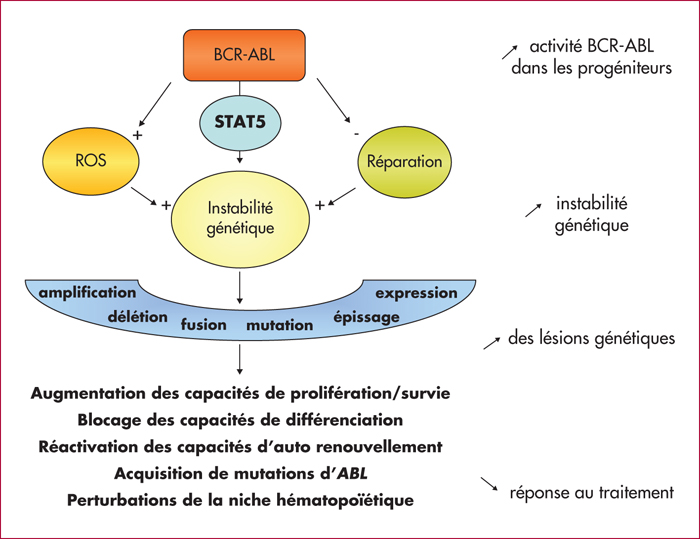
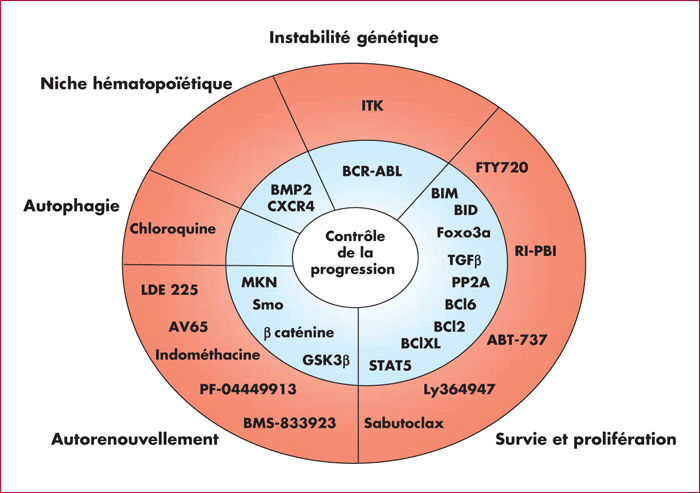
La leucémie myéloïde chronique (LMC) s’apparente à un modèle simple d’oncogenèse puisqu’une anomalie – la translocation réciproque t(9;22)(q34;q11) conduisant à la fusion des gènes BCR et ABL – suffit à poser le diagnostic. Sa progression se caractérise par des variations génotypiques et phénotypiques de la cellule cancéreuse engagée dans la différenciation myéloïde : le progéniteur granulocyte-macrophage perd ses capacités de différenciation cellulaire et d’apoptose, et retrouve des propriétés de cellules souches. Ces modifications moléculaires s’accompagnent de l’accumulation de nombreuses lésions et du changement du profil d’expression des gènes. Fait surprenant, à la succession de trois phases d’évolution de la maladie (phase chronique, phase accélérée et phase blastique) se superpose, au niveau moléculaire, deux phases seulement de variations du profil du transcriptome, les profils d’expression de la phase accélérée et de la phase blastique étant similaires. Cela suggère un phénomène d’irréversibilité de la progression. Par ailleurs, la grande hétérogénéité des lésions observées ne permet pas de définir un profil particulier, et révèle la complexité des mécanismes pouvant intervenir dans la progression de la maladie. Seule la source de ces variabilités est très probablement commune : elle pourrait être liée à une augmentation du stress oxydatif de la cellule souche cancéreuse. En effet, la production d’espèces oxygénées réactives (ROS) est à l’origine des mutations et des cassures de l’ADN. De plus, BCR-ABL favoriserait l’augmentation de ROS et la persistance des lésions par des mécanismes de réparations altérés. Les cellules souches leucémiques sont donc une sorte de réservoir de cellules susceptibles d’initier la progression de la maladie. Or, ces cellules sont insensibles aux inhibiteurs de tyrosine kinases, n’étant pas dépendantes du signal BCR-ABL pour leur survie. Cela explique le risque élevé d’échec des thérapies ciblées dans les phases avancées de la maladie. Dans cette revue de la littérature, nous essayons de dresser un état des connaissances sur les mécanismes de la progression de la LMC, qui, s’il n’est pas exhaustif, est du moins illustratif de la multiplicité et de la complexité des procédés mis en jeu. Concernant les perspectives thérapeutiques : ce sont les stratégies d’associations médicamenteuses ciblant à la fois BCR-ABL et les mécanismes essentiels à la persistance des cellules souches leucémiques, associations encore en développement préclinique plus la plupart, et dont nous rapportons quelques exemples, qui sont à l’étude. Ainsi, actuellement, éradiquer la maladie pour maîtriser sa progression reste encore un défi.