Environnement, Risques & Santé
MENUÉtude des effets de l’uranium sur l’intégrité de l’os Volume 17, numéro 1, Janvier-Février 2018
L’uranium naturel est un métal lourd radioactif (qui fait partie de la famille des actinides), présent dans l’environnement à des concentrations différentes au niveau de la croûte terrestre [1]. Il est utilisé essentiellement dans l’industrie nucléaire civile et militaire ; sa dispersion potentielle dans l’environnement génère des inquiétudes de la part du public. L’ingestion constitue la principale source d’exposition interne et chronique à l’uranium. La quantité seuil de ce radionucléide dans l’eau de boisson a été fixée par l’Organisation mondiale de la santé (OMS) à 30 μg/L [2]. Cependant, certaines régions sont naturellement riches en uranium et les populations environnantes peuvent être exposées en consommant l’eau de boisson provenant de puits privés ([3-5]).
L’uranium possède une double toxicité, chimique et radiologique, et a un tropisme particulier pour certains organes et tissus, tels que les reins et l’os. L’équipe de Kurttio a montré chez l’homme, une corrélation entre la consommation d’eau contenant de l’uranium naturel et une augmentation des phases formation/résorption osseuse [6]. Chez l’animal, l’ingestion chronique d’uranium affecte différents métabolismes majeurs, mais aussi le système nerveux et le système reproducteur [7]. Des études expérimentales, notamment celles de l’Institut de radioprotection et de sûreté nucléaire (IRSN) (programme Envirhom), ont montré des modifications du métabolisme rénal de la vitamine D [8], hormone essentielle pour l’os, chez le rat après ingestion chronique d’uranium via l’eau de boisson [9, 10]. D’autres études ont montré que l’exposition aiguë ou subchronique à l’uranium altère la formation et la croissance osseuse [11-13].
Actuellement très peu de données sont disponibles sur les effets biologiques induits après une ingestion chronique de faible quantité d’uranium sur le métabolisme osseux, et plus particulièrement sur l’intégrité du tissu osseux. En effet, l’intégrité du squelette revêt une importance capitale pour l’homéostasie phosphocalcique, mais aussi pour la qualité de vie, car la fragilisation de l’os peut entraîner certaines pathologies telles que l’ostéoporose. Au regard des connaissances scientifiques existantes, notre hypothèse est qu’une exposition chronique à de faibles concentrations d’uranium pourrait affecter le remodelage osseux, soit en augmentant, soit en diminuant le turnover osseux, et par conséquent affecter la qualité et l’intégrité du tissu osseux. Actuellement, il existe peu d’informations scientifiques concernant la toxicité de l’uranium à faibles doses sur l’os après ingestion chronique chez l’animal [14]. Par ailleurs, l’analyse de la littérature indique que toutes les études portant sur les effets de l’uranium sur l’os sont réalisées en utilisant exclusivement des dosages sériques et/ou de l’histomorphométrie osseuse pour évaluer les paramètres impliqués dans le métabolisme osseux. Aucune étude n’a abordé l’impact des modifications de ce métabolisme sur l’intégrité du tissu osseux. Le microscanner est donc un outil sensible et indispensable, car il est le seul à pouvoir évaluer l’impact des modifications du métabolisme osseux sur ce tissu en renseignant sur la qualité et la micro-architecture osseuse.
Le but de ce travail est d’évaluer pour la première fois l’impact des modifications de ce métabolisme sur le squelette après ingestion chronique via l’eau de boisson chez le rat. Pour cela, nous avons utilisé un microscanner d’une haute résolution, la microtomographie tridimensionnelle (Scanco Viva CT 40), qui permet d’étudier la qualité et l’intégrité du tissu osseux chez un modèle « sensible » ou « postnatal » contaminé dès la naissance avec trois concentrations différentes d’uranium naturel pendant neuf mois.
Matériel et méthode
Animaux et procédure de contamination
Quarante-huit rats mâles Sprague-Dawley ont été utilisés dans cette étude. Ils ont été hébergés à température constante (21 ± 2 ̊C) avec un cycle 12 heures/12 heures (jour/nuit) et avaient libre accès aux granules standards de rat (A04-10 SÛR, Augy, France) et à l’eau. Toutes les procédures expérimentales ont été approuvées par le Comité d’éthique de l’IRSN et conformément à la réglementation française pour l’expérimentation animale (ministère de l’Agriculture, décret n̊ 2001-464, mai 2001). Dans cette étude, nous avons utilisé un modèle en croissance dit « sensible », c’est-à-dire que les animaux ont été contaminés dès la naissance (modèle postnatal). Pour cela, des rates gestantes Sprague-Dawley (souche CD) provenant de Charles Rivers (L’Arbresle/Rhône, France) ont été utilisées pour cette étude. Après la mise bas, les mères ont été exposées à de l’eau non contaminée ou contaminée à de l’uranium naturel 0,7 % d’U235 avec différentes concentration (1,5 mg/L, 10 mg/L et 40 mg/L), et les ratons ont donc été contaminés via la lactation. Après le sevrage, les ratons mâles (N = 12 individus/groupe) issus de mères contaminées et de mères non contaminées ont été récupérés de telle sorte que dans chaque groupe les ratons étaient issus de portées différentes. Après neuf mois de contamination, le sang a été prélevé sous anesthésie terminale pour le dosage de certains paramètres sériques, puis les rats ont été euthanasiés (figure 1). Les fémurs ont ainsi été prélevés, nettoyés, fixés et déshydratés dans du formol 10 % pendant 48 heures puis conservés dans de l’acétone. Ils ont ensuite été scannés au microtomographe en ex vivo.
Mesure des paramètres sanguins
La vitamine D active (1,25(OH)2D3), l’hormone parathyroïdienne (PTH), la C-télopeptide (CTX), la phosphatase alcaline (ALP) et l’ostéocalcine ont été mesurées dans le plasma à l’aide de kits de dosage radio-immunologique (IDS [immunodiagnostic systems] et DSL [diagnostics systems laboratories], France). Les taux de créatinine, d’urée, de magnésium, de calcium et de phosphate inorganique plasmatique ont été déterminés par un analyseur Konelab 20 (Thermo Electron Corporation, France).
Mesure de l’uranium dans l’os
Les fémurs ont été préparés en ajoutant 8 ml d’acide nitrique à 70 % ultra-pure (instra-analysés pour l’analyse des métaux traces, Sodipro, Echirolles, France) et 2 ml de peroxyde d’hydrogène. Ils ont ensuite été minéralisés en utilisant un four à micro-ondes 1 000 W (Ethos tactile, Milestone Systems Laboratory, Italie) avec une rampe de 20 minutes à 180 ∘C, suivies de 10 minutes à 180 ̊C. Les mesures ont enfin été analysées pour leur teneur en uranium par spectrométrie de masse à plasma à couplage intensif (ICP-MS) (EXCEL, ThermoFisher, France). Le bismuth (1 ug/L) a été utilisé comme standard interne.
Calcul de la dose au squelette due à la charge en uranium naturel
Une valeur haute de la dose absorbée par le squelette au cours de l’expérience a été estimée en appliquant des hypothèses majorantes. Le spectre d’émission énergétique de l’uranium naturel a été établi suivant les données de la publication de l’International Commission on Radiological Protection (ICRP) [15], et de la composition isotopique en activité radioactive suivante : Uranium-235 : 2,2 % ; Uranium-234 : 48,9 % ; Uranium-238 : 48,9 %. Toute l’énergie émise, majoritairement sous forme de particules alpha, est supposée localement absorbée dans l’os. L’activité cumulée dans les os a été évaluée sur la base d’une énergie spécifique de l’uranium naturel de 25,3 Bq/mg et d’une intégration approchée de la charge en uranium, considérée comme constante entre deux points de sacrifice des animaux, égale à la valeur maximum mesurée à la fin de la période. La dose absorbée totale est alors le produit de l’énergie émise par désintégration par l’activité cumulée pendant la durée de l’expérience, rapportée à la masse de l’os considéré. La quantité d’uranium estimée au niveau du fémur des animaux contaminés avec 40 mg/L après neuf mois de contamination était de 25 μGy.
Quantification des paramètres de masse et de micro-architecture en microtomographie tridimensionnelle (Scanco, Viva CT 40)
Dispositif et principe
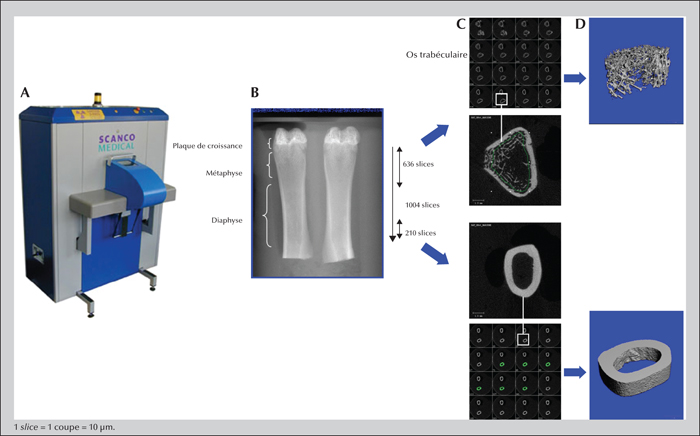
Pour la mesure de ces paramètres, nous avons utilisé la microtomographie tridimensionnelle (μCT) réalisée par un microscanner : le Viva CT 40 (figure 2A, Scanco Medical, Bassersdorf, Suisse). Un tube à rayon X a été utilisé comme source. Ce tube fonctionne avec une tension comprise entre 30 et 50 KeV. Une caméra (Camera Coupled Device, 1024 pixels/253) diode fonctionnant en mode linéaire a été couplée à l’appareil pour la détection de l’image. Le microtomographe fonctionne en mode d’acquisition spiralé : l’objet balayé reste stationnaire, la source de rayon X et le détecteur tournent autour. La résolution utilisée pour l’acquisition dans cette étude était de 10 μm (X, Y, Z) et donnait donc une taille de voxel de 10 × 10 × 10 μm3. Après reconstruction des fichiers d’acquisition en piles d’images (figure 2C), ils ont été analysés grâce à un ordinateur relié au tomographe. Les images tridimensionnelles (figure 2D) ont ensuite été générées permettant d’obtenir des paramètres morphométriques et de micro-architecture (organisation et relations des unités élémentaires ou structurelles du tissu osseux entre elles) de l’os (trabéculaire et cortical) [16].
Protocole de mesure
Le site osseux acquis sur les fémurs de rat en ex vivo était une zone de 636 coupes allant de la plaque de croissance au milieu de la diaphyse (figure 2B). Après acquisition et segmentation des images à 55 Kev, un volume d’intérêt de 210 coupes correspondant à la spongieuse secondaire (os trabéculaire) a été choisi pour l’évaluation tridimensionnelle des paramètres morphométriques et de micro-architecture.
Pour l’os cortical, une zone d’intérêt de 210 coupes, à partir du milieu de la diaphyse, a été acquise, puis un volume d’intérêt de 50 coupes a été évalué pour déterminer les paramètres morphométriques (figure 2B).
Paramètres mesurés
Paramètres morphométriques
Le BV/TV (bone(os) volume/tissu volume) est la fraction volumique du tissu osseux ou la masse osseuse (en %). Les autres paramètres mesurés sur l’os trabéculaire étaient le Tb.N (trabecular number) ou nombre de trabécules (en trabécules/μm), la Tb.Sp (trabecular separation) ou séparation entre les trabécules (en μm), et le Tb.Th (trabecular thickness) ou épaisseur des trabécules (en μm).
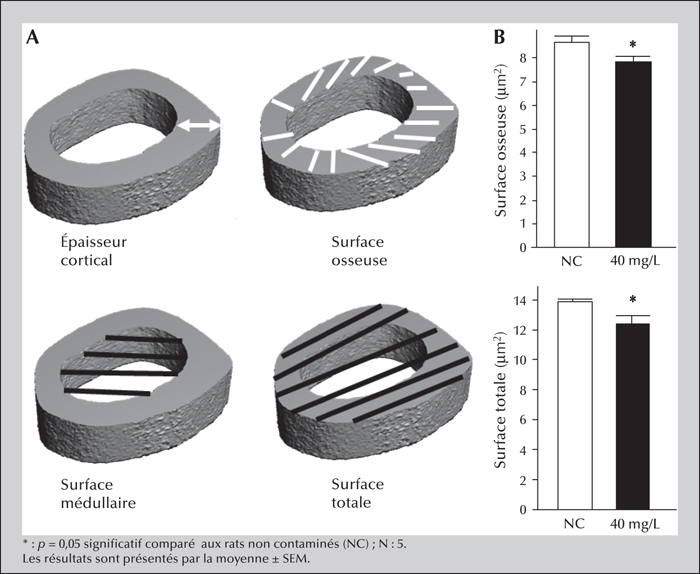
Pour l’os cortical, la Ct.Th (cortical thickness) ou épaisseur de l’os cortical et la BMD (bone mineral density) ou la densité minérale osseuse ont aussi été mesurées. La B.Ar (bone area) ou la surface osseuse, la C.S.Ar (total cross-sectional area) ou surface totale et la porosité corticale ont ensuite été déduites par des calculs.
Paramètres de micro-architecture
Le SMI (structure modele index) ou index de modèle structural est le reflet de l’agencement de la micro-architecture trabéculaire ; lorsque la structure adopte une organisation en plaques, le SMI est proche de 1, et le tissu osseux est donc de bonne qualité, alors que pour une organisation en colonnes, il est proche de 3, et le tissu osseux est à tendance ostéoporotique. Le DA (degree of anisotropy) ou degré d’anisotropie est le reflet de l’orientation des travées osseuses, le tissu osseux étant par essence anisotrope, c’est-à-dire que les travées osseuses sont bien orientées selon une direction orientée sous l’effet de la gravité. La Den.Con. (density of connectivity) ou densité de connexion est le reflet du degré de connexion entre les trabécules. Plus la Den. Con. est élevée et plus les trabécules sont connectés entre eux, et donc plus le réseau osseux est de meilleure qualité.
Analyse statistique
Les résultats sont présentés en moyenne ± SEM. Nous avons fait une analyse statistique test t de student entre groupes contaminés (C) et non contaminés (NC) et une analyse de variance à une voie test entre les groupes avec différentes concentrations d’uranium, avec p < 0,05 considéré comme significatif.
Résultats
L’homéostasie phosphocalcique et la fonction rénale
Quelle que soit la dose utilisée dans cette étude, l’uranium n’affecte pas l’homéostasie phosphocalcique reflétée par les minéraux sériques (calcium, phosphore), la vitamine D et la parathormone sérique. On note une diminution significative de l’urée à la dose de 1,5 mg/L et de la créatinine à 40 mg/L, en comparaison aux animaux non contaminés (Test t, p = 0,038 et p = 0,020 respectivement). Cependant ces valeurs restent dans la tranche des valeurs physiologiquement normales chez le rat (tableau 1). L’analyse de variance à une voie montre qu’il n’existe pas d’effet dose. Ces résultats suggèrent que l’uranium n’affecte pas la fonction rénale et non-néphrotoxique à ces doses après une exposition chronique.
Accumulation de l’uranium dans l’os
Après neuf mois de contamination, l’uranium s’accumule dans le fémur des rats contaminés. L’analyse de variance à une voie montre que l’uranium s’accumule significativement dans l’os dose-dépendant (p < 0,0001, tableau 2).
Paramètres de masse et de micro-architecture de l’os trabéculaire
Après neuf mois de contamination, l’évaluation en microtomographie tridimensionnelle des paramètres de masse, que sont la masse osseuse (BV/TV), le nombre de trabécules (Tb.N), l’épaisseur des trabécules (Tb.Th) et l’espacement entre les trabécules (Tb.Sp), montre que l’uranium naturel ingéré à une dose de 1,5, 10 et 40 mg/L, n’altère pas ces paramètres (tableau 3). De la même façon, ces doses n’affectent pas les paramètres de micro-architecture que sont le degré d’anisotropie (DA), l’index de modèle structural (SMI) et la densité de connexion des trabécules (Den.Con) (tableau 3).
Surfaces osseuses et surface totale de l’os cortical
Après neuf mois de contamination, l’uranium naturel n’affecte pas les paramètres que sont la densité minérale osseuse (BMD), la porosité corticale et l’épaisseur corticale chez les rats contaminés avec 1,5, 10 et 40 mg/L (tableau 3). Cependant, nous observons une diminution significative de la surface osseuse (test t, p = 0,039, figure 3B) de l’os cortical diaphysaire chez les rats contaminés avec 40 mg/L, en comparaison aux animaux non contaminés. L’analyse de variance à une voie n’est pas significative, nous n’avons pas d’effet dose. La surface osseuse étant significative à la dose de 40 mg/L, nous avons alors calculé la surface médullaire (test t, p = 0,09, tableau 3) et la surface totale qui est significativement diminuée par rapport aux rats non contaminés (test t, p = 0,020, figure 3B).
Discussion
Le squelette est un tissu vivant en perpétuel remaniement. Le capital osseux est maintenu et renouvelé par le remodelage osseux qui est un couplage entre la formation et la résorption de l’os. Il est régulé par des facteurs physiologiques et environnementaux. Les modifications de ce couplage peuvent impacter l’intégrité du tissu osseux. La micro-architecture osseuse est importante pour comprendre les mécanismes de la fragilité osseuse, de même que l’action de certaines molécules (molécules toxiques, par exemple certains métaux lourds qui ont un tropisme particulier pour l’os, ou molécules utilisées pour le traitement de l’ostéoporose, par exemple le strontium susceptible d’affecter le remodelage osseux) [17-19].
L’os constitue le site préférentiel d’accumulation de l’uranium à long terme [20, 21]. L’uranium est capable de se substituer au calcium par de l’ion uranyle UO22+ au calcium (Ca2+) de l’hydroxyapatite de la matrice osseuse, sans participer à la formation de ces cristaux [22], ce qui peut entraîner un dysfonctionnement de la minéralisation de la matrice osseuse lors de longue ou de forte accumulation d’uranium dans l’os. En effet, il a été décrit que l’uranium, après 28 jours d’une unique injection en intra-musculaire, diminue la densité minérale de l’os [13]. Dans ce cas-là, c’est la toxicité chimique et donc métallique de l’uranium naturel qui est prépondérante sur sa toxicité radiologique. Dans notre étude, l’uranium naturel est essentiellement caractérisé pour sa toxicité chimique, d’autant que dans nos conditions expérimentales la contamination par l’uranium correspond à une dose radioactive absorbée au niveau du fémur qui a été estimée à 25 μGy (rayonnements α), représentant une très faible dose de radioactivité. Les effets de ce radionucléide pourraient donc induire, comme d’autres métaux lourds tels que le cadmium, une diminution significative du contenu en minéral de l’os [23].
Il y a cinq ans, une étude utilisant deux modèles expérimentaux, un modèle adulte (les animaux sont contaminés à partir de l’âge de trois mois) versus un modèle postnatal (les animaux sont contaminés à partir de la naissance), avait montré que le modèle postnatal est plus sensible à l’uranium en termes d’effets biologiques [24]. Pour compléter ces données scientifiques, nous avons utilisé dans notre étude ce modèle postnatal pour estimer l’impact d’une exposition à l’uranium, et plus particulièrement avec l’utilisation de différentes concentrations de ce radionucléide, afin de déterminer à quelle dose apparaissent les effets de l’uranium sur le métabolisme osseux et sur l’intégrité de l’os.
Dans notre étude, après neuf mois d’exposition chronique, nous n’observons pas de modification au niveau sérique de l’homéostasie phosphocalcique ainsi que des paramètres du remodelage osseux. Cependant, nous observons que l’uranium s’accumule dans l’os et que cette accumulation est dose-dépendante dans le fémur des animaux contaminés. L’uranium naturel n’affecte pas les paramètres de masse (la masse osseuse, le nombre de trabécules, l’épaisseur des trabécules et l’espacement entre les trabécules), ni les paramètres de micro-architecture (le degré d’anisotropie, l’index de structure et la densité de connexion) de l’os trabéculaire, quelle que soit la concentration d’uranium utilisée. Ces paramètres renseignent sur la qualité de l’os trabéculaire. L’os trabéculaire est formé de travées osseuses qui sont connectées entre elles pour former un réseau bien orienté selon les forces mécaniques appliquées à l’os telles que la pesanteur. Cet os trabéculaire représente 20 % de la masse osseuse et est métaboliquement le plus actif. Toute modification du remodelage osseux peut donc affecter cet os à court ou à long terme. Au niveau de l’os cortical (80 % de la masse osseuse), l’uranium n’affecte pas la densité minérale osseuse, l’épaisseur corticale et la porosité corticale. Cependant, de façon intéressante, nous observons chez le modèle postnatal, une diminution significative de 9,5 % de la surface osseuse et une diminution de 10,60 % de la surface totale chez les rats contaminés avec 40 mg/L d’uranium, en comparaison aux rats non contaminés. Ces résultats signifient que le diamètre du fémur au niveau de la diaphyse est plus petit et qu’il pourrait être expliqué par un ralentissement de la croissance en largeur. Il a été décrit chez le rat que la quantité d’uranium accumulée dans l’os cortical et trabéculaire du fémur est écart en raison de leur différence de croissance et de leur taux de remodelage [25]. Ces travaux montrent que, 32 jours après une unique injection intraveineuse de l’uranium, ce dernier n’est pas localisé dans la partie non-minéralisée de la plaque de croissance du fémur de rat [25], un lieu où se produit la croissance en longueur du fémur. Dans notre étude, aucune différence de longueur du fémur entre rats contaminés et non contaminés n’est observée (résultats du laboratoire non publiés). Par contre, nous observons une diminution du diamètre de l’os fémoral cortical qui pourrait être expliquée par le fait que la croissance radiale se produit directement dans le périoste. Le périoste est l’un des sites d’accumulation préférentielle de l’uranium, et il pourrait ainsi modifier ou perturber la croissance en largeur du fémur. En effet, cette croissance par apposition périostée détermine la taille du diamètre de l’os cortical au niveau de la diaphyse et est donc un facteur déterminant de la solidité de l’os [26].
En conclusion, cette étude décrit pour la première fois in vivo les effets d’une contamination chronique à de l’uranium naturel sur la micro-architecture et la qualité de l’os en utilisant un scanner d’une haute résolution. Cette technique a permis de mettre en évidence que l’uranium naturel ingéré à faibles concentrations de façon chronique via l’eau de boisson est susceptible d’affecter la croissance osseuse en largeur du fémur d’individus en croissance, sans cependant entraîner des pathologies osseuses. Néanmoins, ces résultats suggèrent qu’il est nécessaire de porter une attention particulière aux individus en croissance lors d’exposition chronique à ce radionucléide.
Remerciements et autres mentions
Nous remercions le Dr Laurence Vico et Norbert Laroche pour nous avoir facilité l’accès au microtomographe tridimensionnel (Scanco Viva CT 40).
Financement : ce travail s’inscrit dans le cadre du programme Envirhom financé par l’Institut de radioprotection et de sûreté nucléaire (IRSN) ; liens d’intérêts : les auteurs déclarent ne pas avoir de lien d’intérêt.
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International