e-VEGF-IMMUNO-actu
MENU« IMELDA » : capécitabine et bévacizumab ou bévacizumab seul chez les patientes atteintes de cancer du sein métastasé HER2 négatif ? Volume 10, numéro 3, Septembre-octobre 2015
Méthodes
Il s’agit d’une étude de phase III, ouverte, randomisée, effectuée dans 54 hôpitaux dans 10 pays (Brésil, Chine, Egypte, France, Hong Kong, Inde, Italie, Pologne, Espagne et Turquie). Les patientes incluses dans l’étude étaient atteintes de métastases et porteuses de tumeurs HER2-négatives. Chacune a reçu, en première ligne, 3 à 6 cycles de bévacizumab (15 mg/kg) et de docétaxel (75-100 mg/m2) toutes les 3 semaines. Les patientes sans progression étaient randomisées (1:1) et recevaient soit bévacizumab et capécitabine (1 000 mg/m2 deux fois par jour de J1 à J14 toutes les 3 semaines) soit bévacizumab seul (15 mg/kg) jusqu’à progression. Le retrait de l’AMM du docétaxel-bévacizumab a contraint à l’arrêt des inclusions, alors que 185 patientes seulement avaient été incluses, faisant perdre de la puissance statistique à l’étude. Des analyses de sous-groupes ont été faites : selon le statut des récepteurs des œstrogènes (positif ou négatif), la présence ou l’absence de métastases viscérales, la réponse au traitement (stable, répondeur ou non-mesurable), et la concentration de lactate déshydrogénase (inférieure ou supérieure à 1,5 fois les valeurs limites normales). L’étude était ouverte : les patients et les soignants connaissaient le traitement administré. Le critère d’évaluation principal était la survie sans progression à partir de la date de randomisation.
Résultats
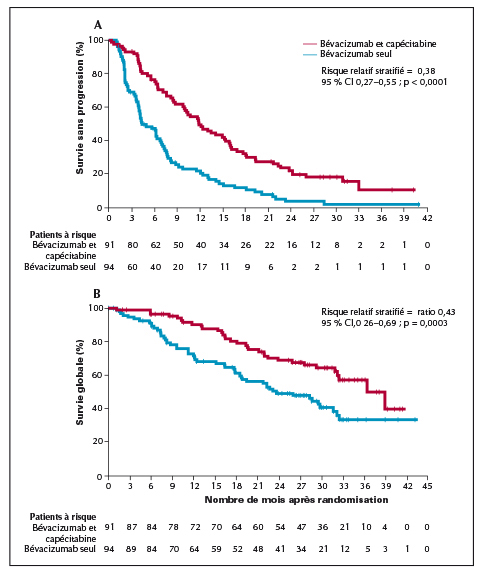
Entre juillet 2009 et mars 2011, parmi les 284 patientes qui avaient reçu le traitement initial bévacizumab et docétaxel, 185 (65 %) ont été incluses dans l’étude : 91 dans le bras bévacizumab et capécitabine et 94 dans le bras bévacizumab seul. L’étude a été interrompue avant son terme.
La survie sans progression était significativement plus longue dans le groupe bévacizumab et capécitabine que dans le groupe bévacizumab seul : médiane 11,9 mois (intervalle de confiance à 95 % : 9,8-15,4) vs. 4,3 mois (IC : 3,9-6,8).
Le rapport des risques (HR) stratifié était de 0,38 (IC à 95 % : 0,27-0,55, p < 0,0001), et la survie globale médiane de 39,0 mois (IC à 95 % : 32,3-non atteint) vs. 23,7 mois (18,5-31,7) dans groupe bévacizumab seul.
Le rapport des risques (HR) stratifié est de 0,43 (IC à 95 % : 0,26-0,69, p = 0,0003).
Les résultats du temps jusqu’à progression étaient cohérents avec ceux de la survie sans progression : 78 (86 %) des patientes du groupe bévacizumab et capécitabine et 72 (77 %) du groupe traité par bévacizumab seul présentaient une réponse objective. Un bénéfice clinique était constaté chez 92 (98 %) des patientes recevant bévacizumab seul et chez 90 (99 %) de celles recevant bévacizumab et capécitabine. Le score global de santé ne différait pas entre les deux groupes de patientes. Les effets secondaires les plus sérieux (grade 3 ou plus) ont été plus nombreux, pendant la phase de maintenance, dans le groupe bévacizumab et capécitabine que dans le groupe bévacizumab seul (45 patients [49 %] vs. 25 [27 %]). Les effets secondaires les plus fréquents ont été :
- syndrome main-pied : 28 (31 %) dans le groupe bévacizumab et capécitabine vs. 0 (aucun) dans le groupe bevacizumab seul ; - hypertension artérielle (8 [9 %] vs. 3 [3 %]) ; - protéinurie (3 [3 %] vs. 4 [4 %]).
Des effets secondaires graves ont été rapportés pour 10 (11 %) patientes du groupe bévacizumab et capécitabine et pour 7 (8 %) patientes du groupe bévacizumab seul.
Conclusion
Malgré l’interruption prématurée de l’étude et le manque d’informations sur la progression après traitement, la survie sans progression et la survie globale ont été significativement améliorées par un traitement en maintenance par bévacizumab et capécitabine par rapport au traitement par bévacizumab seul. Ces résultats permettront d’initier de nouvelles études de traitement de maintenance et de reconsidérer les stratégies de traitement en première ligne des cancers du sein métastasés HER2 négatifs.