Sang Thrombose Vaisseaux
MENULe microbiote intestinal et son implication dans la maladie cardiovasculaire Volume 30, numéro 1, Janvier-Février 2018
Illustrations
Les maladies cardiovasculaires restent la première cause de mortalité dans les pays développés. La diminution des événements cardiovasculaires passe notamment par la prise en charge des facteurs de risque, tels que le diabète ou l’hypertension artérielle (HTA), et nécessite une stratégie thérapeutique de plus en plus efficace et personnalisée. Longtemps considéré comme un simple symbiote du tube digestif sans rôle spécifique, mais du fait de son implication maintenant démontrée dans les maladies métaboliques et cardiovasculaires, un véritable engouement s’est développé dans l’étude de la composition du microbiote et de son rôle dans le métabolisme humain.
Rôle du microbiote intestinal et son interaction avec l’hôte
Le microbiote intestinal est composé de plus de 1014 micro-organismes, incluant des bactéries, des levures, des archées et des virus. Le microbiote intestinal bactérien comporte plus de 500 espèces et contient 100 fois plus de gènes que dans le génome humain. Les bactéries sont réparties en quatre phyla majeurs : Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria[1], avec une nette prédominance des Bacteroidetes et des Firmicutes. Ses fonctions sont multiples : métaboliques, immunitaires, protection contre l’émergence de pathogènes.
Le microbiote et les maladies cardiovasculaires
Le dogme que la maladie athéromateuse est principalement une maladie dégénérative est maintenant dominé par l’implication de divers phénomènes inflammatoires dans lesquels le rôle du microbiote n’est pas négligeable [2]. Cette inflammation chronique est notamment médiée par les Toll-like receptors (TLR) (récepteurs de l’immunité innée dédiés à l’identification des composants conservés des micro-organismes, notamment par les macrophages). L’activation de TLR4, récepteur spécifique du lipopolysaccharide (LPS), exerce des effets pro-inflammatoires et athérogènes. Chez l’homme, certains polymorphismes génétiques de TLR4 sont associés à une réduction du risque d’athérosclérose [3].
Toutefois, cette compréhension du lien entre le microbiote intestinal et les maladies cardiovasculaires était, jusqu’à il y a une quinzaine d’années, très limitée. En effet, les souris axéniques (sans microbiote) Apo E-/- ne sont pas protégées contre le développement de la maladie athéromateuse, suggérant d’abord que le microbiote intestinal n’est pas impliqué dans la physiopathologie athéromateuse. Les modifications du microbiote intestinal par la prise d’antibiotique n’ont pas non plus d’impact sur la mortalité des maladies cardiovasculaires. Ce n’est donc que récemment que d’autres études ont établi un véritable lien.
Une étude récente, descriptive, a montré que l’athérome carotidien sténosant est associé à des déséquilibres importants dans la composition du microbiote intestinal. Cette étude compare des sujets symptomatiques ayant subi un accident vasculaire cérébral (AVC) avec des sujets sains : une prédominance du genre Colinsella est décrite chez les sujets atteints d’une maladie cérébrovasculaire, et une prédominance du genre Roseburia et Eubacterium pour les sujets sains. Plus qu’une simple différence de composition, le microbiote des patients aux antécédents d’AVC synthétise des peptidoglycanes pro-inflammatoires et des acides gras libres oxydants tandis que le métabolite des sujets sains a un métabolisme à prédominance anti-inflammatoire et antioxydant [4].
La présence d’ADN de certaines bactéries, comme Chlamydia pneumoniae, dans les plaques a par ailleurs été bien démontrée [5]. Cette présence d’ADN bactérien au sein de l’athérome suggère leur rôle dans l’instabilité des plaques, donc dans le développement des maladies cardiovasculaires comme dans l’apparition d’événements.
Au-delà de la simple description d’association de telle augmentation ou baisse de bactéries entre sujets sains et témoins, arrivent aujourd’hui de véritables travaux mécanistiques : la modification de la composition du microbiote intestinal par certains antibiotiques (vancomycine) dans un modèle de rat réduit de 27 % les infarctus du myocarde (IDM) améliorant de 35 % la reperfusion myocardique. Ces résultats sont contemporains d’une diminution des taux de leptine et de métabolites produits durant le catabolisme des acides aminés aromatiques, entraînant une diminution de la taille de l’IDM. L’administration de probiotique de type Lactobacilles – i.e. « micro-organisme à potentiel bénéfique pour la santé » – montre également chez la souris un effet en termes de diminution de la taille de l’IDM, une amélioration de la fonction ventriculaire gauche et une réduction de l’hypertrophie ventriculaire [6]. De même, les études de transplantation fécale constituent des approches fonctionnelles élégantes, en vue de transmettre un phénotype pathologique par administration de selles de sujets malades, chez des animaux ou même des patients sains. Ainsi, chez la souris, a été démontrée la transmission du phénotype obèse. De même la transplantation de selles de patients coronariens augmente le développement des plaques athéromateuses aortiques chez la souris dans des modèles murins d’athérogenèse [7]. Cette athérogenèse est par ailleurs amplifiée par un régime riche en phosphatidylcholine [7]. D’autres études montrent que la transplantation fécale de donneurs maigres à des patients atteints de syndrome métabolique améliore la sensibilité à l’insuline de ces derniers [8]. Toutes ces études soulèvent la complexité de l’interaction hôte-microbiote et la difficulté d’intervenir de manière précise sur sa composition.
Le microbiote et ses métabolites
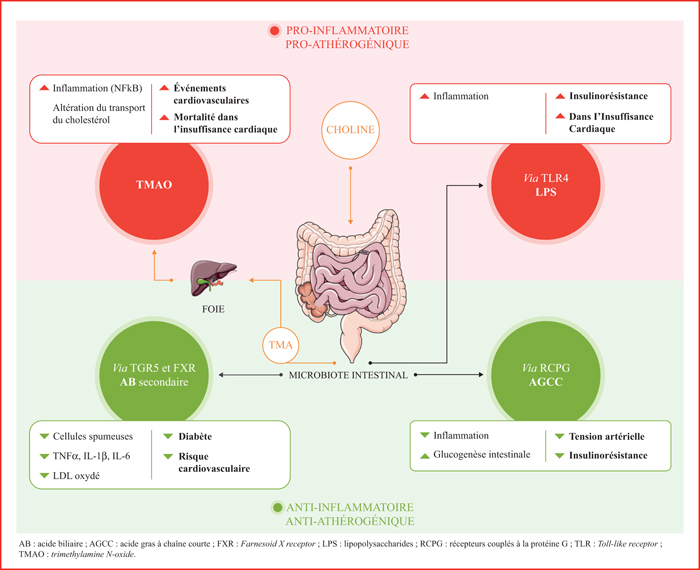
Cet engouement pour le microbiote intestinal et son lien avec la maladie cardiovasculaire a conduit à pousser plus loin son étude et à s’intéresser à ses métabolites potentiellement délétères ou protecteurs, et particulièrement au triméthylamine (TMA) ou triméthylamine N-oxyde (TMAO), aux acides biliaires et aux acides gras à chaîne courte (AGCC).
Le triméthylamine N-oxyde
Le TMAO est produit par le foie à partir de son précurseur, lui-même produit à partir de la phosphatidylcholine par le microbiote intestinal. La phosphatidylcholine est présente en abondance dans la viande rouge, les œufs et le fromage. Des études dans des modèles murins d’athérosclérose (souris Apo E-/-) montrent une corrélation entre le taux plasmatique de TMAO et la présence de plaques d’athérome. Un régime riche en choline accroît également la formation des cellules spumeuses et de l’expression du récepteur scavenger CD36. À l’inverse, après un traitement antibiotique détruisant le microbiote intestinal, la production de TMAO diminue ainsi que le développement de l’athérome [7]. Cette constatation chez la souris est également observée chez l’homme. De nombreuses études associent clairement le TMAO et les événements cardiovasculaires : les patients coronariens ayant un fort taux plasmatique de TMAO sont plus à risque de subir un nouvel événement cardiovasculaire [9].
Plus loin encore, non seulement les fortes concentrations circulantes de TMAO sont associées à une augmentation du risque d’événements et de la mortalité cardiovasculaire, mais il existe en plus une corrélation linéaire dose-dépendante du TMAO avec le risque de mortalité cardiovasculaire [10]. Les taux circulants de L-carnitine, impliqué dans le métabolisme du TMAO, sont également associés à la survenue d’accidents cardiovasculaires.
Les acides biliaires
Les acides biliaires ont longtemps été cantonnés à leur seul rôle de digestion et d’absorption des graisses, mais ils agissent comme de véritables hormones, à travers leurs deux récepteurs principaux : le Farnesoid X receptor (FXR, récepteur nucléaire) et le récepteur TGR5 (membranaire). Ils sont synthétisés par le foie à partir du cholestérol sous forme primaire (acides cholique [CA] et chénodésoxycholique [CDCA]) puis métabolisés en acides biliaires secondaires dans le tube digestif par le microbiote intestinal (acides désoxycholique [DCA] et lithocholique [LCA]). Dans les modèles murins d’athérome aortique (LDL-/- et ApoE-/-), la stimulation des deux récepteurs aux acides biliaires décrits ci-dessus protège contre le développement de l’athérome en agissant sur les macrophages de la plaque [11, 12]. Les souris doubles KO FXR-/- et ApoE-/- sont plus à risque de développer des plaques d’athérome, puisqu’on constate une augmentation de 50 % des plaques d’athérome aortique. Le récepteur FXR est capable de moduler l’inflammation en réduisant l’expression de cytokines pro-inflammatoires (IL-1β et IL-6). TGR5 semble également capable de moduler l’inflammation en diminuant la sécrétion de cytokines pro-inflammatoires par les macrophages et la charge de LDL oxydés dans les cellules spumeuses. In fine, on observe une réduction significative de la surface des plaques d’athérome chez les souris LDL-/- TGR5+/+.
Deux travaux ont été réalisés chez l’homme sur le microbiote et les acides biliaires par une équipe française cardiologique de l’hôpital Cochin comparant sujet coronarien et non coronarien. La première étude observe que la concentration du LCA, le plus puissant ligand naturel de TGR5, est significativement inférieure de 50 % chez les patients coronariens, ce qui représente un facteur prédictif de maladie coronaire [13]. La seconde étude montre une réduction homogène de 50 % de la concentration de toutes les classes d’acides biliaires chez les patients coronariens. La diminution du taux d’acides biliaires totaux est un facteur prédictif de maladie coronaire (OR = 0,51 ; IC 95 % = [0,31-0,85] ; p = 0,01).
Les acides gras à chaîne courte
Les principaux AGCC sont les acides acétiques, propioniques et butyriques, issus de la fermentation des fibres alimentaires par le microbiote intestinal. Les acides acétiques et propioniques sont produits par les Bacteroidetes tandis que l’acide butyrique est produit par les Firmicutes. Ils ont un rôle bénéfique sur le poids, l’homéostasie glucidique et la sensibilité à l’insuline. Les régimes alimentaires riches en AGCC diminuent l’insulinorésistance et augmentent la dépense énergétique et la fonction mitochondriale, permettant de réduire l’obésité. Les AGCC sont également des molécules « signal » et agissent à travers leurs récepteurs couplés à la protéine G : par l’inhibition de l’histone désacétylase sur les cellules endothéliales et les leucocytes, ils peuvent diminuer l’inflammation. Une étude a montré une augmentation de la dégradation des AGCC chez les patients atteints de maladies cardiovasculaires et une diminution de la synthèse de l’acide butyrique et propionique, augmentant l’état inflammatoire [14]. Il existe, pour le moment, peu d’études sur les AGCC dans la maladie cardiovasculaire mais un intérêt grandissant pour ces molécules conduit à des études de plus en plus nombreuses dans les maladies métaboliques et l’HTA.
Microbiote et facteurs de risque cardiovasculaire
Les facteurs de risque cardiovasculaire sont une cible privilégiée étant donné la réduction significative des événements en passant par leur prévention. Alors que le microbiote intestinal est très étudié dans la maladie cardiovasculaire elle-même, de nombreuses études portent également sur son association et son implication dans les différents facteurs de risque [15].
Microbiote et maladies métaboliques
Dans l’obésité, on observe chez l’enfant une altération de la composition du microbiote par restriction de sa biodiversité. La transplantation à des souris génétiquement identiques de microbiote de jumeaux humains, donc parfaitement identiques sur le plan génétique mais différents sur le plan phénotypique de l’obésité, montre que les souris transplantées avec les selles du jumeau « obèse » deviennent obèses, tandis que les souris transplantées avec les selles du jumeau « non obèse » restent minces [16].
Le diabète de type 2, le plus fréquent, est un désordre métabolique caractérisé par l’augmentation de la glycémie dans un contexte d’insulinorésistance. Il existe des prédispositions génétiques mais également une association forte avec l’obésité et la sédentarité. Néanmoins, on constate que le degré d’obésité varie chez les patients diabétiques de type 2. L’implication des facteurs environnementaux conduit à s’intéresser au microbiote intestinal dont les altérations structurelles et fonctionnelles ne sont pas négligeables [17]. On constate une prédominance de Proteobacteria, mais également une diminution de la production de certains AGCC et le développement de certains pathogènes opportunistes à l’origine d’un stress oxydatif et d’une inflammation étant donné que le microbiote est un réservoir naturel de LPS [18] pouvant conduire également à un excès de production d’IL-6, IL-1 et TNFα. Les acides biliaires secondaires et les AGCC sont également diminués dans le diabète de type 2 alors qu’ils sont connus protecteurs contre l’inflammation et l’insulinorésistance [19].
Hypertension artérielle
L’HTA est l’un des facteurs de risque majeurs qui affecte une large population de patients et qui reste à ce jour un véritable enjeu de santé publique et économique.
Il est observé chez la souris hypertendue une diminution de la richesse et de la diversité du microbiote, une augmentation du ratio Firmicutes/Bacteroidetes et une diminution de certains AGCC (acide butyrique et acétique). L’administration orale de minocycline, antibiotique de la famille des cyclines, restaure le ratio Firmicutes/Bacteroidetes et normalise la pression artérielle des rats hypertendus. Une autre approche fonctionnelle consiste à transplanter les selles de rats hypertendus sous régime hyperlipidique à des rats normotendus sous régime normal ; on observe alors une HTA chez les rats initialement normotendus. De nombreuses données impliquent le microbiote intestinal dans la régulation de la pression artérielle et son altération peut être associée à l’apparition d’une HTA donnant une piste supplémentaire dans la prise en charge de l’HTA [20].
Dyslipidémie
Étant donné le lien bien défini entre microbiote intestinal et maladies métaboliques, il est difficile encore d’affirmer que les perturbations du métabolisme lipidique ne soient pas juste une relation liée au hasard expliquée par les désordres métaboliques et la prise de poids plus que par une implication du microbiote lui-même. Toutefois, quelques études récentes suggèrent que le microbiote intestinal est directement impliqué dans le métabolisme lipidique via les acides biliaires [21] et le TMAO notamment [10].
Microbiote et insuffisance cardiaque
Malgré le développement des thérapeutiques dans l’insuffisance cardiaque, elle reste une pathologie grevée d’une haute mortalité et dont la prévalence ne cesse d’augmenter. L’insuffisance cardiaque entraîne une hypoxie, une modification de l’homéostasie de la barrière intestinale et une hypoperfusion de la muqueuse. Elle conduit à une altération de la barrière intestinale, à la translocation bactérienne et à l’augmentation du passage du LPS et de la virulence des bactéries pathogènes favorisant l’état inflammatoire chronique, créant un cercle vicieux. La composition du microbiote est également différente avec une augmentation de bactéries pathogènes telles que Campylobacter, Shigella, Salmonella et Yersinia et une diminution des bactéries du genre Collinsella. Tout comme dans la maladie athéromateuse, il est difficile de conclure à un microbiote « signature » dans l’insuffisance cardiaque étant donné les nombreux facteurs confondants possibles (alimentation, changement de traitement, etc.). Parmi les métabolites du microbiote intestinal, l’augmentation du taux plasmatique de TMAO est corrélée à une augmentation de la mortalité chez les patients insuffisants cardiaques, des taux de peptides natriurétiques et à la dysfonction diastolique [22]. Enfin, le microbiote intestinal pourrait également être capable de moduler la réponse au traitement : la digoxine peut être inactivée par un cytochrome de la bactérie Eggerthella lenta.
Approches thérapeutiques
Le régime alimentaire
Si le régime alimentaire modifie rapidement la composition du microbiote intestinal – un régime riche en fibre permettant par exemple d’accroître les bactéries commensales et d’augmenter la synthèse des AGCC ou un régime pauvre en lipide et riche en protéine permettant d’améliorer la richesse du microbiote [23] –, il reste cependant difficile d’établir un lien direct entre un régime alimentaire particulier et le métabolisme du microbiote.
Les prébiotiques, probiotiques et antibiotiques
Les prébiotiques sont des molécules qui visent à favoriser le développement d’espèces bactériennes bénéfiques préexistantes ou d’impacter favorablement certaines fonctions du microbiote intestinal. Les prébiotiques les plus connus sont les oligosaccharides et les polysaccharides, permettant le contrôle glycémique et lipidique. Par exemple, trois mois de régime avec de l’oligofructose sont associés à une perte de poids et une amélioration de la tolérance au glucose.
Les probiotiques sont des micro-organismes (levures ou bactéries) visant à améliorer l’équilibre du microbiote et à exercer un effet biologique thérapeutique. Par exemple, l’administration de Christensenella minuta permet de protéger les souris de l’obésité. Akkermansia muciniphila, une bactérie dégradant la mucine, est associée à un meilleur statut métabolique en particulier une diminution de la glycémie à jeun et une meilleure sensibilité à l’insuline.
Les antibiotiques vont détruire ou arrêter la croissance de certaines espèces bactériennes. Se pose le problème de la non-spécificité des antibiotiques envers une espèce bactérienne particulière, rendant leur usage difficile. Par exemple, les souris axéniques Apo E-/- nourries à un régime pauvre en graisse finissent tout de même par développer de l’athérosclérose, laissant penser qu’il est nécessaire de préserver les « bonnes bactéries ».
La transplantation fécale
La transplantation fécale vise à remplacer le microbiote préexistant par le microbiote d’un donneur. Des études démontrent que la transplantation fécale de microbiote de donneurs « minces » à des patients présentant un syndrome métabolique améliore leur sensibilité à l’insuline [8]. Chez l’homme, les selles de donneurs sains ont officiellement rejoint la pharmacopée humaine vu le résultat spectaculaire des transplantations fécales dans les infections digestives à Clostridium difficile, en étant bien plus efficaces que les antibiotiques. Cependant, il s’agit d’une indication bien précise et sur une pathologie aiguë : pour une maladie chronique comme la maladie athéromateuse, sans un rationnel plus puissant, la méthode est limitée par le risque de transmettre au receveur des endotoxines, des agents infectieux, le phénotype obèse ou même des maladies auto-immunes [24].
Conclusion
L’ensemble de tous les travaux précités conduit à « reconsidérer » la place du microbiote et à souligner son importance comme voie de recherche dans les maladies cardiovasculaires, et notamment l’athérome et l’insuffisance cardiaque. Si les altérations du microbiote sont associées au développement de la maladie cardiovasculaire [24], il est encore trop tôt pour déterminer la part de son effet.
Le microbiote intestinal est un domaine de recherche immense dont la connaissance de la composition, des fonctions et des interactions avec l’hôte est de plus en plus précise. De nombreuses études ont montré une association forte entre le microbiote intestinal, sa composition ou ses métabolites et la prévalence et l’incidence des maladies cardiovasculaires (figure 1). Il reste encore à élucider les mécanismes et les relations causales directes entre le microbiote intestinal, la maladie athéromateuse et l’insuffisance cardiaque afin d’établir de nouvelles stratégies thérapeutiques efficaces qui pourront encore diminuer l’incidence de ces maladies mortelles. La modulation de la composition du microbiote intestinal reste une approche séduisante dans la thérapeutique personnalisée des patients.
Liens d’intérêts
les auteurs déclarent ne pas avoir de lien d’intérêt.
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International