e-VEGF-IMMUNO-actu
MENUNécroptose des cellules endothéliales et extravasation des cellules tumorales Volume 12, numéro 1, Mars 2017
Le processus métastatique est complexe ; une étape initiale obligée de ce processus est le passage de cellules tumorales depuis la tumeur initiale vers le courant sanguin. Les cellules tumorales circulantes sont fragiles et ne survivent pas longtemps dans la circulation sanguine. Leur survie dépend de leur capacité à passer rapidement la barrière endothéliale pour s’implanter dans un milieu, ou microenvironnement, plus favorable.
Les auteurs de cet article publié dans Nature en août 2016 [1] travaillent au Max Planck Institute à Bad Nauheim. Il y a de grandes analogies entre l’extravasation des cellules tumorales et la migration trans-endothéliale des leucocytes [2]. Les auteurs ont disséqué les mécanismes moléculaires de l’extravasation des cellules tumorales et de leur passage transendothélial.
Les cellules tumorales induisent la mort programmée des cellules endothéliales auxquelles elles s’attachent. Ce phénomène est appelé « nécroptose ». L’apoptose et la nécroptose sont les deux formes principales de la mort cellulaire programmée [3]. La nécroptose obéit aux mêmes mécanismes de régulation que l’apoptose mais dépend également de la formation d’un nécrosome constitué de RIPK1 et de RIPK3 (receptor-interacting serine/threonine protein kinases 1 et 3) qui active la MLKL (mixed lineage kinase-domain-like pseudokinase) et initie le programme spécifique de la nécroptose. Ce dernier dépend également de l’expression ou de l’activité de la caspase 8, elle-même médiateur de l’apoptose [4]. Une expression augmentée de caspase 8 active la nécroptose.
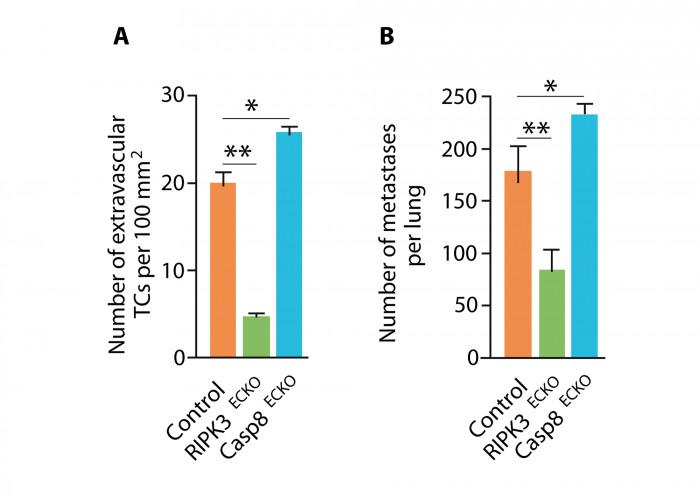
Le blocage pharmacologique de la nécroptose par la nécrostatine-1, inhibiteur spécifique de RIPK1, ou la délétion ciblée dans les cellules endothéliales de RIPK3, limite in vitro la nécroptose endothéliale induite par les cellules tumorales et, in vivo, diminue l’extravasation de ces cellules et la taille des métastases. À l’inverse, l’inhibition pharmacologique des caspases ou la délétion spécifique dans l’endothélium de la caspase 8 accélère et augmente nécroptose, extravasation et métastase (figure 1).
Un élément intéressant des mécanismes mis en jeu a été étudié in vitro. La nécroptose endothéliale préalable à l’extravasation des cellules tumorales nécessite, au début du processus, la présence du précurseur de la protéine amyloïde (APP : amyloid precursor protein) exprimée par la cellule tumorale et de son récepteur DR6 (death receptor 6) par les cellules endothéliales. Les auteurs proposent donc de cibler la voie la nécroptose endothéliale et, en particulier, le récepteur endothélial DR6 pour bloquer le processus métastatique.
Les auteurs ont d’abord observé que dans les co-cultures de cellules endothéliales et de cellules tumorales, le nombre de cellules endothéliales mortes est anormalement élevé. Ces cellules ne présentent pas les caractéristiques habituelles des cellules en apoptose (condensation et fragmentation du noyau, réaction avec l’annexine V). Les cellules endothéliales mortes présentent des noyaux « nécroptiques », avec un marquage caractéristique (EthD-III) indiquant des altérations de la membrane nucléaire.
In vivo, l’injection intraveineuse de cellules tumorales (mélanome ou carcinome pulmonaire) chez des souris témoins est suivie, après quelques heures (6), par un marquage positif EthD-III des cellules endothéliales pulmonaires, indiquant un processus nécroptique activé. Ces cellules EthD-III positives ne présentaient aucune condensation de chromatine ni de fragmentation du noyau. La nécroptose des cellules endothéliales induite par les cellules tumorales n’était pas liée à l’occlusion des capillaires pulmonaires par les cellules tumorales. L’injection de microsphères occlusives (15 µm) ne produit en effet pas de nécroptose.
Le nombre de cellules en nécroptose est diminué, après l’injection de cellules tumorales, chez les souris dont les cellules endothéliales sont déficientes en RIPK3. De plus, le nombre de cellules tumorales ayant traversé l’endothélium et le nombre de métastases sont également diminués dans ce modèle. Les mêmes résultats ont été observés après inhibition pharmacologique de RIPK3. À l’inverse, chez les souris KO pour la caspase 8 (protéine essentielle dans le processus apoptotique), on observe une augmentation du nombre de cellules endothéliales nécroptiques, du nombre de cellules tumorales extravasculaires et du nombre de métastases pulmonaires (figure 1).
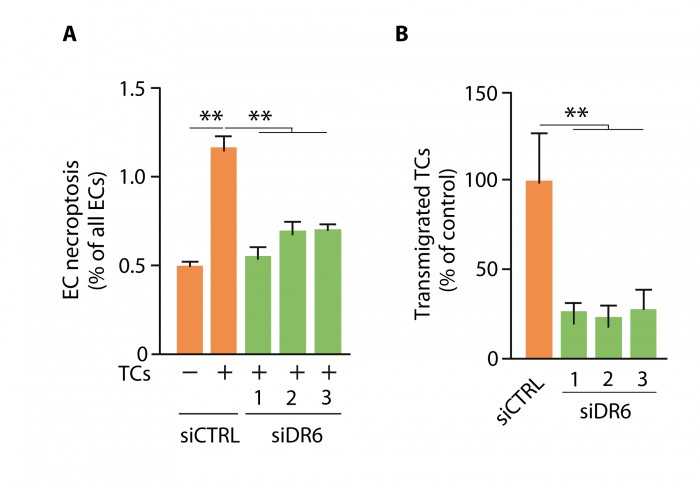
Pour identifier le récepteur endothélial responsable de la nécroptose endothéliale induite par les cellules tumorales, les auteurs ont bloqué, par si-RNA 32, plusieurs gènes candidats. Le knockdown de DR6 (également connu sous le nom de tumor necrosis factor receptor superfamily 21 ou TNFRSF21) dans les cellules endothéliales réduit la nécroptose induite par les cellules tumorales ainsi que la migration trans-endothéliale de ces cellules (figure 2).
Le récepteur DR6, de la famille des récepteurs du TNF, est exprimé par les cellules endothéliales. Chez les souris KO pour DR6 ou après blocage de ce récepteur par un anticorps anti-DR6, on observe, in vivo, une diminution des métastases et, in vitro, une diminution de la migration transendothéliale des cellules tumorales et une diminution de la nécroptose endothéliale.
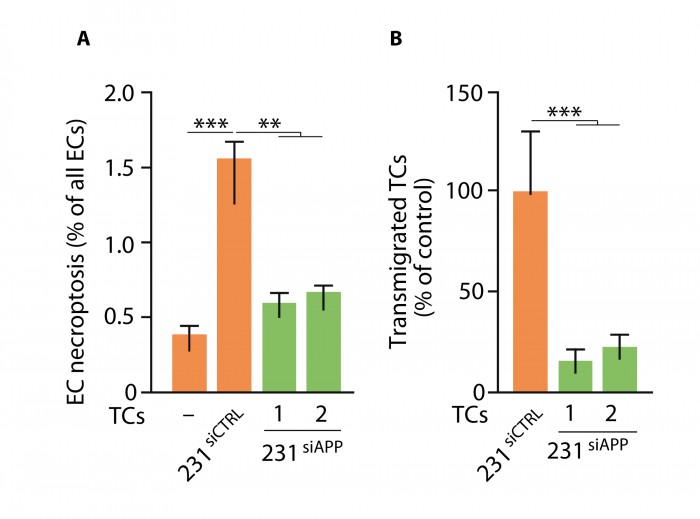
Pour terminer cette belle histoire, la protéine précurseur de la β-amyloïde (APP), à l'origine de la formation des plaques amyloïdes que l'on retrouve dans le cerveau des patients atteints de la maladie d’Alzheimer, est un ligand identifié de DR6. APP est très largement exprimée par de nombreuses cellules tumorales [5, 6, 7]. En cohérence avec tout ce qui précède, l’inhibition de l’expression d’APP par les cellules tumorales en culture réduit considérablement leurs capacités à induire la nécroptose des cellules endothéliales et à traverser la barrière endothéliale. Les cellules tumorales n’exprimant pas APP ont pourtant une survie, une prolifération et une migration normales. Seules leurs propriétés de transmigration à travers une monocouche de cellules endothéliales sont affectées par l’inhibition de l’expression d’APP par les cellules tumorales (figure 3).
Ces mêmes cellules tumorales n’exprimant pas APP, injectées in vivo, ont pratiquement perdu leurs capacités de sortir du secteur sanguin et donc d’induire des métastases. On sait par ailleurs que, dans des études épidémiologiques, une forte expression d’APP par les cellules tumorales est un facteur pronostique péjoratif [5, 6, 7].
En résumé et conclusion
La nécroptose endothéliale est un processus de mort cellulaire particulier qui est un préalable à l’extravasation des cellules tumorales. Ce travail important montre que les cellules tumorales induisent une nécroptose endothéliale par l’intermédiaire d’APP (protéine précurseur de la protéine amyloïde), exprimé par les cellules tumorales et de son récepteur endothélial DR6 (death receptor 6). Cette étape est essentielle pour l’extravasation des cellules tumorales et l’initiation des métastases. Le blocage de cette voie, APP-DR6, pourrait être une nouvelle approche intéressante de la prévention et du traitement de certaines métastases.
Liens d’intérêts : L’auteur déclare ne pas avoir de lien d’intérêt en rapport avec cet article.