Innovations & Thérapeutiques en Oncologie
MENUImmunothérapie anti-SIRPα/CD47 en oncologie Volume 4, numéro 5-6, Septembre-Décembre 2018
22, boulevard Benoni Goullin
44200 Nantes
France
- Mots-clés : immunothérapie, cellules dendritiques, macrophages, CD47, SIRPα
- DOI : 10.1684/ito.2018.0139
- Page(s) : 229-34
- Année de parution : 2018
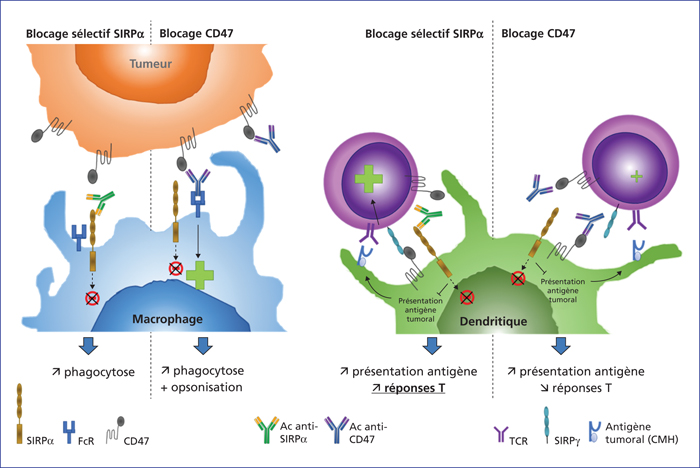
Le succès des traitements d’immunothérapie ciblant des points de contrôle de l’immunité adaptative, en particulier exprimés par des lymphocytes T (PD-1, PD-L1, CTLA-4), a permis l’émergence et l’utilisation en routine clinique de nouveaux traitements chez les patients atteints de cancer au stade avancé. Bien que ces nouveaux traitements aient montré des résultats d’efficacité impressionnants chez certains groupes de patients, la majorité de ces patients restent non-répondeurs à long terme et l’efficacité est variable voire absente selon le type de tumeur. Les cellules de l’immunité innée, en particulier les cellules myéloïdes, ont aussi un rôle primordial dans notre système immunitaire et leur accumulation en périphérie et/ou dans la tumeur a été identifiée comme un des mécanismes immunologiques importants de résistance aux traitements. SIRPα est un point de contrôle des cellules myéloïdes identifié initialement comme régulant la phagocytose des macrophages et la présentation d’antigènes par les cellules dendritiques. Les cellules myéloïdes suppressives (TAM/MDSC) exprimant SIRPα jouent un rôle crucial dans l’immunosuppression du micro-environnement tumoral inhibant la réactivité antitumorale des cellules T et des cellules NK. La surexpression du ligand de SIRPα, CD47, par les cellules tumorales est corrélée à un mauvais pronostic clinique. Cet article reprend les principales connaissances fondamentales de la biologie de l’interaction SIRPα/CD47 et décrit les diverses stratégies thérapeutiques en cours de développement clinique pour bloquer cet axe inhibiteur en oncologie.
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International