L'Information Psychiatrique
MENULa prescription hors autorisation de mise sur le marché (hors AMM) en pédopsychiatrie Volume 94, numéro 2, Février 2018
En France, au 1er janvier 2017, les moins de 18 ans représentent 21,9 % de la population [1], parmi lesquels 12 % seraient atteints d’un trouble mental [2]. En effet, 5 % des enfants souffrent de troubles anxieux, et 1 à 2 % sont hyperactifs. Chez les adolescents de 13 à 19 ans, 3 % présentent des troubles de l’humeur. Quant à l’autisme et à la schizophrénie, il s’agit de maladies plus rares, qui touchent moins de 1 % des enfants et des adolescents [2]. La difficulté du diagnostic dans cette population tend néanmoins à diminuer les statistiques observées. Concernant la prescription médicamenteuse, celle-ci n’est nécessaire que lorsque les patients présentent une grande souffrance psychique et des symptômes perturbant gravement leurs interactions sociales, pour lesquels des soins psychothérapeutiques seuls ne permettent pas d’apporter un apaisement [3]. Dans ce cas, le manque de recherches et d’études menées dans cette population très hétérogène lors du développement des médicaments, souvent pour des raisons éthiques, financières ou des difficultés techniques, engendre pour de nombreuses spécialités pharmaceutiques une absence d’indications officielles, de recommandations posologiques ou une absence de recul sur la tolérance. En 2006, 50 à 90 % des médicaments utilisés en pédiatrie n’étaient ni étudiés, ni évalués chez l’enfant [4]. En conséquence, la prescription hors AMM s’observe régulièrement chez les enfants, de l’ordre de 40 % en pratique de ville [5], de 67 % et jusqu’à 94 % à l’hôpital [6]. Une étude de 2008 observe au sein d’un hôpital pédiatrique 68 % des prescriptions de médicaments psychotropes hors AMM [7]. Cette pratique se heurte à des problèmes de responsabilité pour les acteurs impliqués et de prise en charge pour les patients (non-remboursement). De plus, le médecin doit prescrire tout en sachant qu’il n’est pas possible d’extrapoler les données disponibles chez les adultes à la population pédiatrique, du fait des particularités physiologiques qui impactent les paramètres pharmacocinétiques des médicaments ainsi que la réponse et la tolérance au traitement.
Limites d’une AMM et prescription d’un médicament hors AMM
Pour être commercialisé en France, tout médicament fabriqué industriellement doit faire l’objet d’une AMM. Celle-ci peut être délivrée par l’Agence nationale de sécurité du médicament (ANSM) ou par la Commission européenne, après avis de l’Agence européenne des médicaments (European Medicines Agency, EMA), lors d’une procédure centralisée.
L’AMM valide l’autorisation d’utilisation d’un médicament qui a fait ses preuves en termes d’efficacité et d’innocuité, sur la base d’études scientifiques rigoureuses. Une AMM est délivrée pour une présentation galénique, dans une ou plusieurs indications, avec un schéma posologique et dans certains cas une durée d’utilisation, pour une ou plusieurs populations de patients. Dès lors qu’une des modalités de l’AMM n’est pas respectée, la prescription est dite hors AMM.Citons, par exemple [8] :
- –l’halopéridol (Haldol) 2 mg/ml solution buvable est autorisé dans les troubles graves du comportement chez l’enfant tandis que les comprimés d’halopéridol 1 et 5 mg sont réservés à l’adulte ;
- –la rispéridone (Risperdal) n’est pas recommandée chez les enfants de moins de 5 ans, car il n’existe pas de données disponibles dans cette population. À partir de 5 ans, elle est indiquée dans le traitement symptomatique de courte durée (jusqu’à 6 semaines) de l’agressivité persistante dans le trouble des conduites chez les enfants et adolescents présentant un fonctionnement intellectuel inférieur à la moyenne ou un retard mental diagnostiqués conformément aux critères du DSM-IV.
Encadrement des prescriptions hors AMM
En France, la prescription hors AMM est légale mais de plus en plus encadrée, notamment depuis l’affaire du Médiator et la loi n̊ 2011-2012 du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé [9]. Si le praticien bénéficie d’une liberté de prescription, celle-ci trouve sa limite dans l’obligation qui lui est faite de ne pas faire courir de risques à ses patients [10]. Pour certaines spécialités pharmaceutiques, un encadrement juridique est prévu hors du cadre de leurs AMM : ce sont les autorisations temporaires d’utilisation (ATU) et les recommandations temporaires d’utilisation (RTU).
Autorisation temporaire d’utilisation (ATU)
L’ATU, mesure effective depuis 1994 [11], est une procédure exceptionnelle et dérogatoire, permettant l’accès à des médicaments n’ayant pas d’AMM en France et pour lesquels aucune alternative thérapeutique n’est disponible. Elle est délivrée par l’ANSM dans les conditions suivantes :
- –la spécialité concernée est destinée à traiter, prévenir ou diagnostiquer une maladie grave ou rare ;
- –il n’existe pas d’autre traitement approprié ;
- –son efficacité et sa sécurité d’emploi sont supposées en l’état des connaissances scientifiques.
ATU nominative
L’ATU nominative est délivrée pour un seul malade nommément désigné, sous la responsabilité du médecin prescripteur qui en fait la demande à l’ANSM via un formulaire spécifique (Cerfa) [12] en justifiant la prescription (arguments cliniques). Celle-ci est délivrée pour une durée fixée et renouvelable après justification. Au 1er janvier 2017, 2 spécialités sont disponibles en France dans le cadre d’une ATU nominative dans le trouble déficitaire avec hyperactivité (TDAH) chez l’enfant de plus de 6 ans : l’atomoxétine (Strattera) et le dexamphétamine sulfate (Dexamine), ce dernier répondant à la législation des stupéfiants [13].
ATU de cohorte
L’ATU de cohorte concerne quant à elle un groupe ou sous-groupe de patients, traités et surveillés suivant des critères parfaitement définis dans un protocole d’utilisation thérapeutique (PUT) et de recueil d’informations. L’ATU de cohorte est délivrée à la demande du titulaire des droits d’exploitation pour un an renouvelable, ce dernier s’engageant à déposer une demande d’AMM dans un délai fixé.
Les médicaments faisant l’objet d’une ATU sont dispensés par la pharmacie à usage intérieur (PUI) au sein d’un établissement de santé et sont pris en charge à 100 % pour le patient désigné et pendant la validité de l’ATU.
Recommandation temporaire d’utilisation (RTU)
La RTU est née de la loi du 29 décembre 2011 [9]. Les conditions d’élaboration sont précisées par le décret n̊ 2012-742 du 9 mai 2012 [14]. La RTU est une procédure dérogatoire exceptionnelle, élaborée par l’ANSM, permettant l’utilisation d’une spécialité ayant une AMM mais utilisée dans une indication ou dans des conditions d’utilisation non conforme(s) à cette AMM (précisées par la RTU). Celle-ci est fixée pour une durée limitée à 3 ans renouvelable. La RTU permet de répondre à un besoin thérapeutique dès lors que le rapport bénéfice/risque du médicament est présumé favorable. Elle s’accompagne obligatoirement d’un suivi des patients traités dans l’indication considérée. Les médecins qui prescrivent une RTU participent à l’alimentation d’une base de données-patients, constituant ainsi un levier pour améliorer la connaissance du médicament dans l’indication considérée et sécuriser son utilisation.
Au 1er janvier 2017, 13 RTU sont validées, dont 1 en psychiatrie pédiatrique [15]. Celle-ci concerne la formulation à libération prolongée de mélatonine 2 mg (Circadin). L’AMM du Circadin est le traitement à court terme de l’insomnie primaire caractérisée par un sommeil de mauvaise qualité chez des patients de 55 ans ou plus. Depuis le 1er octobre 2015, une RTU autorise la prescription de cette spécialité dans le traitement du trouble du rythme veille-sommeil chez les enfants de 6 à 18 ans présentant certains handicaps neurodéveloppementaux ou psychiatriques. La posologie recommandée par la RTU est de 4 à 6 mg/jour après titration progressive [16]. Dans cette indication, Circadin est pris en charge par l’Assurance maladie pour une durée de 3 ans et dans la limite de la base forfaitaire annuelle (montant maximal annuel de 800 euros par patient). La prescription doit porter la mention « prescription sous RTU » [17]. Un 1er rapport de l’ANSM après 9 mois d’existence de la RTU mentionne une inclusion pour seulement 9 enfants, dont 7 dans le cadre de troubles autistiques. Les données de suivi n’étant disponibles que pour 4 patients, les conclusions concernant l’efficacité et la tolérance sont limitées [18].
La prescription d’une ATU ou d’une RTU doit s’accompagner d’une information complète du patient sur l’absence d’alternative thérapeutique, les risques encourus, les contraintes et bénéfices potentiels, mais aussi les modalités de mise à disposition du médicament (dispensation à l’hôpital et/ou en ville) et de prise en charge par l’Assurance maladie. Le prescripteur s’engage également à déclarer à l’ANSM les effets indésirables éventuels.
Prescription hors AMM et hors d’un cadre réglementaire
Les ATU et les RTU concernant peu de spécialités de psychiatrie infantile, le médecin est régulièrement contraint de prescrire hors de ces procédures encadrées. La décision peut être prise lorsque la pathologie diagnostiquée ne peut être traitée grâce à l’arsenal thérapeutique disponible, lors de l’apparition d’effets indésirables ou d’une inefficacité thérapeutique contraignant à un switch.
Justification d’une prescription hors AMM
Lors de la prescription d’une spécialité hors de son AMM, le médecin doit justifier que :
- –le traitement est reconnu comme efficace et non dangereux par la communauté médicale au vu de la littérature scientifique ;
- –son indication est « indispensable » au regard de l’état du patient, de sa demande et des connaissances scientifiques du moment.
Pour s’informer et ainsi s’assurer de la pertinence et l’efficience de la prise en charge du patient, le prescripteur peut notamment s’aider des pratiques en cours dans d’autres pays. En effet, non seulement un médicament peut ne pas être commercialisé dans tous les pays, mais les AMM peuvent également être différentes selon les pays. C’est le cas par exemple de la clonidine, existant aux USA sous forme d’un comprimé à libération immédiate dosé à 0,1 ou 0,2 mg (Kapvay), ayant une AMM dans le TDAH chez l’enfant de 6 à 17 ans [19]. Un autre exemple peut être celui de l’aripiprazole (Abilify) par voie orale, comme le montre le tableau 1.
Ainsi, la prise en charge thérapeutique des patients sera différente selon le pays, de par les médicaments disponibles et la réglementation qui les encadre.
Prescription hors AMM en pratique
Résumé des caractéristiques du produit (RCP)
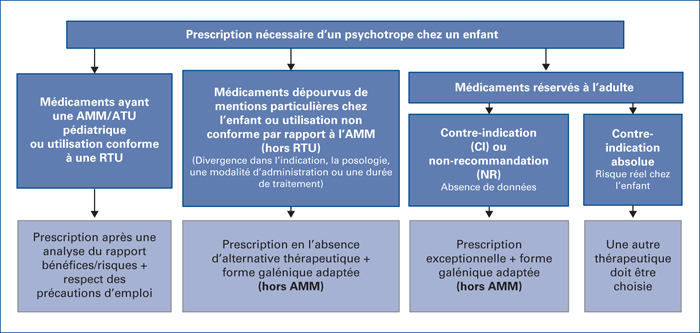
Le RCP d’un médicament est un ensemble d’informations destiné aux professionnels de santé et constituant une des annexes de la décision d’AMM. Les RCP sont consultables sur le site de l’ANSM. À partir de ces RCP, les recommandations de prescription suivantes peuvent être faites (figure 1).
Utilisation d’une forme galénique adaptée à l’administration
Aucune forme sèche n’est recommandée avant l’âge de 6 ans (risque de fausse route). À noter que le fait d’écraser un médicament ou d’ouvrir une gélule peut être une pratique hors AMM si les modalités ne sont pas précisées dans le RCP de la spécialité pharmaceutique (possibilité de modifier la biodisponibilité du principe actif voire d’entraîner une toxicité) [24]. Dans certains cas, la pharmacie peut préparer des gélules pour une administration chez l’enfant de moins de 6 ans (ouverture des gélules) ou pour l’administration de faibles doses.
Le plus souvent, la forme la plus adaptée est une solution buvable. Attention cependant aux solutions buvables alcoolisées (tableau 2) : le taux d’alcool présent par dose (dose définie pour chaque spécialité dans son RCP) et son caractère notoire selon le taux constaté est mentionné dans le RCP. Un taux > 100 mg d’alcool par dose est retenu comme seuil potentiellement inapproprié pour les enfants de moins de 12 ans. Cependant, les solutions buvables potentiellement utilisables en pédiatrie et contenant de l’alcool éthylique – excipient utilisé comme solvant et favorisant la conservation de la solution en évitant par exemple le développement des micro-organismes – gardent un rapport bénéfice/risque favorable, d’où les AMM accordées à ces spécialités, parfois même chez le petit enfant.
Il faudra donc juger de la quantité d’alcool apportée lors de la prescription d’une de ces spécialités à un enfant. D’autres excipients sont déconseillés chez le jeune enfant, comme l’huile d’arachide ou de ricin. Si la solution buvable reste néanmoins le plus souvent la galénique la plus adaptée, la pipette fournie avec une spécialité ne doit pas être utilisée pour l’administration d’une autre spécialité. En effet, les graduations peuvent ne pas correspondre à une même quantité de principe actif. Pour sensibiliser à l’importance des bonnes pratiques d’administration et éviter les erreurs graves d’administration, l’ANSM a publié en 2013 une affiche, intitulée « Ne vous mélangez pas les pipettes ! » reprenant les principes essentiels à une bonne pratique infirmière [25].
Adaptation de la posologie en fonction de l’âge et du poids
L’enfant n’est pas un adulte miniature. Extrapoler une donnée de l’adulte à l’enfant est difficilement réalisable car la pharmacocinétique des médicaments chez l’enfant est modifiée (volume de distribution ou clairance modifiés…). Ainsi, il n’est pas rare de voir des posologies supérieures à celles de l’adulte chez le jeune enfant du fait d’une clairance plus élevée. De même, ne tenir compte que du poids sans prendre en compte les différences de répartition masse grasse/masse maigre selon l’âge de l’enfant, peut entraîner un risque de sur ou sous dosage. Les spécialités dont la posologie est exprimée en unité/kg sont à privilégier.
Évaluation de la tolérance du médicament
Les études portant sur la tolérance des médicaments chez l’enfant ne montrent pas une incidence différente comparée à l’adulte [26]. Cependant, certains effets indésirables sont spécifiques ou plus sévères chez l’enfant. Par exemple, le RCP de l’olanzapine (Zyprexa) précise : « L’utilisation de l’olanzapine chez les enfants et les adolescents âgés de moins de 18 ans n’est pas recommandée du fait du manque de données sur la sécurité d’emploi et l’efficacité. Une prise de poids, des anomalies lipidiques et des taux de prolactine ont été rapportés avec une ampleur plus élevée dans les études à court terme chez les patients adolescents comparativement aux études chez les patients adultes » [8]. L’utilisation de polythérapies est également à éviter, car elles majorent le risque de provoquer un effet indésirable. Rappelons que toute suspicion d’apparition d’un effet indésirable, que l’utilisation du médicament soit faite conformément à l’AMM ou non, doit être signalée par le prescripteur, soit directement au Centre régional de pharmacovigilance (CRPV) dont il dépend, soit par le biais du correspondant local de pharmacovigilance dans le cas d’un suivi hospitalier du patient [27].
Clarté de l’ordonnance et information du patient
Le médecin doit préciser la mention « hors AMM » sur l’ordonnance, engageant ainsi sa responsabilité (loi du 29 décembre 2011) [9]. Par ailleurs, l’explicitation de la posologie prescrite est très importante, l’enfant étant particulièrement exposé à l’erreur d’administration. En effet, les erreurs d’un facteur 10 ou 100 ne sont pas exceptionnelles. Enfin, une information claire, portant sur la non-conformité par rapport à l’AMM, les risques encourus, l’absence d’alternative appropriée, et les contraintes et bénéfices potentiels doit être apportée au patient et à sa famille. L’information donnée doit être écrite et signée par le(s) parent(s) ou toute autre personne responsable du mineur concerné. Pour exemple, l’ANSM a publié en juin 2016 une note d’information concernant le tramadol en solution buvable (Contramal, Topalgic), pour lequel un grand nombre de signalements graves d’erreurs médicamenteuses a été observé chez l’enfant. Il a été rappelé l’importance de la clarté de la prescription et de l’explication donnée aux parents, ainsi que la nécessité de vérifier la bonne compréhension de ces derniers, afin de limiter les erreurs [25].
Prise en charge par l’Assurance maladie
En dehors de certains dispositifs dérogatoires (RTU), les médicaments prescrits hors AMM sont théoriquement non pris en charge par l’Assurance maladie.
Rôle des autorités de santé et des firmes pharmaceutiques
Dans l’objectif d’une diffusion large des bonnes pratiques de prescription, les autorités de santé européennes s’engagent largement à la diffusion d’alertes, reprenant notamment les risques d’une utilisation hors AMM des médicaments ou mettant en garde sur la tolérance des médicaments chez l’enfant. Par ailleurs, la loi du 29 décembre 2011 [9] énonce les charges opposables aux laboratoires, qui doivent contribuer au bon usage des médicaments qu’ils commercialisent en veillant à ce qu’ils soient prescrits conformément à leur autorisation (AMM, ATU ou RTU). Les firmes ont ainsi l’obligation de colliger toutes les informations via les prescripteurs et informer l’ANSM lorsqu’ils constatent des utilisations non conformes au bon usage de leurs spécialités.
Ainsi, en France, l’ANSM, conjointement avec les laboratoires exploitants, publie régulièrement des « Points d’informations » et des « Lettres aux professionnels de santé ». En 2016, quatre informations en rapport avec la psychiatrie ont été publiées sur le site de l’ANSM (tableau 3).
Règlement pédiatrique européen
Entré en vigueur le 26 janvier 2007, le Règlement pédiatrique européen [28] est opposable à tous les pays composant l’Union européenne (UE). Celui-ci a pour objectif de stimuler la recherche et faciliter la mise à disposition des médicaments en pédiatrie. Ce règlement, basé sur un système d’obligations-incitations, s’applique à tous les médicaments potentiellement utilisables en pédiatrie, qu’ils soient en cours de développement ou déjà autorisés, y compris ceux n’étant plus couverts par un brevet [29]. Ainsi, les firmes pharmaceutiques sont dorénavant dans l’obligation de déposer un plan d’investigation pédiatrique (PIP) auprès du Comité européen pédiatrique (Paediatric Committee ou PDCO), comité créé spécifiquement en 2007. Ce dossier est obligatoire :
- –avant toute nouvelle demande d’AMM ou demande de modification d’AMM pour une spécialité pharmaceutique ;
- –dans le cadre d’une demande de PUMA (Paediatric Use Marketing Autorisation), c’est-à-dire une demande d’AMM en vue d’un usage pédiatrique, concernant les substances actives qui ne sont plus sous brevet mais largement administrées chez l’adulte.
Une dérogation est possible pour certaines classes thérapeutiques de médicaments ou certaines indications couvrant une pathologie inexistante chez l’enfant. La dérogation peut ne concerner qu’une sous-population pédiatrique. Le laboratoire doit détailler le programme de développement envisagé pour fournir des données visant à démontrer la qualité, la sécurité et l’efficacité du médicament dans les différentes catégories d’âge pédiatrique. Il doit aussi spécifier les mesures envisagées pour adapter la formulation du produit en vue d’améliorer son usage dans les différents sous-groupes d’âge. Le règlement précise que les essais cliniques envisagés doivent être de qualité, sans soumettre la population pédiatrique à des essais cliniques inutiles et sans retarder les AMM pour l’adulte [29].
La Commission européenne publie au moins une fois par an, sur la base d’un rapport de l’EMA, une liste des laboratoires et des spécialités qui ont bénéficié d’une récompense ou d’une incitation, dans le cadre d’un dépôt de PIP. Les récompenses peuvent être une extension de brevet ou une durée de protection des données allongée, interdisant par exemple la possibilité de « génériquer » une spécialité. La liste des dérogations et PIP en cours, réactualisée régulièrement, est également disponible sur le site Internet de l’EMA [30].
De plus, dans un objectif d’accès du public à l’information, la liste des essais cliniques en cours inclus dans des PIP menés dans les pays tiers et la liste des médicaments autorisés en pédiatrie en Europe sont consultables sur internet via les bases respectives Eudract et Eudrapharm [31, 32].
Enfin, le règlement pédiatrique contribue également à la réactualisation des recommandations de bon usage, l’encadrement de la recherche ou encore la collaboration entre autorités réglementaires.
Un premier bilan après cinq ans d’existence du règlement européen montrait en 2012 une augmentation des études cliniques réalisées chez l’enfant et 1600 PIP déposés. D’un point de vue des bonnes pratiques de prescription, 13 nouvelles AMM avec indications pédiatriques ont vu le jour, 30 nouvelles indications pour des médicaments ayant déjà une AMM et neuf nouvelles formes pharmaceutiques adaptées à la pédiatrie. À noter, seulement 2 % des PIP déposés en cinq ans concernaient la psychiatrie [33]. Pour exemple, l’extension d’indication de l’aripiprazole (Abilify) dans la schizophrénie à partir de 15 ans et l’ajout dans les RCP des résultats des études réalisées dans l’autisme.
Conclusion
Le pédopsychiatre qui juge nécessaire la prescription d’un médicament hors du cadre de son AMM n’est pas dans l’illégalité de ses fonctions. Cependant, sa prescription doit répondre aux recommandations suivantes :
- –s’assurer qu’il n’existe pas de solution alternative parmi des molécules qui ont une AMM, une ATU ou une RTU dans l’indication traitée ;
- –être en mesure de justifier son choix de manière argumentée (études publiées, conférence de consensus, avis d’experts…) ;
- –écarter tout produit contre-indiqué chez l’enfant ou l’adolescent pour un motif de tolérance ;
- –prendre le temps nécessaire pour informer soigneusement les parents et l’enfant de ce choix ;
- –obtenir le consentement éclairé du patient et/ou des parents ;
- –tracer l’information donnée et la faire signer par les parents ou le représentant légal de l’enfant ;
- –rédiger une ordonnance claire et indiquer la mention « hors AMM ».
- –Évaluer régulièrement l’efficacité du traitement et réévaluer la balance bénéfice/risque.
Le renforcement de l’obligation d’évaluation des médicaments utilisés chez l’enfant, notamment grâce au règlement pédiatrique européen, devrait permettre à l’avenir l’augmentation de la sécurité d’emploi pour les patients et la sécurité d’exercice pour le praticien.
Liens d’intérêts
l’auteur déclare ne pas avoir de lien d’intérêt en rapport avec cet article.
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International