Hématologie
MENUTraitement personnalisé dans l’hémophilie Volume 26, numéro 3, Mai-Juin 2020
L’hémophilie est une maladie hémorragique liée à un déficit constitutionnel en facteur VIII (hémophilie A) ou en facteur IX (hémophilie B). Il n’existe pas, actuellement, de traitement curatif, mais la prise en charge de l’hémophilie a énormément évolué au cours des dix dernières années avec le développement de molécules améliorées et de nouvelles thérapeutiques. Depuis les années 1960, date à laquelle a été mise au point la préparation de cryoprécipités contenant du facteur VIII (environ 3 à 5 UI/mL), et jusqu’à nos jours, le principe du traitement de l’hémophilie est demeuré le même : la substitution du facteur de coagulation manquant selon deux modalités : « à la demande », lorsqu’un saignement survient, ou « en prophylaxie », permettant de prévenir les saignements.
Prophylaxie : le gold standard du traitement de l’hémophilie
Les organismes officiels comme l’Organisation mondiale de la santé (OMS) ou la Fédération mondiale d’hémophilie (WFH) recommandent la prophylaxie comme stratégie thérapeutique optimale pour les hémophiles sévères. Les deux objectifs principaux de la prophylaxie sont de prévenir les hémorragies graves mettant le pronostic vital en danger, telles que les hémorragies intracrâniennes, et d’empêcher la survenue d’arthropathie hémophilique, source de handicap fonctionnel majeur chez les hémophiles.
Plusieurs protocoles de prophylaxie ont été développés, avec des visions et des objectifs différents. Les premières prophylaxies ont été initiées en Suède, en 1958. La prophylaxie selon le protocole de Malmö a pour objectif de procurer au patient une vie « la plus normale possible », en maintenant le taux de facteur VIII (FVIII)/FIX au-dessus de 1 UI/dL [1, 2]. Il s’agit d’un protocole lourd et contraignant, qui nécessite plusieurs injections intraveineuses de FVIII/FIX par semaine et qui prévoit de débuter la prophylaxie le plus tôt possible, entre 1 et 2 ans, souvent avant tout accident hémorragique. Malgré ses bons résultats cliniques et son efficacité démontrée, ce protocole ne s’est pas généralisé à d’autres pays du fait du coût élevé des injections et des problèmes de disponibilité des concentrés de FVIII/IX dans différents pays [3]. Il a également engendré des réticences de la part des patients et de leurs familles, du fait de la nécessité de réaliser des injections régulières chez des enfants hémophiles dont la majorité n’a jamais présenté aucun accident hémorragique.
Ces facteurs, qui ont empêché l’utilisation large du protocole suédois, ont conduit à la mise au point d’autres protocoles de prophylaxie, plus adaptés aux besoins individuels des patients. L’école néerlandaise a ainsi défendu un schéma dans quoi la prophylaxie est engagée après la survenue de la première hémarthrose, par une ou deux injections hebdomadaires, avec une adaptation secondaire du régime selon la tendance hémorragique du patient, qui pouvait être progressivement intensifié [4]. C’était la première approche de traitement personnalisé chez les hémophilies.
Des équipes canadiennes ont ensuite développé un protocole de prophylaxie « personnalisée » sur des critères cliniques, où le régime est ajusté, avec intensification progressive des doses selon les besoins individuels des patients, en fonction des saignements observés sous traitement prophylactique. Les résultats de cette stratégie ont montré que seuls 16 % de patients avaient besoin d’un régime lourd, nécessitant plusieurs injections hebdomadaires, alors que 40 % des patients recevaient une seule injection par semaine, limitant ainsi de manière significative les recours aux chambres implantables. L’efficacité de ce protocole a néanmoins été sujette à interrogation, 40 % des patients ayant développé une articulation cible (i.e. siège d’au moins trois hémarthroses spontanées dans une période de six mois consécutifs) lors des cinq premières années de suivi.
Ainsi, plusieurs questions demeurent actuellement posées, concernant le régime optimal de prophylaxie :
- –quelle dose ?
- –quelle fréquence ?
- –comment intégrer les caractéristiques individuelles de chaque patient, telles que la tendance hémorragique personnelle, l’état articulaire, le mode de vie, l’intensité des activités physiques pratiquées, le degré d’adhésion au traitement, l’état veineux ainsi que la réponse individuelle de chaque patient aux concentrés de facteurs ?
Tous ces paramètres soulignent la pertinence d’une approche individualisée, « sur mesure », de la prophylaxie, qui doit être adaptée aux besoins de chaque individu, guidée par des critères objectifs, quantifiables et précis, au-delà d’une intensification ou d’un allégement des régimes basés uniquement sur la survenue de saignements symptomatiques. Cette manière de personnaliser le régime de prophylaxie, en fonction des seuls saignements symptomatiques, ne permet pas de protéger les articulations de façon optimale.
L’un des outils pouvant aider à mieux définir la réponse individuelle des patients à chaque concentré de facteur VIII ou IX est l’étude pharmacocinétique (PK). Des variations importantes des niveaux plasmatiques de ces facteurs ont en effet été observées après l’injection de doses similaires de concentrés de FVIII/FIX [5, 6].
Étude pharmacocinétique : un des outils de personnalisation
Il existe des différences considérables au niveau du profil pharmacocinétique des patients ayant reçu des doses similaires de FVIII ou de FIX. La variabilité de la demi-vie individuelle du FVIII a ainsi été rapportée par plusieurs auteurs. Après l’injection de 30 UI/kg de FVIII chez un enfant âgé de 0-6 ans, le temps nécessaire pour obtenir un taux résiduel < 1 % est d’environ 44 h si la demi-vie individuelle est au 5e percentile, contre 78,1 h si elle est dans le 95e percentile, soit une différence de 34,1 h. Cet écart est encore plus important chez les adolescents et les adultes (46,4 et 103,5 h, soit une différence de 57,1 h) [7]. Ainsi, la variabilité individuelle de la demi-vie des facteurs pourrait avoir un impact majeur sur le régime de prophylaxie.
Il a également été démontré que le temps passé en dessous du seuil critique de 1 UI/dL exposait les patients à un risque hémorragique plus important. La durée de la période où l’activité du FVIII/FIX circulant reste supérieure à 1 UI/dL est surtout liée à la demi-vie du médicament, à la fréquence des injections et à l’adhésion du patient au traitement plutôt qu’à la dose injectée ou au volume de distribution. Plusieurs paramètres, comme l’âge et le poids, participent à cette variabilité individuelle. Ainsi, les enfants ont besoin de doses de FVIII plus importantes que les adultes car la clairance du FVIII diminue avec l’âge et que sa demi-vie augmente ainsi progressivement (cette évolution de l’élimination avec l’âge n’est pas observée pour le FIX) [8]. Une adaptation par rapport au poids pourrait être également intéressante chez les patients obèses.
L’étude PK est certes un outil précieux, mais elle ne permet pas de prendre en compte toutes les variables qui influencent le risque hémorragique. Ainsi, l’état articulaire est un autre paramètre majeur qui doit être pris en considération. Une étude a testé deux régimes de prophylaxie : l’un intense, avec des injections quotidiennes, et l’autre avec des injections plus espacées. Les résultats montrent que, malgré des taux résiduels de FVIII plus élevés dans le groupe de prophylaxie intense, le nombre d’hémarthroses spontanées était comparable dans les deux groupes, avec un nombre important de saignements spontanés chez les patients ayant des articulations cibles [9]. Des résultats similaires ont été rapportés par une étude de thérapie génique, confirmant l’importance d’intégrer l’état articulaire parmi les critères de personnalisation [10]. Dans cette étude, parmi les patients hémophiles B sévères traités par une dose unique de vecteur AAV-FIX, tous les patients ont atteint un taux de FIX plasmatique situé entre 2 et 5 UI/dL. La prophylaxie a pu être interrompue chez certains patients qui ne présentaient plus de saignement spontané, alors que d’autres, ayant des articulations cibles, ont été obligés de poursuivre le traitement malgré des taux de FIX ≥ 2 UI/dL, démontrant la nécessité de taux résiduels plus élevés chez les sujets ayant des articulations cibles, pour une prophylaxie efficace.
Toutes ces données suggèrent fortement qu’il n’y a pas de seuil résiduel « universel » et que la prophylaxie doit être personnalisée, avec des seuils « individuels » déterminés selon les caractéristiques cliniques et environnementales de chaque patient ainsi que des propriétés du concentré de facteur qu’il utilise.
L’étude GENA-21 a été l’un des premiers essais de prophylaxie personnalisée à l’aide de PK. Il s’agissait d’une étude multicentrique, prospective, de phase IIIB, conduite chez des patients hémophiles A sévères adultes. L’objectif de GENA-21 était de tester l’efficacité de la prophylaxie personnalisée à l’aide de données PK, utilisant un facteur VIII recombinant produit par des cellules humaines (h-Cl rFVIII) [11]. Chaque patient a bénéficié d’une évaluation PK avec h-Cl rFVIII 60 ± 5 UI/kg. Après cette évaluation, les patients entraient dans la première phase de l’étude où ils suivaient une période de prophylaxie classique avec 30-40 UI/kg du même FVIII, injecté un jour sur deux – ou trois fois par semaine – pendant un à trois mois. Pendant cette phase, les données PK des patients étaient analysées et un régime de prophylaxie personnalisé, permettant un taux résiduel de 1 %, a été déterminé pour chaque sujet. Pendant la deuxième phase de l’étude, les patients ont été traités selon ce régime personnalisé pendant six mois. Les résultats de cette étude ont montré une nette diminution du nombre d’accidents hémorragiques pendant la phase de prophylaxie personnalisée, durant laquelle les injections ont en outre été plus espacées chez 58 % des patients, et la quantité de FVIII consommée réduite de 8 %. Soixante-treize pour cent (73 %) des patients n’ont présenté aucun accident hémorragique. L’étude PK semble être un outil prometteur, qui nous approche d’une « médecine de précision pour l’hémophilie » en permettant d’améliorer les régimes de prophylaxie des hémophiles en fonction de leurs réponses individuelles à chaque produit. La cible d’un taux résiduel > 1 %, qui a montré son efficacité dans l’expérience clinique suédoise et a été utilisée comme base dans toutes les études de PK, reste néanmoins arbitraire.
Nouvelles molécules de FVIII/FIX à demi-vie prolongée et étude pharmacocinétique
L’importance d’une approche personnalisée de la prophylaxie est d’autant plus évidente depuis l’arrivée des concentrés de FVIII/FIX à demi-vie prolongée dans l’arsenal thérapeutique. Une demi-vie prolongée ne permet pas seulement d’espacer les injections, mais pourrait offrir une meilleure protection antihémorragique, en gardant des intervalles d’injections similaires et des objectifs de taux résiduels mieux adaptés aux besoins de chaque individu. Une telle approche pourrait permettre de réduire de manière significative le nombre d’accidents hémorragiques si les conditions de prise en charge économiques le permettent.
Les résultats des études de phase III PROLONG-9FP (CSL654-3001 et CSL654-3002) ont été les premiers à valider cette approche [12, 13]. Ces études ont testé l’efficacité et la tolérance du FIX-albumine (rFIX-FP) en prophylaxie, selon différents régimes avec des injections tous les 7-10 ou 14 jours chez des patients âgés de 12 à 61 ans avec un taux de FIX plasmatique < 2 %. La demi-vie moyenne du rFIX-FP est de 102 h, soit 4,3 fois plus longue que le FIX conventionnel. Tous les patients inclus dans l’étude ont eu une évaluation PK. Les taux résiduels moyens observés étaient de 20 et de 12 % pour les groupes ayant reçu 40 UI/kg/7 jours et 75 UI/kg/14 jours. Le nombre de saignements spontanés annuels était de zéro pour tous les groupes (injections tous les 7-10 et 14 jours). Certains patients, avec un profil hémorragique atténué, ont pu bénéficier d’une prophylaxie tous les 21 jours, sans accident hémorragique spontané.
Suite à ces observations, plusieurs auteurs ont développé des programmes d’évaluation PK bayésienne, adaptés aux différentes molécules de FVIII et FIX, afin d’accompagner la démarche de personnalisation des traitements antihémophiliques. Ces outils, qui ne nécessitent que deux ou trois prises de sang (au lieu des PK historiques avec 10 à 12 points, très difficiles à réaliser en clinique), permettent d’effectuer des simulations de régime de prophylaxie avec des doses et des intervalles d’injections variés pour atteindre des objectifs de taux résiduels cibles prédéfinis [14]. Le maintien d’un taux résiduel plus élevé, chez des patients jeunes ayant un style de vie très actif, en utilisant des médicaments à demi-vie prolongée, pourrait être particulièrement intéressant pour mieux les protéger contre le risque hémorragique en leur permettant de conserver leurs activités. Afin d’optimiser la performance des outils PK, une étude récente a défini les valeurs résiduelles minimales dans différents contextes cliniques, en utilisant la méthode Delphi avec la participation de 15 experts internationaux. Les experts ont défini trois niveaux de taux résiduels correspondant à des profils de patients, d’activités ou de phénotypes hémorragiques différents [15] :
- –1 à 3 % pour des patients ayant un phénotype hémorragique atténué sous prophylaxie,
- –3 à 5 % pour les patients actifs et pour ceux qui ont des arthropathies modérées,
- –5 à 15 % pour les patients ayant des activités physiques à risque ou ayant des articulations cibles avec arthropathies sévères.
Les mêmes auteurs, dans une étude interventionnelle, ont ensuite utilisé ces trois niveaux de taux résiduels pour adapter de manière individuelle la prophylaxie des patients à l’aide d’un outil de PK [16]. Durant la période d’étude, ils ont considéré un taux résiduel < 3 % comme étant à risque hémorragique, un taux de 3 à 15 % comme adapté à la pratique d’une activité physique modérée et des valeurs > 15 % comme « sans danger », quelle que soit l’activité pratiquée. Cette étude n’a rapporté aucun accident hémorragique pendant la phase de prophylaxie personnalisée. Ce type d’approche utilisant des valeurs résiduelles cibles élevés (> 15 %) est certainement très sécurisante pour les articulations, mais augmente le coût de la prophylaxie de manière non négligeable et nous éloigne de plus en plus des premières estimations médico-économiques publiées par Carlsson et al.[17] qui avaient montré une réduction de 20 à 30 % des quantités de concentrés de FVIII/FIX utilisées sous prophylaxie personnalisée. Ces auteurs avaient suggéré un réel intérêt médico-économique de la prophylaxie guidée par PK, en plus d’une couverture plus efficace pour les patients. Compte tenu de ces observations, on peut penser que la « capacité coagulante résiduelle », plutôt que le taux de FVIII résiduel, est probablement une notion individuelle qu’il convient de mesurer.
Peut-on évoluer vers une personnalisation plus efficiente ?
Un nouveau modèle associant l’étude PK avec la pharmacodynamie (PD) a été développé afin d’essayer de mieux adapter le régime de prophylaxie aux besoins individuels de chaque patient [18]. La PK étudie le devenir du médicament dans l’organisme, quand la PD s’intéresse à l’effet exercé par le médicament sur l’organisme (dans le cas de l’hémophilie : l’amélioration de la capacité coagulante). Les auteurs ont proposé d’utiliser le test de génération de thrombine pour évaluer la pharmacodynamie, en association avec l’outil PK adapté au concentré de FVIII utilisé. Le test de génération de thrombine est un test global d’hémostase qui tient compte non seulement de l’effet procoagulant du FVIII ou du FIX mais également de l’impact de toutes les autres protéines procoagulantes et des régulateurs naturels de la coagulation comme l’antithrombine, le système de la protéine C et l’inhibiteur de la voie du facteur tissulaire (TFPI). En développant un outil combiné PK + PD, les auteurs ont amélioré la précision des simulations, par rapport à celles fondées sur l’outil PK seul. Cette approche intéressante et innovante doit être testée de manière prospective dans de nouvelles études cliniques. Son efficacité et son efficience doivent être comparées à la prophylaxie personnalisée à l’aide de l’analyse de PK seule.
Y a-t-il une place à la personnalisation avec les nouvelles approches thérapeutiques non substitutives ?
L’émicizumab (Hemlibra®) est le premier traitement non substitutif disponible sur le marché. Il s’agit d’un anticorps monoclonal humanisé bispécifique qui imite la fonction coagulatrice du FVIII activé (FVIIIa), en se liant au facteur IXa et au facteur X. L’émicizumab n’a pas de relation structurelle ni d’homologie de séquence avec le facteur VIII, ce qui lui permet de ne pas être neutralisé par les inhibiteurs dirigés contre ce dernier. Il s’administre en injections sous-cutanées hebdomadaires, et est indiqué en prophylaxie des épisodes hémorragiques chez les patients atteints d’hémophilie A avec ou sans alloanticorps anti-facteur VIII appelés inhibiteurs [19].
En effet, l’administration de concentrés de FVIII peut provoquer chez certains patients le développement d’alloanticorps anti-FVIII, notamment chez les hémophiles A sévères. Le développement d’un inhibiteur anti-FVIII est la complication la plus redoutable du traitement de l’hémophilie dans la mesure où les inhibiteurs compromettent l’efficacité du traitement substitutif, augmentent de manière significative le handicap fonctionnel lié à l’arthropathie hémophilique et la mortalité. La prise en charge thérapeutique des hémophiles A avec inhibiteurs comprend habituellement deux volets :
- –un protocole d’induction de tolérance immune (ITI) par injections de concentrés de FVIII visant à éradiquer l’inhibiteur,
- –l’administration d’agents dits by-passants pour traiter et/ou prévenir les saignements.
Les deux médicaments by-passants disponibles sur le marché sont le facteur VII activé recombinant (rFVIIa, Novoseven®) et le concentré de complexe prothrombique activé (CCPa, Feiba®). Ces deux médicaments ont des mécanismes d’action différents, multiples et complexes, mais ils sont tous les deux efficaces car, in fine, ils améliorent la génération de thrombine des patients. Ils ont tous les deux une efficacité de 85 % en contexte chirurgical. Néanmoins, il n’y a pas de test de routine validé pour surveiller leur efficacité et adapter leur posologie aux besoins des patients. Les patients hémophiles sévères sont souvent concernés par la chirurgie orthopédique, à un stage avancé de leur arthropathie. Pour assurer une hémostase efficace lors de ces chirurgies majeures, il est important de connaître la réponse individuelle des patients et d’évaluer objectivement l’efficacité des deux molécules avant la chirurgie. Il a été montré que le test de génération de thrombine pouvait être un biomarqueur intéressant, capable d’évaluer la réponse individuelle des patients aux agents by-passants et de personnaliser ainsi le traitement en contexte de chirurgies programmées [20]. Des résultats similaires ont également été rapportés avec la thromboélastométrie [21]. Ainsi, les tests globaux d’hémostase, comme le test de génération de thrombine et la thromboélastométrie, sont des outils biologiques qui peuvent être utilisés pour une prescription personnalisée des traitements by-passants chez les hémophiles avec inhibiteurs.
L’émicizumab a été récemment introduit dans la liste des médicaments destinés aux hémophiles A avec inhibiteurs. Il est indiqué en prophylaxie des épisodes hémorragiques.
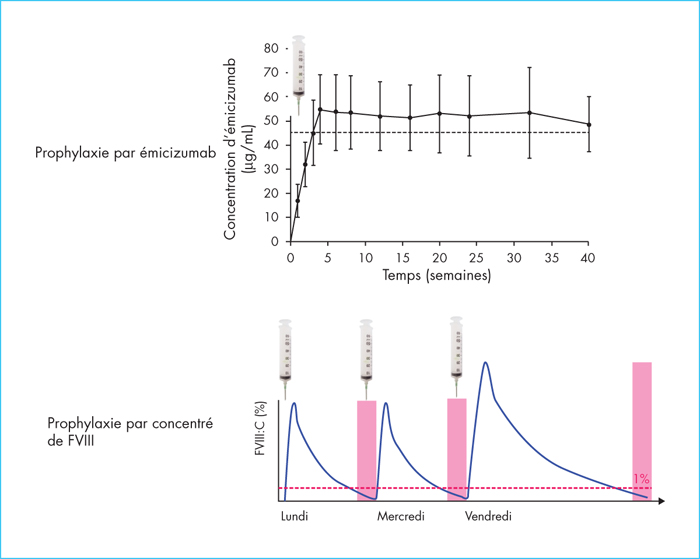
La prophylaxie par émicizumab permet d’obtenir une capacité coagulante stable et prolongée, différence fondamentale avec la prophylaxie classique par concentré de FVIII ou par agents by-passants qui donnent un profil hémostatique en dents de scie (figure 1). Le niveau de capacité coagulante atteint sous émicizumab n’est pas complètement normalisé mais il est habituellement supérieur à celui procuré par le taux résiduel de FVIII. En cas de saignement intercurrent, le traitement est assuré par l’administration de FVIII ou d’agents by-passants. Des événements thromboemboliques graves ont été rapportés, chez les patients avec inhibiteurs, lors de l’utilisation concomitante d’émicizumab et de CCPa [22]. Ces événements ont été observés lors que le CCPa était prescrit à la dose moyenne > 100 unités/kg/j pendant plus d’un jour, c’est-à-dire à la dose habituelle de 75 unités/kg toutes les 8 à 12 h. Il existe également une possibilité d’hypercoagulabilité en cas d’administration de rFVIIa ou de FVIII avec l’émicizumab, sur la base des travaux précliniques. L’émicizumab augmente la capacité de coagulation ; la dose de facteur de coagulation requise pour obtenir l’hémostase peut par conséquent être inférieure à celle utilisée en l’absence de prophylaxie par émicizumab. Une personnalisation des prescriptions est indispensable dans ce contexte d’utilisation concomitante de plusieurs molécules procoagulantes, afin d’assurer efficacement l’hémostase et sans induire d’hypercoagulabilité responsable de complications thrombotiques. Un cas clinique publié illustre cette approche personnalisée [23]. Il s’agit d’un patient hémophile A sévère, sous prophylaxie émicizumab, qui a présenté un hématome rétropéritonéal sur rupture spontanée d’une artère malformée au niveau du pôle supérieur du rein gauche. Le patient était habituellement traité par CCPa en raison d’une réponse individuelle insuffisante au rFVIIa. L’effet combiné de l’émicizumab et du CCPa a été évalué in vitro avant l’accident, avec des doses croissantes de CCPa. Les doses de CCPa entre 15 et 25 U/kg ont permis de normaliser la génération de thrombine in vitro, sans induire d’hypercoagulabilité. Ainsi, le patient a reçu un traitement par CCPa 25 U/kg poursuivi avec des doses biquotidiennes de 15 U/kg pendant trois semaines. Le traitement médical a permis de contrôler l’hémorragie et aucune complication thrombotique n’a été rapportée en lien avec ce traitement. Ce cas illustre le fait que l’approche personnalisée avec des techniques de laboratoires maîtrisées permet de mieux sécuriser l’utilisation des nouveaux traitements non substitutifs.
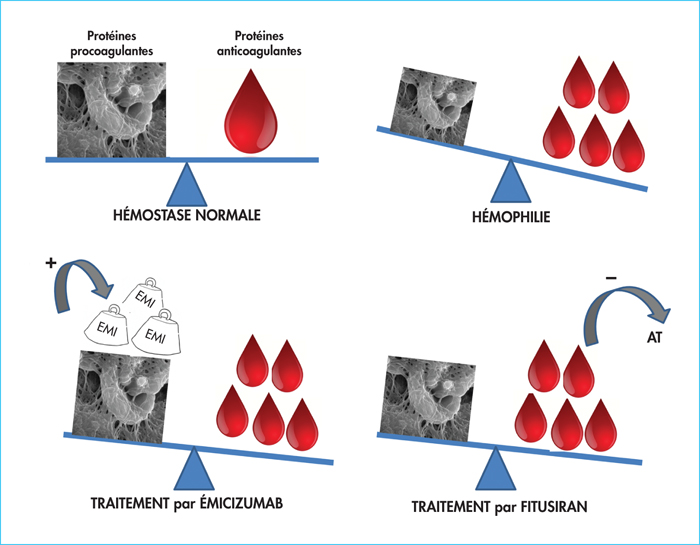
Un autre traitement non substitutif en cours de développement est le fitusiran. Il s’agit d’un ARN interférant, administré par voie sous-cutanée avec une demi-vie de 30 jours, pour le traitement de l’hémophilie et d’autres déficits hémorragiques rares. Cette molécule vise à corriger les défauts de coagulation en modifiant l’équilibre entre les facteurs de coagulation procoagulants et les inhibiteurs qui sont des anticoagulants naturels (figure 2). Il réduit l’expression de l’antithrombine, le plus puissant anticoagulant endogène, et crée un déficit acquis, contrôlé et transitoire en antithrombine [24]. Les études de phase II ont testé deux doses de fitusiran : 50 et 80 mg/mois ; dans les deux cas, une réduction d’antithrombine de 80 % a été observée et 48 % des patients n’ont présenté aucun accident hémorragique [25]. Les études de phase I et II ont clairement démontré que la baisse de l’antithrombine circulante était systématiquement accompagnée d’une augmentation de la génération de thrombine. Dans la plupart des cas une dose fixe mensuelle a été efficace durant les études de phase II. Néanmoins, une thrombose veineuse cérébrale fatale est survenue chez un patient qui a reçu fitusiran et du concentré de FVIII (31-46 U/kg) suite à un saignement intercurrent. Des recommandations, basées sur l’évaluation in vitro de la génération de thrombine, ont été alors publiées pour la prescription de concentrés de facteurs en association avec le fitusiran [26]. Il est recommandé d’éviter toute prescription d’antifibrinolytique en association avec le fitusiran. En cas d’accident hémorragique chez un patient recevant une prophylaxie par fitusiran, de faibles posologies de concentrés sont privilégiées : FVIII 10-20 UI/kg, FIX 20-30 UI/kg, CCPa 30-50 U/kg et rFVIIa ≤ 45 μg/kg [26].
Le marstacimab (PF 6741086) est un anticorps monoclonal anti-TFPI humanisé qui, comme le fitusiran, exerce un effet procoagulant en inhibant un anticoagulant endogène : le TFPI. Il s’agit de l’inhibiteur principal de la phase d’initiation de la coagulation. De la même manière que pour l’émicizumab, l’arrivée sur le marché de ces deux molécules innovantes en cours de développement pour la prophylaxie, soulèvera la question de la prise en charge des saignements intercurrents survenant sous prophylaxie. Leur prescription concomitante avec d’autres médicaments procoagulants nécessitera une personnalisation des doses afin de garantir leur efficacité et d’éviter si possible les accidents thrombotiques. Il est à noter que les programmes de développement des deux autres anticorps monoclonaux anti-TFPI ont été récemment arrêtés en raison d’accidents thrombotiques graves.
Des traitements personnalisés car chaque patient est différent
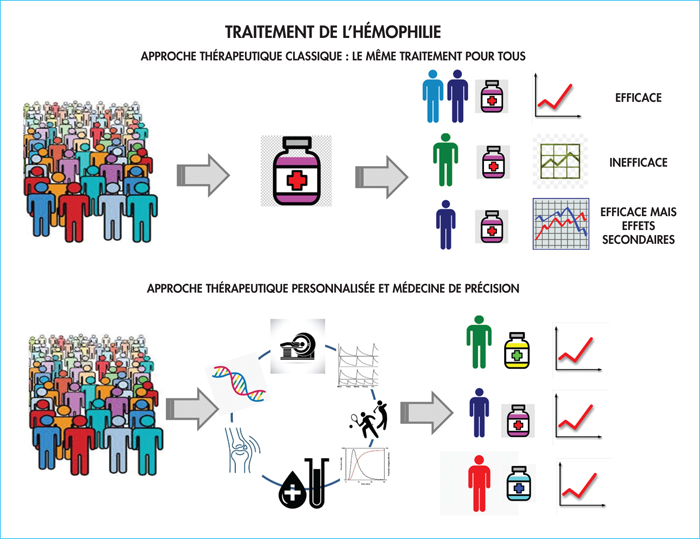
Malgré des taux similaires de FVIII plasmatiques, 10 à 15 % des hémophiles A sévères présentent un phénotype hémorragique modéré/mineur, avec des épisodes hémorragiques rares, une consommation réduite de facteurs et une absence d’arthropathie hémophilique. L’expression concomitante d’une thrombophilie constitutionnelle comme la mutation Leiden ou l’atteinte par les virus de l’hépatite B ou C ou VIH sont des éléments à risque thrombotique qui peuvent modifier l’expression clinique de l’hémophilie. Le génotype est un autre déterminant du phénotype hémorragique. Il a été montré que certaines mutations comme les mutations faux-sens, les petites délétions/insertions ainsi que les mutations touchant les sites d’épissage sont associées à des taux circulants minimes de facteur VIII, permettant une certaine protection contre les hémorragies [27]. Par ailleurs, les taux des facteurs de coagulation et des inhibiteurs ont une grande variabilité, qui peut aller du simple au triple d’un sujet à l’autre, tout en restant dans des valeurs normales (pour rappel, les taux normaux de la plupart des facteurs sont entre 50 et 150 %). Ainsi, l’activité du FVIII ou du FIX n’est pas le seul déterminant de la capacité de la coagulation globale d’un individu. Toutes ces considérations font évoluer notre vision du traitement de l’hémophilie vers la nécessité d’une médecine personnalisée de précision, intégrant la génomique et le mode de vie, permettant de déterminer la posologie optimale de différentes molécules thérapeutiques pour chaque patient selon sa réponse individuelle, sécurisant l’usage concomitant de plusieurs facteurs procoagulants en faisant bénéficier les patients des doses sur mesure, adaptées à leur capacité coagulante (figure 3).
Le traitement des patients pédiatriques et celui des adultes avec certaines comorbidités doivent être attentivement suivis, évalués et adaptés. Le principe des ARN interférant contre l’ARN messager de l’antithrombine a été validé chez des adultes ayant un foie mature et normal. L’administration du fitusiran chez des patients ayant un antécédent d’hépatite C non traitée a conduit à une augmentation des enzymes hépatiques et à l’arrêt du traitement chez ces patients durant l’étude de phase I [25]. Les nouveau-nés et les nourrissons avec un foie « immature » pourraient être plus vulnérables à ce type d’effet secondaire. L’efficacité de l’émicizumab a été validée chez les enfants de moins de 12 ans [28]. Néanmoins, seuls huit enfants entre 1 et 2 ans étaient inclus dans l’étude et il n’y a aucune donnée chez les nourrissons < 1 an avec un foie immature, chez qui les taux de FIX et de FX sont différents de ceux notés chez les adultes. Ces différences peuvent modifier la PK et la PD de l’émicizumab dans cette population particulière, et nécessiter des adaptations en fonction de la maturité hépatique.
Une autre personnalisation peut concerner le choix des molécules adaptées à chaque patient. Après avoir traité, durant 50 ans, les hémophiles par des concentrés de FVIII et de FIX, nous vivons un tournant avec l’arrivée des molécules recombinantes améliorées et des thérapeutiques non substitutives qui sont source d’espoir chez les médecins et les patients. Ces nouvelles approches ouvrent des perspectives pour réduire la survenue de la principale complication de l’hémophilie en 2020 : le développement d’un inhibiteur. Leur choix « personnalisé » peut être d’avantage intéressant et justifié chez des patients ayant des mutations et d’autres particularités constitutionnelles et acquises à haut risque d’inhibiteur.
Et l’avenir : la guérison de l’hémophilie est-elle en vue ?
Les résultats récents des essais cliniques de thérapie génique sont très prometteurs et laisse espérer une possibilité de guérir les hémophilies A et B [29, 30]. L’année 2020 sera probablement un tournant, avec l’arrivée probable sur le marché du premier produit de thérapie génique pour l’hémophilie A. Le valoctocogène roxaparvovec a permis, chez des patients suivis depuis trois ans, une expression stable d’environ 20 % de FVIII, avec une réduction de plus de 95 % des besoins en concentrés de FVIII. Les résultats obtenus chez les hémophiles B sont également très prometteurs avec des taux plasmatiques stables de 5 à 10 % avec le FIX sauvage et une possibilité de normalisation du taux de FIX entre 35 à 50 %, voire au-delà, lorsque le transgène utilisé est le FIX-Padua, un variant avec une activité spécifique augmentée. Est-ce que la personnalisation sera toujours d’actualité lorsque la thérapie génique prendra place parmi les traitements courants de l’hémophilie ? Si on regarde attentivement les résultats des études de phase III, la variabilité des résultats, la prédictibilité des taux atteints selon la quantité de vecteurs administrée, la durabilité à l’échelle individuelle ainsi que le risque d’hépatotoxicité suggèrent que l’approche personnalisée du traitement de l’hémophilie pourrait encore avoir une place dans l’ère de la thérapie génique.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt en rapport avec cet article.
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International