Hématologie
MENUMaturation ex vivo des globules rouges : de la culture cellulaire à la poche de transfusion Volume 11, numéro 2, Mars-Avril 2005
- Page(s) : 153-5
- Année de parution : 2005
Auteur(s) : Dominique Labie1, Ryad Tamouza2
1 Institut Cochin, département GDPM, faculté de
médecine Cochin, 24 rue du Faubourg St-Jacques,
75014 Paris
<labie@cochin.inserm.fr>
2 Laboratoire d’immunologie et d’histocompatibilité,
hôpital St-Louis, 1 avenue Claude-Vellefaux,
75010 Paris
Le problème des besoins transfusionnels est loin d’être résolu.
La demande augmente, les exigences liées au contrôle également.
Pouvait-on envisager d’autres ressources transfusionnelles que le
sang des donneurs ? La recherche s’est orientée vers
l’utilisation de produits de substitution dont aucun, jusqu’à
présent, ne s’est avéré être utilisable en pratique médicale
courante [1]. Un pas vient sans doute d’être franchi par un groupe
de chercheurs français qui a obtenu la régénération de globules
rouges humains à maturité obtenue en culture à partir de cellules
hématopoïétiques précurseurs CD34+ [2]. Plusieurs
critères sont rappelés pour que la production de globules rouges
puisse être considérée comme valable :
– La prolifération des cellules progénitrices doit être
importante ;
– La différenciation vers la lignée érythroïde doit être
spécifique ;
– La maturation doit être complète et implique l’énucléation des
cellules.
Aucun essai n’avait satisfait à tous ces critères auparavant. En
culture liquide, on avait pu obtenir une expansion significative,
mais avec blocage de la maturation finale [3]. Une énucléation
n’avait été obtenue qu’aux dépens d’une expansion réduite. Le
processus de culture mis au point dans le travail actuel obtient
une expansion de 1,95 × 106, ainsi qu’une
conversion à 100 % des érythrocytes. Les globules rouges ont
les caractères morphologiques et fonctionnels – déformabilité,
aptitude à fixer l’oxygène – de cellules adultes
natives.
Les techniques de culture employées ont cherché à reproduire, dans
la mesure du possible, le microenvironnement qui, dans la moelle,
permet la maturation érythrocytaire à partir de cellules
progénitrices (figure 1). La première
étape (8 jours) a été d’induire prolifération et
différenciation érythroïde dans un milieu sans sérum, en présence
de cytokines, le stem cell factor (SCF), l’interleukine-3
(IL-3) et l’érythropoïétine (Epo) [4]. Une deuxième étape
(3 jours) a consisté à poursuivre la culture avec l’Epo seule,
en ajoutant soit des cellules stromales murines, soit des cellules
mésenchymateuses humaines. Dans une troisième étape
(10 jours), enfin, les cellules ont été incubées sur stroma en
supprimant tous les facteurs exogènes. Une amplification maximale a
été observée vers J15, à partir de sang périphérique, mais encore
plus importante à partir de sang de cordon. L’engagement vers la
lignée érythroïde est net dès J8, suivi rapidement par une
différenciation terminale. Les cellules progénitrices disparaissent
à ce moment. À J15 la presque totalité des cellules
étaient des réticulocytes. Dans les jours suivants, on a assisté à
l’énucléation finale, en même temps qu’à la disparition de
l’expression du récepteur de la transferrine. Les globules rouges
avaient les caractéristiques de cellules natives, leur morphologie
biconcave a été vérifiée par microscopie bifocale, le taux de
réticulocytes était environ de 18 %. La nature de
l’hémoglobine synthétisée variait selon l’origine du
prélèvement : majoritairement (94 %) de l’HbA à partir de
sang périphérique, une dominante (64 %) d’HbF à partir de sang
de cordon. Sur ces érythrocytes obtenus ex vivo on a vérifié
un taux normal de glucose-6-phosphate déshydrogénase et de pyruvate
kinase, ce qui suggérait le maintien de propriétés réductrices.
Leur valeur fonctionnelle a été évaluée par leur capacité à fixer
un ligand après photolyse en flash, ainsi que par leur capacité à
fixer et relarguer l’oxygène. Toutes ces valeurs étaient
pratiquement les mêmes que celles des cellules témoins. La première
étape d’amplification des cellules CD34+ avait déjà fait
l’objet d’une publication par les mêmes auteurs [5]. Les auteurs
avaient aussi montré que les précurseurs érythroïdes, introduits
chez la souris NOD/SCID, s’y différenciaient normalement. Le
progrès du dernier travail est d’avoir tenu compte du rôle de
facteurs régulateurs produits dans la moelle par les cellules
stromales [6], la chronologie des différents milieux de culture
s’avérant importante. Elle a cherché à reproduire les étapes
connues de prolifération et différenciation des cellules
hématopoïétiques [7]. Les cytokines sont actives sur la
prolifération, mais n’agissent pas sur la différenciation des
progéniteurs, seuls les facteurs tardifs, Epo dans le cas présent,
sont spécifiques, l’engagement dans une voie ou une autre étant
toujours le fait du hasard.
Enfin, l’interaction avec les protéines de la matrice
extracellulaire et les macrophages permet l’énucléation finale.
L’utilisation de cellules murines posait un problème, qui a été
résolu par la substitution de cellules mésenchymateuses humaines.
Un contact direct avec ces cellules est nécessaire, l’interposition
d’un filtre très mince annulant l’effet recherché.
Les auteurs évoquent, pour finir, les développements possibles de
leurs travaux. Peut-on envisager une utilisation transfusionnelle
pour les groupes sanguins rares ? Il est clair que, dans un
futur proche, le rendement obtenu (4 unités de sang à
transfuser à partir d’un prélèvement de sang de cordon) et le coût
élevé de la préparation rendent cet usage prohibitif [8]. La percée
reste, cependant, remarquable ; elle doit permettre de mieux
comprendre les mécanismes de la différenciation érythroïde
terminale, peut-être d’explorer l’invasion des globules rouges par
des agents dont ces cellules sont la cible, Plasmodium,
parvovirus B19. Le but évident, dans la décennie à venir, est une
production automatisée et moins onéreuse de globules rouges prêts à
l’emploi.
Références
1. Winslow RM. Current status of blood substitute research : towards a new paradigm. J Intern Med 2003 ; 253 : 508-17.
2. Giarratana MC, Kobari L, Lapillonne H, et al. Ex vivo generation of fully mature red blood cells from hematopoietic stem cells. Nature Biotech 2005 ; 23 : 69-74.
3. Fibach E, Manor D, Oppenheim A, Rachmilewitz EA. Proliferation and maturation of human erythroid progenitors in liquid culture. Blood 1989 ; 73 : 100-3.
4. Migliaccio G, Di Pietro R, di Giacomo V, et al. In vitro mass production of human erythroid cells from the blood of normal donors and of thalassemic patients. Blood Cells Mol Dis 2002 ; 28 : 169-80.
5. Neildez-Nguyen TM, Wajcman H, Marden MCD, et al. Human erythroid cells produced at large scale differentiate into red blood cells in vivo. Nat Biotech 2002 ; 20 : 467-72.
6. Verfaillie CM. Soluble factor(s) produced by human bone marrow stroma increase cytokine-induced proliferation and maturation of primitive hematopoietic progenitors while preventing their terminal differentiation. Blood 1993 ; 82 : 2045-53.
7. Ogawa M. Differentiation and proliferation of hematopoietic stem cells. Blood 1993 ; 81 : 2844-53.
8. Mohandas N. Banking on red blood cells. Nat Biotech 2005 ; 23 : 35-6.
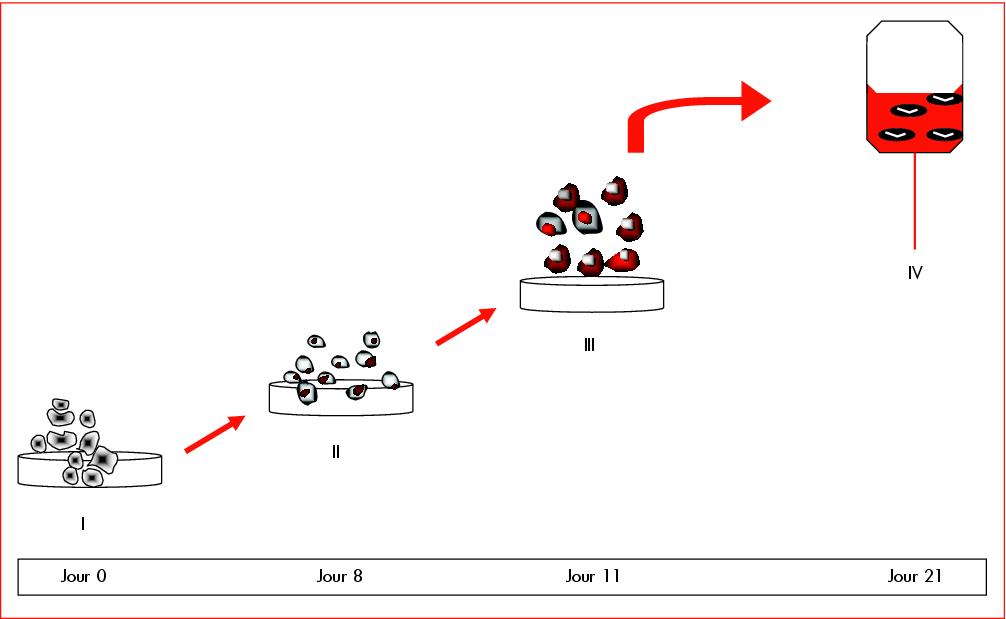
Figure 1. Représentation schématique des étapes
nécessaires à l’obtention ex vivo d’hématies humaines à
maturité en culture.
I. Pendant la première phase, les précurseurs
CD34+ sont cultivés pendant 8 jours en présence de
cytokines : SCF (stem cell factor), IL-3
(interleukine-3) et Epo (erythropoiétine).
II. Au cours de la deuxième étape, qui dure 3 jours, les
cellules ne sont plus en présence que d’Epo, avec addition de
cellules stromales.
III. Lors de la dernière étape de 10 jours, le milieu ne
contient plus aucune cytokine, seulement les cellules
stromales.
IV. À l’issue de ces trois étapes, les cellules originelles
CD34+ auront subi une amplification de l’ordre de deux
millions de fois, aboutissant à des globules rouges matures,
fonctionnels, totalement énucléés, aptes à être transfusés.

