Innovations & Thérapeutiques en Oncologie
MENUCiblage de NF-kappaB en oncologie Volume 4, numéro 5-6, Septembre-Décembre 2018
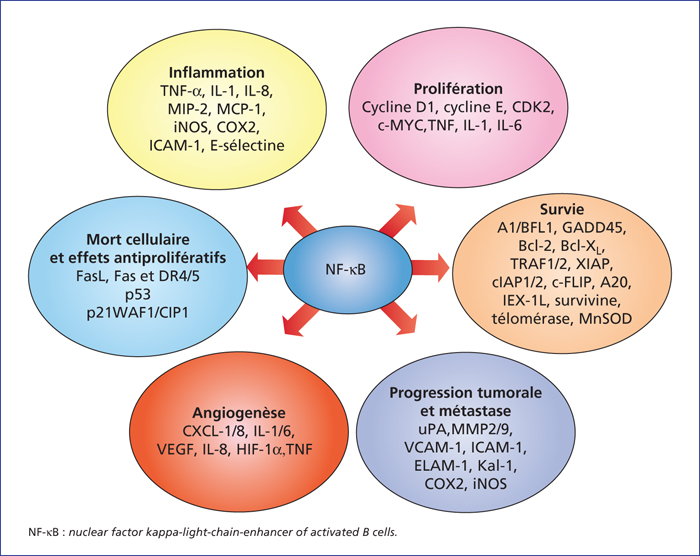
Figure 1
Gènes cibles de
NF-κB target genes involved in cancer development and progression. NF-κB activation affects the hallmarks of cancer through the transcription of genes involved in cell proliferation, angiogenesis, metastasis, inflammation, and suppression of apoptosis as identified in both cell lines and tumor samples (see [7]).
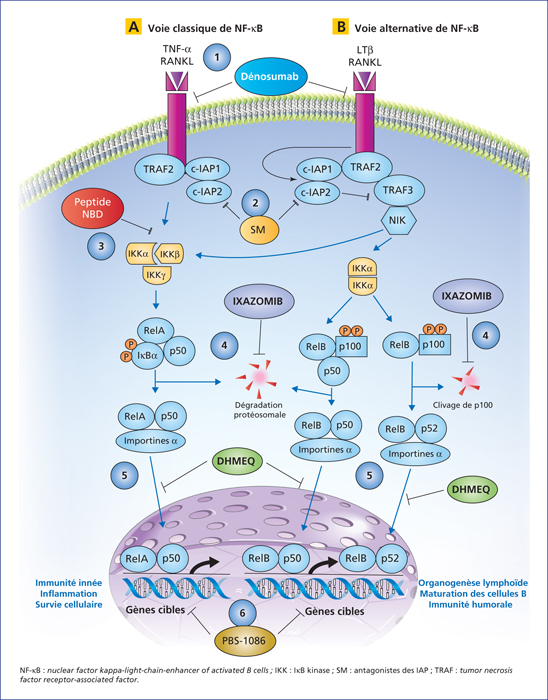
Figure 2
Voies principales d’activation de
Main NF-κB activation pathways and the six current strategies to inhibit its activity in preclinical and clinical stages in oncology. Classical (A) and alternative (B) NF-κB activation pathways are represented. Six key steps targeting NF-κB activity in oncology are indicated, representing six classes of inhibitors reported in preclinical and clinical trials: 1. Binding of ligands to their specific membrane receptors; 2. Anti-apoptotic proteins (IAP); 3. Activity of the IKK complex; 4. Degradation of NF-κB inhibitory proteins (IκB) via the proteasome; 5. Translocation of NF-κB complexes into the nucleus; and 6. binding of NF-κB complexes to DNA. An example of inhibitor for each step is indicated.
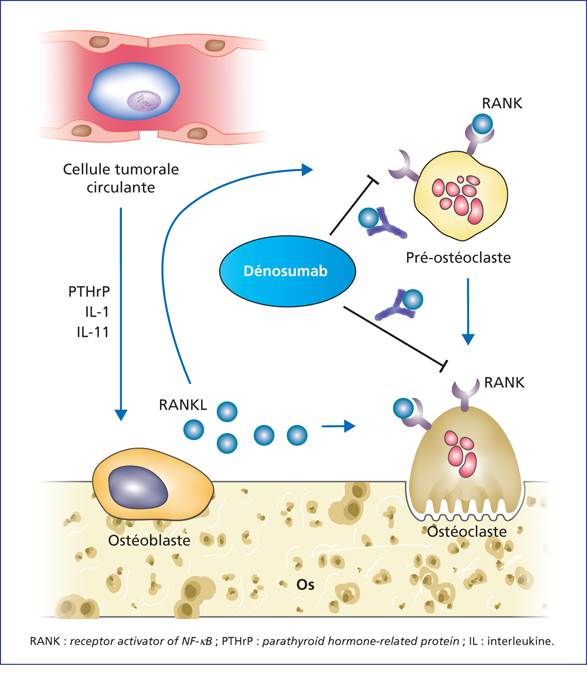
Figure 3
Blocage de la liaison RANK-RANKL par le dénosumab. Ce blocage réduit les lésions du squelette associées à certains traitements anticancéreux et retarde l’apparition des métastases osseuses. Les facteurs PTHrP, IL-1 et IL-11 sécrétés par les cellules tumorales circulantes induisent la production de RANKL par les ostéoclastes. RANKL va alors se lier à son récepteur RANK à la surface des pré-ostéoclastes, induisant leur différenciation, ainsi qu’à la surface des ostéoclastes, activant leur fonction d’ostéolyse. Le dénosumab est un anticorps qui se fixe à RANKL, bloquant ainsi la liaison RANK-RANKL et les conséquences de cette liaison, telles les lésions osseuses associées à certains traitements anticancéreux (inhibiteurs des aromatases pour le cancer du sein, déprivation androgénique pour le cancer de la prostate, etc.) et retarde l’apparition des métastases osseuses.
Inhibition of RANK-RANKL binding by denosumab. This inhibition reduces skeletal lesions associated with certain anticancer treatments and delays the appearance of bone metastasis. Secretion of PTHrP, IL-1 and IL-11 by circulating tumour cells lead to the production of RANKL by osteoclasts. RANKL then binds to its receptor RANK on the surface of pre-osteoclasts, leading to their differentiation, as well as to the surface of osteoclasts, activating their osteolytic function. Denosumab is an antibody that binds to RANKL, thus blocking RANK-RANKL binding and its consequences, such as skeletal-related events associated with certain anticancer treatments (aromatase inhibitors for breast cancer, androgenic deprivation for prostate cancer, etc.) and delays in the appearance of bone metastasis.

