Hépato-Gastro & Oncologie Digestive
MENUUn algorithme de prise en charge de la dysfonction hépatique en hématologie Volume 26, numéro 2, Février 2019
Contexte
Les traitements des hémopathies ont considérablement évolué ces dix dernières années. Un nombre croissant de patients ont recours à la greffe de cellules hématopoïétiques allogéniques. Depuis la première en 1957, le nombre de greffes de cellules hématopoïétiques allogéniques est passé d’un nombre cumulé de 100 000 en 1995 à 1 million en décembre 2012 [1]. Cette croissance est attribuable à une augmentation du nombre de donneurs de cellules hématopoïétiques allogéniques non-apparentés, à de nouvelles sources de cellules hématopoïétiques allogéniques comme le sang de cordon ombilical ou encore au développement de techniques de conditionnements de moindre intensité, permettant aux patients plus âgés ou avec des comorbidités, d’avoir accès à la greffe [2]. Enfin, récemment, la possibilité de pratiquer des greffes haplo-identiques avec des conditionnements contenant du cyclophosphamide en post-greffe permet virtuellement de trouver un donneur pour tous les patients. Les indications évoluent vite et s’étendent désormais au-delà de l’oncologie. Ainsi, les patients avec des facteurs de risque de syndrome d’obstruction sinusoïdale (SOS) comme la surcharge en fer, les infections par des virus hépatotropes, fréquemment rencontrées chez les patients souffrant d’hémoglobinopathies, auront accès à la greffe dans un futur proche [3, 4]. Les patients d’hématologie sont de plus en plus traités par des molécules innovantes : nouvelles immunothérapies, anticorps déplétants, anticorps immunoconjugués (ADC), inhibiteurs de tyrosine kinase, molécules inhibitrices des BH3 anti-apoptotiques (Bcl-2), qui peuvent être associés à des toxicités hépatiques dont les mécanismes ne sont pas encore connus.
Ce qui rend cette niche hépatologique si complexe et difficile à aborder, c’est la multitude de lésions hépatiques pouvant survenir au cours de la prise en charge des patients avec une hémopathie maligne. Le foie peut être infiltré par des cellules tumorales ; les traitements (chimiothérapie, irradiation et thérapies ciblées) peuvent tous être toxiques pour le foie ; les infections hépatiques dans un contexte d’immunodépression sont fréquentes ; la maladie du greffon contre l’hôte (GVH) est fréquente après greffe de cellules hématopoïétiques allogéniques ; et les hépatites associées aux médicaments non-anticancéreux ne sont pas rares. Ces catégories de diagnostic ne s’excluent pas mutuellement – les patients d’hématologie ont fréquemment plusieurs processus physiopathologiques, hépatocytaire, biliaire, vasculaire, affectant le foie en même temps.
Anomalies du bilan hépatique chez un patient hématologique
Celui qui ne sait pas ce qu’il cherche, ne comprend pas ce qu’il trouve. Claude Bernard
Les anomalies hépatiques sont classiques après un traitement hématologique. Elles s’étendent de la simple perturbation du bilan hépatique sans retentissement clinique à la défaillance d’organe et au décès du patient. Leur fréquence atteint 80 % dans certaines séries [5, 6]. Le risque de décès après une greffe de cellules hématopoïétiques allogéniques, toutes causes confondues et sans rechute hématologique, augmente lorsque le taux de bilirubine totale dépasse deux fois la limite supérieure de la normale (LSN) pour atteindre 80 % lorsque les concentrations dépassent 10 fois la LSN [7]. Les causes de dysfonction hépatique après un traitement hématologique (greffe de cellules hématopoïétiques allogéniques comprise) sont multiples, et plusieurs processus pathologiques atteignant soit les hépatocytes [hépatite hypoxique, toxicité médicamenteuse, réaction du greffon contre l’hôte (GVH), infections virales hépatotropes (hépatites A, B, C, D et E [VHA, VHB, VHC, VHD et VHE, respectivement], adénovirus et herpès virus humains, notamment herpès simplex (HSV), Varicella-Zoster (VZV), Epstein-Barr Virus (EBV) et cytomégalovirus (CMV)], soit les cellules biliaires (GVH, sepsis, toxicité médicamenteuse), soit l’endothélium hépatique (syndrome d’obstruction sinusoïdale [SOS]) peuvent être intimement associés. Les hépatopathies du patient hématologique sont souvent multiples et intriquées
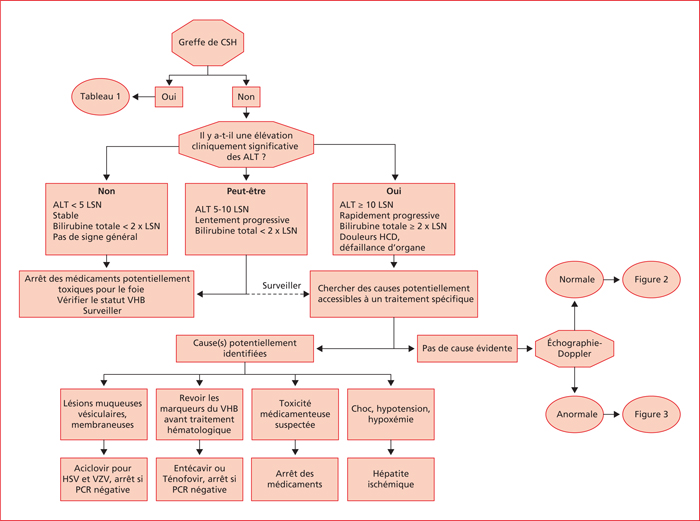
Une approche algorithmique avec un minimum de tests invasifs aboutit souvent au bon diagnostic chez un patient d’hématologie avec des anomalies du bilan hépatique. Cela permet d’identifier les situations dans lesquelles il existe plusieurs causes intriquées, une situation fréquente. Notre algorithme est présenté dans trois figures (figures 1-3) et sépare les patients avec une greffe de cellules hématopoïétiques allogéniques des autres patients d’hématologie. Les causes de dysfonction hépatique après greffe de cellules hématopoïétiques allogéniques sont rares en dehors de ce contexte (tableau 1). L’algorithme comporte ensuite une question qui requiert un jugement clinique : « Les anomalies des tests hépatiques sont-elles médicalement significatives ? ». L’élévation des ALT et des AST est fréquente chez les patients fébriles prenant de nombreux médicaments et il est parfois difficile de justifier une poursuite des investigations. La conduite à tenir devant un taux d’ALT < 5 fois la LSN, stables dans le temps et qui n’est pas associée à un ictère (bilirubine totale < 2 fois la LSN) est de chercher une infection par un virus hépatotrope, en particulier si les tests initiaux ont été négligés (tableau 2) et de passer en revue les médicaments reçus. Des augmentations mineures des ALT ne sont pas, en général, associées à une défaillance hépatique. En revanche, chez les patients dont les ALT augmentent rapidement et dépassent dix fois la LSN (500 UI/L) ou lorsque le syndrome de cytolyse est accompagné d’un ictère (bilirubine totale ≥ 2 fois la LSN), une évaluation urgente est nécessaire pour chercher les causes de nécrose hépatocellulaire pouvant être traitées.
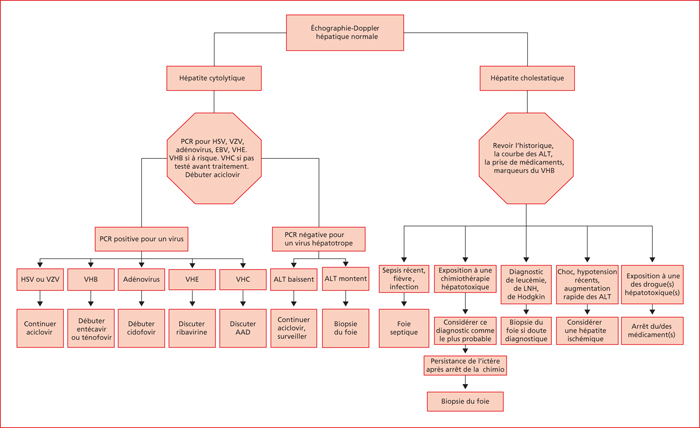
Un traitement antiviral empirique par voie intraveineuse avec aciclovir associé à de l’acétyl-cystéine par voie intraveineuse (si le patient reçoit du paracétamol) doit être envisagé pendant le déroulement des tests de diagnostic. Les patients ne présentant pas d’ictère et dont les ALT sont entre 5 à 10 fois la LSN (250 à 500 U/L) mais de façon rapidement croissante doivent être également évalués de façon urgente. Une fois lancés les traitements urgents, une approche non invasive en différenciant syndrome de cytolyse (ratio ALT (LSN)/PAL (LSN) > 5) et syndrome de cholestase (ratio ALT (LSN)/PAL (LSN) < 2) [8] et avec une échographie Doppler du foie, de la vésicule biliaire, des voies biliaires, de la tête du pancréas, du système vasculaire et de la cavité péritonéale permettra, en général d’aboutir au bon diagnostic.
Atteintes hépatocytaires : hépatites cytolytiques
Lésions hépatocellulaires causées par une hépatite virale
Les hépatites virales ne sont plus des causes fréquentes d’hépatite après un traitement hématologique.
Certains virus peuvent néanmoins être à l’origine d’une hépatite grave avec insuffisance hépatique contribuant au décès du patient. Il s’agit en général de causes réversibles et accessibles à un traitement, il est donc essentiel de les détecter rapidement. Les recherches de virus recommandées dans un contexte d’hépatite cytolytique et de traitement hématologique sont présentées dans le tableau 2.
L’hépatite aiguë par réactivation du VHB après traitement hématologique devrait être une rareté de nos jours : (1) les patients porteurs de marqueurs du VHB sont facilement identifiés avant traitement hématologique en cherchant l’antigène de surface du virus de l’hépatite B (AgHBs), les anticorps dirigés contre le core du VHB (anti-HBc) et l’ADN du VHB ; (2) les traitements hématologiques favorisant la réactivation du VHB, (biothérapies et greffe de cellules hématopoïétiques allogéniques) sont connus ; et (3) les prophylaxies antivirales préviennent l’hépatite associée au VHB lors de la reconstitution immunitaire. Il est établi que les greffes de cellules hématopoïétiques allogéniques avec un donneur positif pour l’antigène HBs peuvent transmettre le VHB à des receveurs naïfs ou à ceux qui ont perdu leur immunité. L’infection qui en découle est susceptible d’être grave si le receveur n’a jamais rencontré le VHB. Les greffes de cellules hématopoïétiques allogéniques d’un donneur AgHBs-négatif et anti-HBc-positif peuvent également transmettre le VHB aux receveurs, mais à une fréquence moindre. Les greffes de cellules anti-HBc-positives peuvent transmettre le virus B
L’infection à VHC dans un contexte de traitement hématologique évolue très rarement vers une fibrose hépatique cholestasiante, à l’inverse de ce qui est observé au cours de la greffe de foie [9, 10]. La sérologie de l’hépatite C peut être faussement négative chez les patients d’hématologie ; la recherche d’ARN est la technique de référence.
La réactivation du CMV est relativement fréquente chez les patients d’hématologie. Le virus peut également être acquis à partir de produits sanguins de cellules hématopoïétiques allogéniques de donneurs séropositifs. L’infection peut généralement être détectée par PCR dans le sang. La maladie à CMV implique une atteinte d’organe. Les organes généralement touchés sont le système digestif, la moelle osseuse ou les poumons. Le CMV n’infecte presque jamais le foie de façon isolée. On peut trouver des lésions hépatiques ou biliaires dans un contexte d’infection à CMV disséminée. Les lésions hépatiques sont généralement des atteintes focales composées de lymphocytes entourant des cellules infectées : hépatocytes, cellules endothéliales et cellules épithéliales biliaires. Les taux d’ALT ne se situent presque jamais dans la fourchette observée avec le VZV, l’HSV ou l’adénovirus. Le pronostic d’une infection à CMV disséminée n’est que rarement dépendant de l’atteinte hépatique. Cependant, de rares cas de nécroses hépatocellulaires fatales ont été décrits [11]. Une infection gastro-intestinale à CMV peut toucher l’ampoule de Vater et contribuer à une obstruction biliaire.
Malgré les prophylaxies antivirales, de rares cas d’hépatites à HSV sont encore décrites chez les patients hématologie. Il s’agit, en général, de réactivations et les lésions muqueuses ne sont pas rares. Pendant les périodes d’immunodépressions, l’infection à HSV peut se présenter sous une forme viscérale sans lésions herpétiques visibles. Le diagnostic est fait en détectant l’ADN HSV dans le sérum. Un traitement probabiliste par aciclovir doit être instauré rapidement car il prévient les lésions hépatiques graves.
Comme l’HSV, de rares cas d’hépatite à VZV sont décrits chez les patients d’hématologie et résultent, à l’image des autres herpès virus, de leur capacité de latence dans nos organismes. Cependant, il arrive parfois qu’il s’agisse d’une primo-infection. Le diagnostic est évident lorsque les lésions dermatologiques associées au zona sont visibles, mais difficile lorsque la douleur neurogène est la seule manifestation. Des cas d’hépatite à VZV sans atteinte extrahépatique sont décrits. Une autre manifestation classique de l’infection viscérale par le VZV est une douleur abdominale non systématisée, une anorexie, des nausées et une distension abdominale associées à une élévation des ALT. Cette présentation est suffisamment caractéristique pour justifier un traitement immédiat par aciclovir [12]. Le diagnostic est confirmé par la détection de l’ADN du VZV dans le sérum.
Il existe deux manifestations hépatiques (rares) asssociée à l’EBV dans un contexte hématologique. La première est une hépatique par des immunoblastes transformés (maladie lymphoproliférative à EBV) conduisant à une hépatomégalie. Le diagnostic est suggéré par la présence d’ADN EBV dans le sang et/ou dans les biopsies tissulaires. L’autre manifestation est celle d’une hépatite aiguë souvent associée à un ictère. Quelques cas d’hépatites fulminantes mortelles ont a été rapportées [13].
La réactivation d’autres herpès virus (HHV-6 et HHV-8) peut être associée à des d’hépatites chez des patients sous traitement anticancéreux [14]. On les détecte par des PCR spécifiques, surtout depuis l’utilisation de PCR multiplex [15].
Certains sérotypes d’adénovirus peuvent provoquer une nécrose hépatique fatale et progressive, presque toujours dans le cadre d’une immunosuppression sévère et prolongée. Ce type d’infection à adénovirus est rare après une greffe de cellules hématopoïétiques allogéniques et très rare chez les patients d’hématologie générale. La nécrose hépatique est souvent accompagnée d’une entérite virale, d’une pneumonie, d’une néphrite et d’une cystite. Le diagnostic est fait par la détection du génome de l’adénovirus dans le sang, les selles, les urines ou le lavage broncho-alvéolaire.
Le VHE, dont la transmission est essentiellement alimentaire sous nos climats, peut également être transmis par les produits sanguins, notamment les cellules souches hématopoïétiques. L’infection par le VHE peut progresser vers une hépatite chronique et une insuffisance hépatique chez les patients d’hématologie, notamment après une greffe de cellules hématopoïétiques allogéniques. Des cas de d’insuffisance hépatique grave associée au VHE sont décrits, notamment dans un contexte hématologique. Le diagnostic repose sur la mise en évidence de l’ARN dans le sérum. L’infection par le virus de l’hépatite E peut progresser vers une hépatite chronique et une insuffisance hépatique chez les patients d’hématologie, notamment après une greffe de cellules hématopoïétiques allogéniques
Lésions hépatocellulaires causées par des médicaments anticancéreux
Il faut toujours avoir en tête l’hépatotoxicité des traitements anti-cancéreux lorsque les taux sériques d’AST et d’ALT augmentent vite. Cependant, seuls certains médicaments et schémas thérapeutiques combinés sont des causes courantes de lésions hépatocellulaires graves. D’autres combinaisons de traitement, y compris la radio-chimiothérapie, peuvent provoquer des lésions hépatiques sinusoïdales, une ischémie hépatocytaire et une élévation du taux sérique d’AST/ALT. Les grands essais multicentriques donnent, en général, une estimation basse de la fréquence de ces lésions hépatiques. Les critères de toxicité hépatique utilisés dans les essais cliniques médicamenteux peuvent ne pas refléter une lésion hépatique sous-jacente. Par exemple, la fibrose sinusoïdale étendue après traitement ADC ou chimiothérapie à base d’oxaliplatine [16-18].
Lésions hépatocellulaires causées par des médicaments non-hématologiques
Il s’agit de la première cause d’élévation modérée des ALT en hématologie. Les hépatites dues aux traitements non hématologiques peuvent être difficiles à différencier des nécroses hépatocellulaires associées aux traitements anticancéreux.
Les médicaments les plus souvent mis en cause sont les traitements antifongiques ou antibactériens. Cependant, un large éventail de médicaments utilisés en hématologie peut engendrer une atteinte hépatique. Certains de ces médicaments affectent également le métabolisme des chimiothérapies. Les lésions hépatiques causées par les antibiotiques sont généralement asymptomatiques, mais des lésions hépatiques graves peuvent être observées avec le triméthoprime-sulfaméthoxazole et l’amoxicilline-clavulanate. Les antiviraux, notamment l’aciclovir, le ganciclovir, le foscarnet, le cidofovir et la ribavirine, sont rarement toxiques pour le foie. Des hépatites graves sont associées au paracétamol à forte dose et à des doses thérapeutiques chez les personnes sensibles, notamment les patients dépendants à l’alcool, les patients avec une cirrhose, les patients avec des stocks glutathion protecteur diminués comme au cours des dénutritions ou des chimiothérapies à base d’agents alkylants. Des sites tiennent à jour des bases de données sur les toxicités médicamenteuses, notamment celui du National Institute of Health qui dispose de financements institutionnels et est tenu régulièrement à jour1.
Hépatites ischémiques
L’hépatite ischémique n’est pas un diagnostic difficile chez le patient d’hématologie, car les causes sont cliniquement évidentes : choc septique, choc cardiogénique et hypoxie prolongée provoquée par une insuffisance respiratoire. Dans une étude observationnelle entre 1992 et 2007 comportant plus de 6 000 patients, le pourcentage de patients avec un pic d’AST > 30 N après une greffe de cellules hématopoïétiques allogéniques était de 1,4 % et les deux causes principales (totalisant 80 % des causes totales) étaient le SOS et l’hépatite hypoxique. Le syndrome d’obstruction sinusoïdale et l’hépatite ischémique contribuent à plus de 80 % des hépatites post-greffe
Le pronostic dépend de l’étendue de la nécrose hépatique, elle-même dépendant du temps nécessaire pour rétablir un débit sanguin adéquat dans le foie. Les patients avec une maladie hépatique sous-jacente (cirrhose compensée, foie cardiaque chronique) et les personnes âgées peuvent être particulièrement sujets à ces lésions ischémiques.
Présentation hépatique d’une réaction du greffon contre l’hôte
Une hépatite cytolytique (ALT entre 2N et 5N) peut être associée à la GVH lorsqu’elle survient alors que le patient est encore sous immunosuppresseurs après greffe de cellules hématopoïétiques allogéniques. Cette présentation atypique peut également survenir à distance de la greffe de cellules hématopoïétiques allogéniques, c’est-à-dire à l’arrêt des anti-rejets ou après réinjection de lymphocytes du donneur de cellules hématopoïétiques allogéniques. Le tableau clinique est une hépatite cytolytique rapidement progressive associée, dans un second temps, à un syndrome de cholestase. L’aspect histologique est semblable à celui des hépatites auto-immunes, associant notamment une hépatite d’interface, une atteinte lobulaire associée à des infiltrats de plasmocytes et de polynucléaires éosinophiles [19, 20].
Hyperammoniémie post-chimiothérapie
Le coma hyperammoniémique est une complication rare et parfois mortelle de la chimiothérapie à forte dose, notamment après conditionnement pour greffe de cellules hématopoïétiques allogéniques. Le mécanisme comporte vraisemblablement un déficit acquis dans une enzyme du cycle de l’urée, la carbamoyl phosphate synthétase [21].
Atteintes biliaires : hépatites cholestatiques
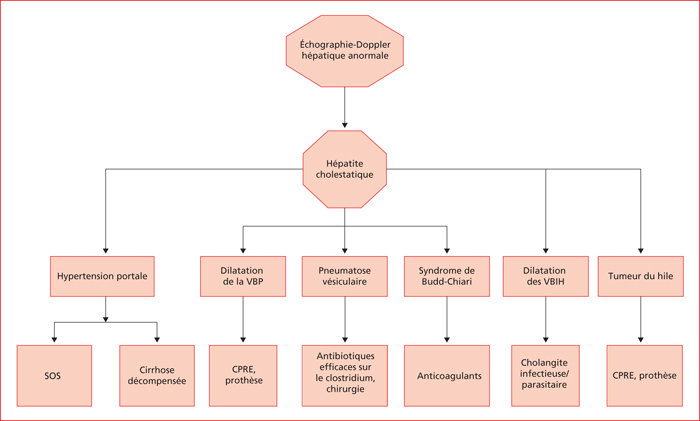
La cholestase ictérique est un facteur pronostic inquiétant chez les patients traités pour un cancer, car les causes d’ictère sont souvent graves (sepsis, toxicité médicamenteuse, hépatite virale, obstruction biliaire, cancer primitif du foie…). Les causes les plus fréquentes après un traitement hématologique sont la cholestase intrahépatique provoquée par des cytokines en circulation (cholestase liée à une infection). Cependant, d’autres causes telles que le cancer lui-même, la toxicité de la thérapie anticancéreuse, l’obstruction biliaire, le SOS et la cholangite provoquée par des médicaments ou des virus ne sont pas rares. L’échographie Doppler hépatique est au centre du raisonnement.
Échographie Doppler hépatique normale
L’ictère est fréquent chez les personnes neutropéniques et fébriles avec une mucite post-chimiothérapie. Également appelée « cholangitis lenta » et « cholestase du sepsis », cette forme d’ictère est provoquée par des cytokines inflammatoires (TNF-alpha et IL-6), qui affectent le transport de la bilirubine conjuguée par la protéine MRP2 codée par le gène ABCC2[22]. La présentation habituelle est une augmentation lente de la bilirubine sérique totale, principalement de la bilirubine conjuguée, souvent sans élévation des ALT ou des phosphatases alcalines. L’hémolyse accompagnant le sepsis aggrave ce syndrome [23]. L’augmentation des phosphatases alcalines est plus fréquente lorsque la cholestase est prolongée. Le foie septique est la première cause d’ictère
Jusqu’à 70 % des patients développent une GVH aiguë après une greffe de cellules hématopoïétiques allogéniques. Les facteurs de risque sont le mismatch HLA, un faible niveau de prophylaxie anti-rejet et l’absence de déplétion en lymphocytes T du greffon. La prescription systématique d’AUDC a modifié le phénotype de la GVH [24,25]. La GVH est un mélange de trois processus : 1) le premier est un syndrome de cholestase sans anomalie histologique à la biopsie hépatique [26] qui s’apparente au cholangitis lenta ; 2) Le second est un syndrome de cholestase avec un infiltrat lymphocytaire des canaux biliaires avec pléomorphisme nucléaire, destruction des cellules épithéliales biliaires et cholestase dans la zone 3 des acini hépatiques [26]. Ce type de GVH peut progresser vers une ductopénie ; 3) Le troisième est en général observé à distance de l’allogreffe, alors que le patient a de faibles doses d’immunodépresseurs et se présente sous la forme d’une hépatite aiguë cytolytique avec des caractéristiques anatomopathologiques semblables à celles des hépatites auto-immunes [19, 27].
La plupart des schémas thérapeutiques chimiothérapeutiques utilisés en pratique hématologique ont une faible toxicité biliaire. Les schémas thérapeutiques les plus susceptibles d’entraîner un ictère sont les schémas myéloablatifs utilisés pour préparer les patients à la greffe de cellules hématopoïétiques allogéniques et à l’utilisation de L-asparaginase et des ADC. À moins que la présentation et le tableau clinique soient suffisamment caractéristiques de la toxicité hépatique connue d’un médicament, il s’agit souvent d’un diagnostic d’exclusion. Aucun traitement spécifique n’est disponible et, par conséquent, un diagnostic précis d’un médicament de chimiothérapie (ou d’un schéma thérapeutique) en tant que cause d’ictère n’est pertinent que si ce médicament doit être à nouveau prescrit. Dans ce cas, une biopsie du foie peut être utile pour déterminer le lien de causalité, tout en sachant que certaines caractéristiques histologiques de la toxicité du médicament peuvent être peu spécifiques, à l’image de la clinique [28]. Trouver une autre explication à l’ictère sur la biopsie (par exemple, une hépatite virale, des granulomes…) exclurait la chimiothérapie des causes imputables à cet ictère. Les immunomodulateurs anti-PD1 et anti-PDL1 ont été associés à des hépatites cholestatiques rarement ictériques [29].
Les atteintes biliaires associées aux médicaments non hématologiques sont en général bénignes. Il s’agit généralement d’une élévation brutale mais modérée des phosphatases alcalines associée, à un moindre degré à une élévation des transaminases. La présence d’un ictère augmente le risque de mortalité lorsque les transaminases sont élevées. Par exemple, dans une population essentiellement non oncologique, la mortalité des patients une hépatite cytolytique était de 9,2 % si la bilirubine totale était > 2 fois la LSN [30]. Il est difficile d’extrapoler ces données au contexte hématologique en raison des multiples causes d’ictère autres que médicamenteuses, mais en règle générale, tout médicament associé à des ALT > 3 fois la LSN doit être arrêté si un ictère apparait. L’ictère est un facteur de gravité des hépatites médicamenteuses
La cyclosporine inhibe directement le transport canaliculaire biliaire et est associée à des cholestases modérées sans syndrome de cytolyse. Le tacrolimus est moins souvent à l’origine de cholestases, sauf en présence de surdosages. Parmi les médicaments anti-nauséeux disponibles, la chlorpromazine est la plus susceptible de causer des lésions hépatiques cholestatiques.
L’insuffisance hépatique ischémique résulte d’un débit sanguin sinusoïdal inadéquat généralement causé par une hypotension et une hypoxie. L’ictère qui suit une hypotension puis à une élévation des taux sériques d’ALT est un signe de mauvais pronostic.
Les virus des hépatites ne sont pas des causes fréquentes d’ictère en hématologie, en particulier lorsque des prophylaxies anti-VHB et HSV/VZV sont données chez les patients à risque. L’association élévation des transaminases et ictères doit faire néanmoins chercher tous les virus hépatotropes par des techniques d’amplification génique, notamment le VHE dont le fardeau chez les patients d’hématologie est mal décrit.
Un lymphome volumineux dans le foie est visible en imagerie, mais tous les lymphomes infiltrants ne peuvent être détectés. Le lymphome de Hodgkin extrahépatique peut être associé à une cholestase ictérique sans atteinte du foie et des voies biliaires [31]. Le syndrome de cholestase régresse, en général, avec le cancer. Des cas de ductopénie conduisant à une issue fatale sont cependant décrits.
La prescription systématique de prophylaxies antifongiques a presque éliminé les abcès fongiques hépatiques chez les patients d’hématologie. En cas d’infection fongique invasive, notamment hépatosplénique, on isole volontiers des levures résistantes [32]. Les facteurs de risque sont la neutropénie prolongée, les antibiothérapies à large spectre, les procédures médicales invasives, l’alimentation parentérale prolongée et la colonisation du tube digestif. Les cholangites à Cryptosporidium sont classiques au cours des déficits immunitaires congénitaux, notamment au cours du déficit immunitaire lié à l’X avec hyper-IgM associé à des mutations du ligand du CD40. Ces cholangites chroniques peuvent progresser vers une cholangite sclérosante qui indique par elle-même la greffe de cellules hématopoïétiques allogéniques. Dans ce contexte, des poussées de cholangite associés à la reconstitution immunitaire sont classiques. Les infections hépatiques à mycobactéries, y compris à BCG chez les patients ayant eu une vaccination antérieure, sont décrites chez les patients d’hématologie avec un traitement immunosuppresseur prolongé. Les infections disséminées à Clostridium et les infections de la vésicule biliaire par des organismes anaérobies peuvent donner des aérobilies et des cholécystites gangréneuses.
Une augmentation de la bilirubine non conjuguée à partir de globules rouges hémolysés ou sénescents dans un foie dysfonctionnel entraîne souvent une forte augmentation de la bilirubine sérique totale, parfois très disproportionnée par rapport au degré d’atteinte hépatique.
Il existe une relation inverse entre le débit de filtration glomérulaire (DFG) et les taux sériques de solutés filtrés par les glomérules, notamment la créatinine et la bilirubine conjuguée. La bilirubine conjuguée (chez l’homme sain, 80 à 85 % sont du diglucuronide et 15 à 20 % du monoglucuronide) est filtrée au niveau du glomérule. Ces deux composants subissent également une sécrétion active. Lorsque le DFG diminue, la clairance des solutés filtrés par les reins diminue et les taux sériques de ces solutés augmentent [33].
Échographie-doppler avec anomalies spécifiques
La migration lithiasique est fréquente chez les patients d’hématologie. Des causes classiques, comme les calculs biliaires, sont souvent en cause, en raison d’une prévalence élevée de cette maladie chez les personnes âgées. D’autres causes, plus spécifiques au patient d’hématologie, sont parfois en cause. La lithiase biliaire est fréquente chez les patients d’hématologie
Une boue biliaire composée de cholestérol ou de bilirubinate de calcium peut s’accumuler rapidement dans la vésicule biliaire chez les patients avec de faibles ingesta au cours des chimiothérapies. La cyclosporine, dont l’élimination bilaire pourrait participer à la formation du sludge biliaire, est un facteur de risque. Lorsque les patients avec un sludge biliaire reprennent une alimentation, il n’est pas rare que cette substance microcristalline migre dans la voie biliaire principale et provoque des nausées, des vomissements et des douleurs épigastriques. Certaines de ces manifestations nécessitent une sphinctérotomie ou la pose d’un stent biliaire, en particulier en cas de dysfonctionnement ampullaire (voir ci-dessous) ou en cas d’angiocholite associée [34]. L’acide ursodésoxycholique (AUDC) peut améliorer la cholérèse et accélérer la dissolution des microlithes de cholestérol mais n’a pas d’effet sur le sludge biliaire dans un contexte de greffe de cellules hématopoïétiques allogéniques (McDonald, communication personnelle).
L’angiocholite peut être une manifestation de la maladie à CMV dans le tractus gastro-intestinal et le foie, en particulier chez les patients dont l’immunosuppression a été longue.
La cholécystite aiguë peut provoquer un ictère par obstruction de la voie biliaire principale par une vésicule biliaire inflammée et volumineuse (syndrome de Mirizzi). La cholécystite fongique peut également entraîner une obstruction par extension des champignons dans les voies biliaires intra- et extrahépatiques. Dans une population hématologique, la «cholécystite alithiasique» peut être plus fréquente que celle liée aux calculs biliaires, mais le terme « cholécystite sans calcul » est impropre, car de nombreux patients ayant reçu une chimiothérapie et mangeant peu auront des microlithes dans la bile de la vésicule biliaire. Le diagnostic de la cholécystite aiguë par échographie peut être difficile chez les patients d’hématologie en raison du sludge ou d’épaississements de la paroi de la vésicule biliaire lié à un SOS et non à une cholecystite. Les signes suggérant une cholécystite incluent un épanchement périvésiculaire, du gaz dans la paroi de la vésicule biliaire, un signe de Murphy échographique et une douleur à la palpation de l’hypochondre droit.
Le syndrome de Budd-Chiari (obstruction au drainage des veines hépatiques) est caractéristique à l’échographie doppler. Les causes sont la thrombose ou rarement une tumeur ou une infection fongique impliquant soit les veines hépatiques, soit la veine cave adjacente. Ce diagnostic peut être suspecté en cas d’ictère, d’hépatomégalie et d’ascite chez un patient avec une hypercoagulabilité, un syndrome myéloprolifératif sous-jacent ou rarement une tumeur impliquant la veine cave et/ou des veines hépatiques.
Atteintes vasculaires
Thromboses veineuses splanchniques
Les thromboses veineuses splanchniques (TVS) comprennent les thromboses de la veine porte, de la veine mésentérique, de la veine splénique et le syndrome de Budd-Chiari. Les syndromes myéoloprolifératifs sont la principale cause générale de TVS. Les syndromes myéloprolifératifs contribuent à environ 10 % de l’ensemble des TVS dans les plus grandes études de cohortes à presque 50 % dans les cohortes de patients atteints du syndrome de Budd-Chiari [35]. La TVS est souvent le premier signe clinique associé aux syndromes myéloprolifératifs, en particulier lorsque la mutation JAK2V617F est présente. La prévalence de la mutation JAK2V617F est de 32,7 % (IC à 95 %, 25,5 % à 35,9 %) dans une grande série de patients avec une TVS [36] et comprise entre 27,7 % (IC à 95 %, 20,8 % à 35,8 %) chez les patients sans cancer du foie et sans cirrhose avec une thrombose de la veine porte et 41,1 % (IC à 95 %, 32,3 % à 50,6 %) chez les patients avec un syndrome de Budd-Chiari [37]. La TVS est également l’une des complications les plus importantes de l’hémoglobinurie paroxystique nocturne [38]. Il faut chercher une hémoglobinurie paroxystique nocturne chez les patients avec une TVS et des signes cliniques et biologiques compatibles avec une hémolyse intravasculaire.
Atteintes sinusoïdales
Les atteintes sinusoïdales sont fréquentes chez les patients d’hématologie. Des fibroses sinusoïdales sont rapportées chez les patients avec une hématopoïèse extramédullaire associée aux myélofibroses. Des obstructions sinusoïdales sont décrites au cours des leucémies en phase blastique. Des dilatations sinusoïdales sont rapportées au cours de la maladie de Hodgkin, du myélome multiple et des syndromes myéloprolifératifs. La prise d’imatinib est parfois associée à des nécroses hépatocytaires et à un collapsus sinusoïdal qui peut progresser vers une fibrose sinusoïdale. Les atteintes sinusoïdales chroniques infracliniques sont fréquentes
Le primum movens du SOS est la destruction des cellules endothéliales bordant les sinusoïdes hépatiques. Le primum movens du syndrome d’obstruction sinusoïdale est une destruction des cellules sinusoïdales qui embolisent les petites veinules des zones 3 de l’acinus hépatique
L’oblitération des petites veines hépatiques et les thromboses des petits vaisseaux intrahépatiques ne sont pas des conditions nécessaires au développement du SOS. L’ancien terme « maladie veino-occlusive » est inexact. La présence de peptides procollagènes et des inhibiteurs de la fibrolyse sont présents dans le sérum des patients avec un SOS sévère ce qui est cohérent avec le processus de fibrose intense des sinusoïdes et des petites veines hépatiques. Les marquages anti-actine sur coupes de foie de patients atteints de SOS montrent une activation des cellules étoilées, source de dépôts de collagène dans les sinusoïdes [39]. La fréquence et la gravité du SOS a chuté de façon spectaculaire ces dix dernières années pour les raisons suivantes : (1) les doses d’irradiation corporelle totale (ICT) > 14 Gy ne sont presque plus utilisées ; (2) la fludarabine a remplacé le cyclophosphamide (CY) dans de nombreux protocoles de conditionnement avant greffe de cellules hématopoïétiques allogéniques ; (3) les patients à risque de SOS sont conditionnés avec des protocoles moins toxiques pour le foie sans CY et sans TBI > 12 Gy ; (4) la prévalence de l’infection chronique par le VHC chez les candidats à la greffe de cellules hématopoïétiques allogéniques est devenue faible ; et (5) l’adaptation des doses de chimiothérapie en fonction de leurs dosages sériques. Le CY et l’ICT étaient, historiquement, les principaux facteurs de risque du SOS [40]. Les métabolites du CY sont directement toxiques pour les cellules endothéliales sinusoïdales. Le métabolisme du CY est très variable d’un patient à l’autre et, de ce fait, sa toxicité est difficilement prévisible sans monitoring des taux sériques [28, 41]. Le busulfan (BU) est une autre drogue fréquemment associée au SOS. Le BU, peu toxique pour le foie, diminue les concentrations endothéliales en glutathion et les sensibilise ainsi au CY [42, 43]. L’ordre de la chimiothérapie est également associé à la sévérité du SOS [43]. Des chimiothérapies à base d’oxaliplatine, de carmustine et de melphalan ont également été associées au SOS et des toxicités synergiques ont été rapportées [44]. Des déterminants génétiques contribuent certainement aux toxicités médicamenteuses endothéliales à la sensibilité des cellules endothéliales au SOS mais aucun biomarqueur n’a été, à ce jour, identifié [45]. Cyclosphosphamide, oxaliplatine, et anticorps immunoconjugués sont les principaux facteurs de risque de syndrome d’obstruction sinusoïdale
Le SOS est une complication classique des traitements à base d’ADC [46]. Les ADC gemtuzumab et inotuzumab ozogamicin sont des anticorps humanisés spécifiques d’antigènes de surface des cellules cancéreuses conjugués à un dérivé disulfure de la calicheamicine γ1 par un ligand hydrolysable. Il existe quatre mécanismes potentiels de lésions hépatiques causés par les ADC : 1) le ciblage de cellules sinusoïdales normales qui expriment le même antigène que celui exprimé sur les cellules malignes ; 2) l’endocytose des ADC par les cellules endothéliales sinusoïdales du foie et les cellules de Kupffer via les récepteurs Fc des immunoglobulines ; 3) la présence de cellules malignes dans les sinusoïdes hépatiques qui expriment l’antigène d’intérêt, entraînant la libération de toxines dans les sinusoïdes après apoptose des cellules malignes ; et 4) l’exposition des cellules endothéliales à la calicheamicine γ1. Le SOS associé aux ADC est caractérisé par une fibrose sinusoïdale étendue, une activation des cellules étoilées, une hémorragie centrolobulaire dans les espaces de Disse et une nécrose des hépatocytes de la zone 3 [47]. Le risque de SOS associé aux ADC augmente lorsque les ADC sont administrés de manière rapprochée par rapport à d’autres protocoles myéloablatifs [47].
Évaluation des patients avant traitement hématologique, greffe de cellules hématopoïétiques allogéniques comprise
Dans les champs de l’observation, le hasard ne favorise que les esprits préparés Louis Pasteur
Les patients d’hématologie avec des facteurs de risque ou des antécédents de facteurs de risque de maladie chronique du foie doivent être vus par un expert pour chercher des lésions hépatiques occultes qui pourraient modifier le plan de traitement hématologique. L’immunité est le déterminant principal de l’histoire naturelle des hépatites virales. Ces infections peuvent être mortelles chez les patients d’hématologie en raison du virus lui-même ou d’une baisse des doses de chimiothérapies. Une infection fongique hépatosplénique doit être cherchée chez un patient d’hématologie avec des périodes prolongées de neutropénie.
Bilan virologique
Les recommandations de dépistage des virus hépatotropes sont précisées dans le tableau 3. Tous les patients d’hématologie doivent être dépistés pour le VHB/VHD et le VHC avant de débuter une chimiothérapie. Les patients avec des marqueurs d’infection récente ou passée doivent rencontrer un expert. Les patients d’hématologie avec des tests hépatiques anormaux doivent être testés pour le VHA et le VHE. La recherche d’IgM anti-VHA et anti-VHE est peu sensible chez les personnes immunodéprimées, en particulier ceux traités par anticorps déplétants, et les techniques de biologie moléculaire doivent être privilégiées [48].
Infections hépatiques occultes
Une infection fongique hépatosplénique latente doit être cherchée en présence d’un syndrome septique à hémocultures négatives associé à une altération de l’état général et à des douleurs de l’hypochondre droit. Les antécédents de fongémie en période d’aplasie sont des facteurs de risques. Une douleur à la palpation du foie associée à des anomalies de la biologie hépatique, des microabcès hépatiques à l’échographie, au scanner au à l’IRM sont évocateurs. La valeur prédictive négative des examens d’imagerie est faible en raison de la taille des abcès à levure [49]. La présence de biomarqueurs fongiques (dosages galactomannanes et ß-D glucanes) et la culture d’une biopsie du foie sont souvent utiles au diagnostic [50].
Évaluation de la fibrose et de la fonction hépatique
Les maladies chroniques du foie, notamment les infections à virus hépatotropes et les stéatohépatites, sont prévalentes sous nos climats et les patients d’hématologie, à l’instar de la population générale, peuvent avoir une hépatopathie occulte, éventuellement au stade de cirrhose plus ou moins compensée. La cirrhose décompensée est, en général, une contre-indication à la plupart des traitements cytotoxiques. La fibrose hépatique cliniquement significative, la stéatohépatite, l’infection par le VHC, sont des facteurs de risque de SOS, de toxicité médicamenteuses et d’hépatite ischémique, notamment après greffe de cellules hématopoïétiques allogéniques [5, 9, 51]. La biopsie du foie est la méthode de référence pour évaluer la fibrose hépatique avant un traitement hématologique. Les biomarqueurs de fibrose ne sont pas évalués dans ce contexte. Une endoscopie digestive haute est obligatoire pour les patients atteints de cirrhose avancée. Les patients avec une élasticité hépatique < 20 kPa ont un risque faible de varices œsophagiennes cliniquement significatives [52].
La présence d’une circulation veineuse collatérale sans autre signe clinico-biologique de cirrhose doit faire chercher un SOS infraclinique favorisé par des toxicités sinusoïdales antérieures au cours de traitements d’induction ou de consolidation et/ou par la maladie hématologique sous-jacente. Les hépatopathies chroniques sont des facteurs de risque de décès
Calculs biliaires
Les patients avec des calculs biliaires symptomatiques doivent avoir une cholécystectomie ou une sphinctérotomie avant le traitement hématologique. Les calculs biliaires de la voie biliaire principale doivent être extraits. Les preuves de ces recommandations ne sont pas facilement disponibles, mais, si ces patients développent une cholécystite aiguë ou une septicémie biliaire en période d’aplasie, la prise en charge sera probablement moins efficace dans ces situations aiguës. Il faut traiter la lithiase biliaire avant le traitement hématologique
Surcharge de fer
En raison de transfusions répétées et d’une hyperabsorption du fer en raison d’une hématopoïèse inadaptée, les patients atteint d’hémopathies comme les hémoglobinopathies, les syndromes myélodysplasiques, les leucémies chroniques ou les lymphomes indolents sont à risque de surcharge hépatique en fer. Les grandes surcharges en fer, définies par plus de 12 500 μg par gramme de poids sec (évaluée avec précision par une IRM en séquence T2), ont été associées à une plus grande mortalité sans rechute hématologique après greffe de cellules hématopoïétiques allogéniques. Les causes de décès sont des troubles du rythme cardiaque et des infections fongiques [53].
Syndrome de Gilbert
Les patients avec un syndrome de Gilbert, un trouble polygénique fréquent associé à une hyperbilirubinémie non conjuguée, ont un défaut de glucuronoconjugaison hépatique. Les médicaments habituellement excrétés dans la bile sous forme de glucuronides sont moins détoxiqués au cours du syndrome de Gilbert et peuvent être associés à une toxicité. Le syndrome de Gilbert a été associé à une surmortalité (avec et sans rechute hématologique) 200 jours après conditionnement myéloablatif par BU [54].
Prévention et traitements
Hépatites virales
Si le patient a des signes cliniques d’infection par HSV ou VZV, l’aciclovir doit être débuté immédiatement, dans l’attente des PCR. Les prophylaxies anti-HSV/VZV sont systématiques lorsque les patients sont immunodéprimés, notamment après greffe de cellules hématopoïétiques allogéniques. Environ 5 % des HSV/VZV isolés chez les immunodéprimés sont porteurs de mutations sur le thymidine kinase les rendant résistant à l’aciclovir. Le cidofovir est efficace sur les adénovirus s’il est administré précocement. Un traitement par rituximab peut être administré aux patients atteints de lymphoproliférations EBV-induites ou en préemptif en cas d’augmentation de la charge virale. Un traitement antiviral par ténofovir ou entecavir doit être débuté le jour du début de l’immunodépression pour les patients avec des marqueurs d’infection par le VHB. Les patients anti-HBc positifs doivent recevoir un traitement antiviral avant biothérapie ou greffe de cellules souches hématopoïétiques allogéniques
Un traitement antiviral par ténofovir ou entecavir doit être débuté chez tout patient avec une réactivation VHB. Des cas de réactivation VHB fulminante ont été rapportés après arrêt prématuré du traitement antiviral. Les médicaments anti-VHB ne doivent être interrompus qu’une fois la guérison hématologique prononcée. Tous les patients, en particulier ceux dont l’ADN du VHB est élevé avant la greffe, doivent être surveillés par un dosage de l’ADN du VHB et des ALT sériques après le retrait des antiviraux. Il en est de même pour le VHB. Le traitement du donneur et du receveur et la vaccination du receveur pourraient prévenir la transmission du VHB dans ce contexte. Par ailleurs, l’immunité adoptive contre le VHB peut être transférée à partir de donneurs anti-HBs positifs. L’immunisation des donneurs de cellules hématopoïétiques allogéniques naïfs au VHB peut induire une immunité au VHB chez les receveurs dans les jours ou les semaines qui suivent la transplantation. Des cas de clairance du VHB chez des receveurs porteurs chroniques après greffe de cellules hématopoïétiques allogéniques issues de donneurs immunisés sont rapportés. Théoriquement, l’immunisation des donneurs de cellules hématopoïétiques allogéniques est facile à réaliser et pratiquement sans risque. Le seul facteur limitant cette pratique est le temps de réaliser les trois injections recommandées par le calendrier vaccinal avant la greffe de cellules hématopoïétiques allogéniques. Un calendrier accéléré (jours 0, 10 et 21) est une alternative possible [48]. Un traitement contre le VHC peut être administré après rémission complète de la maladie hématologique. Comme le VHC a été associé au SOS après greffe de cellules hématopoïétiques allogéniques, il convient, dans la mesure du possible, de le traiter avant. Compte tenu du potentiel vital de la greffe de cellules hématopoïétiques allogéniques et des progrès actuels dans le traitement de l’infection par le VHC, des cellules hématopoïétiques allogéniques issues d’un donneur apparenté avec une infection chronique par le VHC pourraient être greffées s’il n’existe pas de donneur VHC négatif possible [55].
Réaction du greffon contre l’hôte
Le traitement de la GVH aiguë est complexe et controversé, en particulier pour les patients qui ne répondent pas au traitement de première intention par la prednisone (1 à 2 mg/kg/jour). Le traitement initial doit tenir compte du risque de récidive de l’hémopathie sous-jacente et de l’effet graft versus leukemia. Le pronostic des patients atteints de GVH hépatique n’est pas corrélé à l’intensité des symptômes, mais plutôt à l’aire sous la courbe d’activité de la maladie. Chez moins de 5 % des allogreffés actuels, la GVH aiguë est une maladie mortelle pour laquelle il n’existe pas de traitement efficace. L’ictère persistant est un facteur indépendant de prédiction de la mortalité [56].
La diminution de l’intensité de l’ictère depuis quelques années peut être attribuée à des schémas thérapeutiques moins intenses, à moins de bactériémies, à un nombre de GVH en diminution et à l’utilisation de l’AUDC pour prévenir la cholestase. L’adoption de la prophylaxie à l’AUDC était fondée sur des données montrant que l’AUDC améliorait les tests hépatiques chez les patients atteints de GVH, réduisait la fréquence de l’ictère et améliorait la survie après greffe [25, 57].
Syndrome d’obstruction sinusoïdale
La majorité des patients avec un syndrome d’obstruction sinusoïdale se rétabliront spontanément
Plus de 70 % des patients diagnostiqués avec un SOS se rétabliront spontanément avec des soins de soutien (gestion des troubles hydro-électrolytiques, néphroprotection avec maintien d’un débit de perfusion rénal satisfaisant et ponctions d’ascite et/ou pleurales itératives en cas d’ascite associée à une gêne). Les patients avec un mauvais pronostic peuvent être identifiés par de fortes augmentations de la bilirubine sérique totale et du poids, des valeurs sériques d’ALT à 20N, des pressions portales supérieures à 20 mmHg, le développement d’une thrombose de la veine porte et la défaillance multiviscérale. Il n’y a pas de traitement satisfaisant pour le SOS sévère. Les meilleurs résultats sont rapportés avec le défibrotide par voie intraveineuse (25 mg/kg/jour). Des cas de mise en place de TIPS dans un contexte de SOS sont rapportés de manière anecdotique. Le TIPS n’a pas montré d’efficacité dans cette indication et a été associé à une surmortalité. Des greffes hépatiques ont été un succès dans certains cas de SOS grave, mais dans la plupart des centres, les patients atteints de SOS sévère ne sont pas candidats prioritaires pour la greffe de foie en raison des risques de développer une GVH et de la réapparition de leur néoplasie sous-jacente.
Surcharge de fer
Chez les patients avec une surcharge en fer extrême, un traitement efficace par chélation avant la greffe de cellules hématopoïétiques allogéniques améliore la survie post greffe. Après une greffe de cellules hématopoïétiques allogéniques, une surcharge en fer sévère a été associée à un dysfonctionnement hépatique non spécifique pouvant répondre à un traitement par saignée associée à un traitement par EPO ou à une chélation. La quantification du fer pourra être réalisée chez la plupart des patients à distance de la greffe de cellules hématopoïétiques allogéniques [58].
Conclusion
En cinquante ans, on peut dire que les atteintes hépatiques associées aux traitements hématologiques ont été débroussaillées, élucidées, catégorisées, et traitées. La plupart des problèmes historiques des patients d’hématologie, infections, cholestases, SOS mortels, peuvent être prévenus, et traités avec des résultats tout à fait satisfaisants. Les consultants qui seront amenés à évaluer les patients d’hématologie dans le futur seront certainement confrontés à de nouveaux problèmes de foie associées à la prise de nouveaux médicaments, à l’instar des anticorps immunoconjugués et des immunothérapies, dont le profil de sécurité hépatique est mal connu, surtout lorsqu’ils sont administrés à des personnes fragiles, souvent en échec de précédentes lignes thérapeutiques, souvent âgées. Les traitements par CAR-T et par thérapie génique sont en tête de peloton. Le rôle de ces médecins sera d’accompagner les patients au cours de leurs traitements pour qu’ils puissent avoir la dose adéquate de chimiothérapie et guérir du cancer.Take home messages
Remerciements
les auteurs remercient le Professeur Olivier Hermine pour ses commentaires sur le manuscrit.
Liens d’intérêts
les auteurs déclarent n’avoir aucun lien d’intérêt en rapport avec l’article.
1 https://livertox.nih.gov
![]() Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International
Cette œuvre est mise à disposition selon les termes de la
Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Pas de Modification 4.0 International