Hépato-Gastro & Oncologie Digestive
MENUDépistage et prévention des polypes coliques Volume 10, numéro 4, Juillet 2003
- Page(s) : 323-5
- Année de parution : 2003
Auteur(s) : par Thierry Piche
Joseph Sung JY, Francis Chan KL, Wai Leung K, Justin Wu CY, James Lau YW, Ching J, et al. Screening for colorectal cancer in Chinese : comparison of fecal occult blood test, flexible sigmoidoscopy, and colonoscopy. Gastroenterology 2003 ; 124 : 608-14Le cancer colorectal (CCR) constitue la deuxième cause de décès
par cancer dans les pays occidentaux. Dans certains pays asiatiques
comme la Chine, son incidence a augmenté de manière considérable en
raison du vieillissement de la population [1]. Son dépistage est
possible par la recherche d'un saignement occulte dans les selles
(FOBT) dans le cadre d'un dépistage de masse soumis à des
conditions strictes de réalisation. Il a également été montré que
le dépistage du CCR par FOBT [2, 3] ou sigmoïdoscopie [3] réduisait
la mortalité de ce cancer. Malgré ces données encourageantes, la
FOBT a une mauvaise sensibilité pour la détection des polypes et
donne souvent des faux positifs. La sigmoïdoscopie et la coloscopie
totale ont une sensibilité élevée, mais ne répondent certainement
pas aux critères d'acceptabilité et d'innocuité d'un test de
dépistage de masse. Quelques auteurs ont montré que des néoplasies
coliques n'étaient pas mises en évidence quand une sigmoïdoscopie
était proposée en première intention pour le dépistage du CCR dans
des populations à risque moyen [4, 5]. Enfin, la combinaison d'une
FOBT et d'une sigmoïdoscopie ne mettrait en évidence que 75 %
des lésions détectées par une coloscopie totale [5]. Ces résultats
sont issus d'études effectuées chez des sujets de même ethnie ou de
même sexe et ne sont pas extrapolables à l'ensemble de la
population générale.
Les buts de cette étude chinoise, pays où l'incidence du CCR a
considérablement augmenté, étaient de comparer ces trois procédures
de dépistage (FOBT, sigmoïdoscopie et coloscopie) chez des adultes
de plus de 50 ans asymptomatiques et sans antécédent familial
de cancer du côlon (population à risque moyen de CCR). Cinq cent
cinq sujets (56 % de femmes, âge moyen
56,5 ± 5,4 ans) ont été inclus et 476 ont bénéficié
d'une coloscopie totale sous anesthésie générale et d'une FOBT. Une
lésion colique évoluée était définie par un adénome de taille
supérieure à 10 mm de diamètre, un adénome villeux en
dysplasie modérée à sévère ou un cancer invasif. Les lésions
observées jusqu'à 40 cm de la marge anale étaient considérées
comme accessibles à une sigmoïdoscopie. Soixante-trois sujets
étaient porteurs d'un cancer (12,5 %) dont 45 au niveau du
côlon distal et 26 dans le côlon proximal. Parmi les
385 sujets qui avaient un côlon distal normal, 14 (3,6 %)
avaient des lésions dans le côlon proximal qui n'auraient pas été
mises en évidence si une sigmoïdoscopie seule avait été réalisée.
La sensibilité et la spécificité de la FOBT pour le diagnostic des
lésions coliques évoluées étaient respectivement de 14,3 % et
79,2 %, et celles de la sigmoïdoscopie atteignaient
77,8 % et 83,9 %. La combinaison de la FOBT et de la
sigmoïdoscopie n'aurait pas amélioré significativement les
résultats de la sigmoïdoscopie seule. Dans ce travail, aucune
perforation n'a été rapportée et une seule hémorragie est survenue
au décours d'une polypectomie. Bien que les définitions des lésions
coliques évoluées varient sensiblement d'une étude à l'autre [4,
5], les résultats de ce travail montrent que la coloscopie totale
est supérieure à la sigmoïdoscopie et/ou à la FOBT pour le
dépistage du cancer du côlon chez des sujets à risque moyen de CCR.
Le débat sur les modalités de dépistage du CCR n'est pas
terminé…
Baron JA, Cole BF, Sandler RS, Haile RW, Ahnen D, Bresalier R, et al. A randomized trial of aspirin to prevent colorectal adenomas. N Engl J Med 2003 ; 348 : 891-9
Plusieurs travaux fondamentaux, cliniques ou épidémiologiques,
ont étayé l'hypothèse d'un rôle protecteur de l'aspirine et des
AINS dans la cancérogenèse colique [6-8]. Ces études ont fourni des
résultats globalement similaires avec une réduction du risque de
néoplasie d'environ 40 à 50 %, quels que soient l'âge, le
sexe, l'ethnie, le lieu de l'étude ou la localisation de la tumeur
dans le côlon. Dans la polypose adénomateuse familiale, le sulindac
[9] ou le celecoxib [10] se sont également montrés efficaces avec
une réduction du nombre et de la taille des adénomes chez les
malades traités. Les mécanismes par lesquels l'aspirine exerce ses
effets protecteurs ne sont pas clairement élucidés. L'inhibition
des cyclo-oxygénases (COX) et de la synthèse des prostaglandines
pourrait être à l'origine des effets anti-carcinogènes de
l'aspirine. En effet, l'expression de COX2 est augmentée dès le
stade d'adénome et est très élevée dans la majorité des CCR.
Pourtant, de nombreuses incertitudes freinent l'étape de la
recommandation en prévention primaire. Les études réalisées
jusqu'ici n'ont pas permis de préciser une relation entre la dose
et/ou la durée du traitement et les effets observés. Les AINS, dont
l'aspirine, ont une toxicité digestive indiscutable, même si les
faibles doses (300 mg/j) ont moins d'effets secondaires et
sont actuellement recommandées en prévention des maladies
cardiovasculaires après 50 ans. Des observations de cancer
rectal ont été rapportées chez des malades atteints de polypose
adénomateuse familiale soumis à un traitement préventif par
sulindac. Enfin, en l'état actuel des connaissances, les effets
bénéfiques de l'aspirine en prévention du CCR ne peuvent pas être
extrapolés au CCR qui survient de manière sporadique.
Baron et al. [13] ont évalué l'efficacité de l'aspirine
dans une étude randomisée en double aveugle pour prévenir la
récidive des polyadénomes. Mille cent vingt et un malades porteurs
d'adénomes du côlon ont été inclus pour recevoir le placebo
(n = 372), 81 mg (n = 377) ou 325 mg
(n = 372) d'aspirine par jour. Une coloscopie était
effectuée 3 ans après le diagnostic initial de polype
adénomateux du côlon. Dans ce travail, le risque relatif de
survenue des adénomes était de 0,81 dans le groupe aspirine
81 mg (IC95 % = 0,69-0,96) et 0,96 dans le
groupe aspirine 325 mg (IC95 % = 0,81-1,13).
Une analyse sur les lésions coliques avancées (adénome de
taille > 1 cm ou comportant un contingent
villeux, tubulovilleux des dysplasies sévères ou un cancer)
montrait des risques relatifs de 0,59
(IC95 % = 0,38-0,92) et de 0,83
(IC95 % = 0,55-1,23). Finalement on peut conclure à
une réduction significative du risque de récidive des adénomes de
19 % dans le groupe aspirine 81 mg, une réduction non
significative de 4 % dans le groupe aspirine 325 mg et de
12 % dans le groupe aspirine, quelle que soit la dose.
Cette étude montre que l'aspirine à faibles doses a un effet
bénéfique modéré pour prévenir la récidive des adénomes coliques.
La réduction du risque étant plus importante pour les lésions
coliques avancées, cela suggère que l'aspirine pourrait intervenir
essentiellement sur les dernières étapes de la transformation des
polypes en cancer. L'absence d'effet protecteur aux doses de
325 mg reste mal comprise. En admettant que l'effet
anti-carcinogène de l'aspirine s'exerce par une inhibition des COX,
plusieurs études pharmacologiques ont montré que l'administration
orale de 81 mg ou de 325 mg supprimaient les
prostaglandines coliques de manière identique, ce qui suggère que
l'effet clinique devrait être identique.
En conclusion, cette étude confirme que l'aspirine réduit le
risque de récidive des adénomes coliques. L'idée de son utilisation
en prévention primaire du cancer colorectal est certainement
séduisante, mais doit être replacée dans le contexte de sa toxicité
gastro-intestinale et surtout de l'efficacité démontrée de la
surveillance endoscopique dans cette population.
Sandler RS, Halabi S, Baron JA, Budinger S, Paskett E, Keresztes R, et al. A randomized trial of aspirin to prevent colorectal adenomas in patients with previous colorectal cancer. N Engl J Med 2003 ; 348 : 883
La plupart des cancers colorectaux (CCR) surviennent dans
l'évolution naturelle des polyadénomes qui constituent une cible
privilégiée pour élaborer des stratégies de prévention primaire du
CCR. Les études qui ont évalué les effets de l'administration
régulière de fibres alimentaires [11] ou de vitamines
anti-oxydantes [12] ont donné des résultats négatifs alors que le
calcium a montré qu'il avait un effet protecteur contre les polypes
[13]. Bien que l'effet anti-carcinogène de l'aspirine soit bien
établi, son utilisation pour prévenir la survenue des polypes n'est
pas recommandée en raison de sa toxicité gastro-intestinale et d'un
effet protecteur qui reste modéré. La majorité des études de
prévention du CCR par l'aspirine ont été réalisées chez des sujets
à risque moyen de CCR.
Dans la présente étude, Sandler et al. ont formulé
l'hypothèse d'un effet protecteur plus élevé chez des sujets à haut
risque de CCR et ont évalué une population ayant un antécédent
personnel de CCR. Six cent trente-cinq malades ayant un antécédent
de cancer du côlon ont été inclus et recevaient 325 mg
d'aspirine par jour ou un placebo. Le but de l'étude était de
déterminer la proportion de malades qui présentaient de nouveaux
adénomes, leur nombre et le délai de leur survenue depuis la
randomisation. Les risques relatifs étaient ajustés sur l'âge, le
sexe, le stade du CCR, le nombre de coloscopies effectuées et le
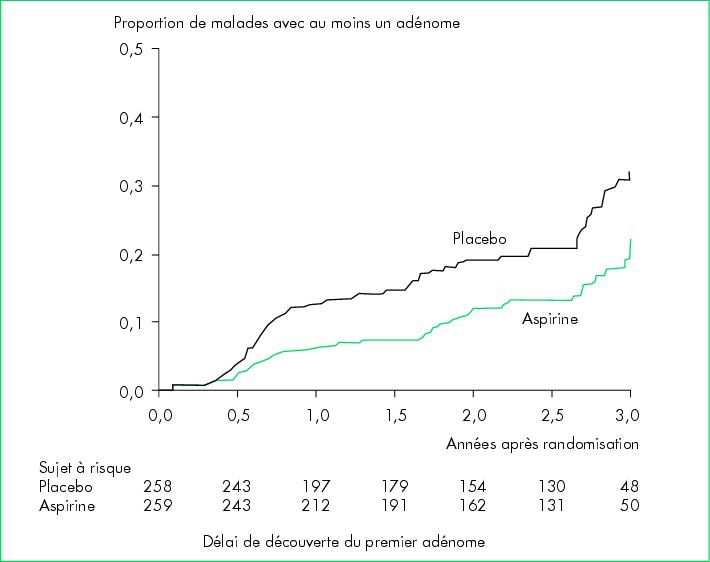
délai par rapport à la première coloscopie. Cinq cent dix-sept
malades avaient bénéficié d'au moins une coloscopie dans un délai
médian de 12,8 mois après la randomisation. Dans le groupe
aspirine, 17 % des malades présentaient un adénome (ou plus)
contre 27 % dans le groupe placebo (p = 0,004). Le
nombre moyen d'adénomes observés dans le groupe aspirine était
significativement plus faible (0,30 ± 0,87) que dans le
groupe placebo (0,49 ± 0,99, p = 0,003). Dans
le groupe aspirine, le risque relatif de survenue d'un adénome
atteignait 0,65 (IC95 % = 0,46-0,91). Le délai de
survenue d'un nouvel adénome était plus long dans le groupe
aspirine que dans le groupe placebo (figure).
Cette étude montre que l'aspirine est efficace pour prévenir la
récidive des adénomes coliques chez des malades ayant un antécédent
personnel de CCR. Elle a été interrompue plus tôt que prévu en
raison de l'effet protecteur net de l'aspirine et de la très bonne
tolérance à cette posologie. Il est probable que la sélection de
malades à haut risque d'adénomes explique ces résultats. La
posologie la plus efficace reste encore à préciser puisque
325 mg d'aspirine avaient un effet protecteur significatif
dans le travail de Sandler et al. mais pas dans celui de
Baron et al. Comme dans le travail précédent, les auteurs
suggèrent que l'effet bénéfique de l'aspirine en prévention de la
récidive des adénomes coliques mériterait d'être comparé à celui
des programmes de surveillance endoscopique avant d'envisager des
recommandations.
Références
1. Yuen ST, Chung LP, Leung SY, Luk IS, Chan SY, Ho JC, et al. Colorectal carcinoma in Hong Kong : epidemiology and genetic mutations. Br J Cancer 1997 ; 76 : 1610-6.
2. Kronborg O, Fenger C, Olsen J, Jorgensen OD, Sondergaard O. Randomised study of screening for colorectal cancer with faecal-occult-blood test. Lancet 1996 ; 348 : 1467-71.
3. Mandel JS, Church TR, Bond JH, Ederer F, Geisser MS, Mongin SJ, et al. The effect of fecal occult-blood screening on the incidence of colorectal cancer. N Engl J Med 2000 ; 343 : 1603-7.
4. Imperiale TF, Wagner DR, Lin CY, Larkin GN, Rogge JD, Ransohoff DF. Risk of advanced proximal neoplasms in asymptomatic adults according to the distal colorectal findings. N Engl J Med 2000 ; 343 : 169-74.
5. Lieberman DA, Weiss DG. One-time screening for colorectal cancer with combined fecal occult-blood testing and examination of the distal colon. N Engl J Med 2001 ; 345 : 555-60.
6. Thun MJ, Namboodiri MM, Heath CW. Aspirin use and reduced risk of fatal colon cancer. N Engl J Med 1991 ; 325 : 1593-6.
7. Giovannucci E, Egan KM, Hunter DJ, Stampfer MJ, Colditz GA, Willett WC, et al. Aspirin and the risk of colorectal cancer in women. N Engl J Med 1995 ; 333 : 609-14.
8. Kune GA, Kune S, Watson LF. Colorectal cancer risk, chronic illnesses, operations, and medications : case control results from the Melbourne Colorectal Cancer Study. Cancer Res 1988 ; 48 : 4399-404.
9. Labayle D, Fischer D, Vielh P, Drouhin F, Pariente A, Bories C, et al. Sulindac causes regression of rectal polyps in familial adenomatous polyposis. Gastroenterology 1991 ; 101 : 635-9.
10. Steinbach G, Lynch PM, Phillips RK, Wallace MH, Hawk E, Gordon GB, et al. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N Engl J Med 2000 ; 342 : 1946-52.
11. Alberts DS, Martinez ME, Roe DJ, Guillen-Rodriguez JM, Marshall JR, van Leeuwen JB, et al. Lack of effect of a high-fiber cereal supplement on the recurrence of colorectal adenomas. Phoenix Colon Cancer Prevention Physicians' Network. N Engl J Med 2000 ; 342 : 1156-62.
12. Greenberg ER, Baron JA, Tosteson TD, Freeman DH, Beck GJ, Bond JH, et al. A clinical trial of antioxidant vitamins to prevent colorectal adenoma. Polyp Prevention Study Group. N Engl J Med 1994 ; 331 : 141-7.
13. Baron JA, Beach M, Mandel JS, van Stolk RU, Haile RW, Sandler RS, et al. Calcium supplements for the prevention of colorectal adenomas. Calcium Polyp Prevention Study Group. N Engl J Med 1999 ; 340 : 101-7.