e-VEGF-IMMUNO-actu
MENUOncologie thoracique Volume 10, issue 2, Juillet-août 2015
Mésothéliome pleural
Bévacizumab et chimiothérapie de 1re ligne : résultat positif de l’essai MAPS
Lors du congrès ASCO 2015, à côté des succès remportés par l’immunothérapie dans les carcinomes métastatiques non à petites cellules, un autre résultat a marqué le domaine de l’oncologie thoracique. Il s’agit de la présentation par G. Zalcman des résultats de l’essai de phase III randomisé MAPS, porté par l’IFCT et le GFPC. Cet essai a évalué les effets de l’adjonction du bévacizumab à l’association cisplatine – pémétrexed dans le mésothéliome pleural (MP) non résécable [1]. Ces résultats étaient très attendus dans la mesure où cette pathologie redoutable n’a pas vraiment bénéficié d’apport significatif depuis la publication de Vogelzang en 2003, qui a positionné l’association cisplatine – pémétrexed comme étant la chimiothérapie de référence [2]. L’essai MAPS IFCT-GFPC 07-01 a mobilisé 73 centres français entre 2008 et 2014.
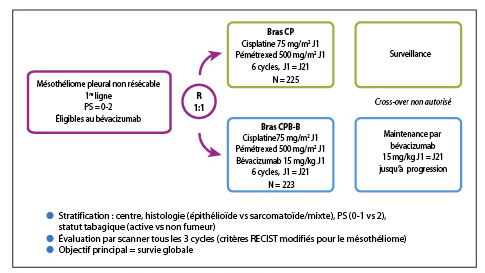
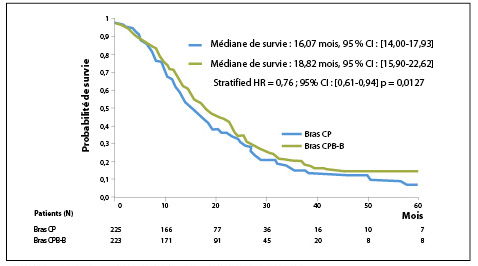
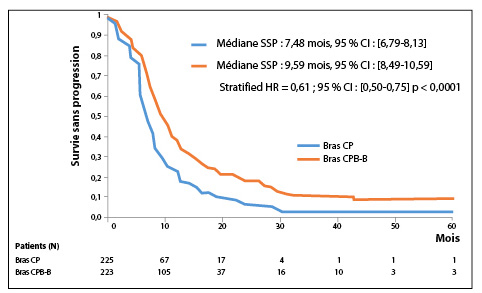
Les patients ont été randomisés dans deux groupes : bras CP : 6 cures de cisplatine – pémétrexed (n = 225) et bras CPB-B : 6 cures de cisplatine – pémétrexed – bévacizumab avec bévacizumab en maintenance (n = 223) (figure1). Les caractéristiques cliniques et histologiques sont comparables dans les 2 bras. Les doses utilisées étaient habituelles : 75 mg/m² pour le cisplatine, 500 mg/m² pour le pémétrexed et 15 mg/kg toutes les 3 semaines pour le bévacizumab. L’objectif principal a été atteint avec un bénéfice significatif de survie globale (SG) en faveur du bras cisplatine – pémétrexed – bévacizumab. La réduction du risque de décès était de 24 % dans le bras comportant l’anticorps anti-VEGF avec une médiane de SG de 18,8 mois versus 16,1 mois dans le bras standard (HR : 0,76, IC 95% [0,61-0,94], p = 0,012) (figure 2). La médiane de survie sans progression était également améliorée dans le bras CPB-B, avec à 9,6 mois versus 7,5 mois dans le bras standard (HR : 0,62, IC 95% [0,5-0,75], p < 0,0001) (figure 3). Les auteurs n’ont pas observé de différences entre les 2 bras pour la toxicité hématologique et ont signalé, de façon non surprenante, une majoration significative des toxicités spécifiques de l’agent anti-angiogénique : HTA (gr 3 ; bras CPB-B : 23 % vs. 0 % bras CP), protéinurie (gr 3 ; bras CPB-B : 3 % vs. 0 % bras CP) et de thrombose artérielle
(gr 3 ; bras CPB-B : 2,7 % vs. 0 % bras CP). Ce résultat positif représente donc un tournant dans la prise en charge des patients atteints de mésothéliome pleural non résécable. Les futures recommandations devraient intégrer cette nouvelle donnée pour situer, chez les patients éligibles au bévacizumab, la combinaison cisplatine – pémétrexed – bévacizumab comme traitement de référence de 1re ligne du mésothéliome pleural non résécable.
NGR-hTNF et chimiothérapie en 2e ligne : peu d’espoir
Cet agent anti-vasculaire, NGR-hTNF, a été testé, en association à une chimiothérapie de 2e ligne laissée au choix des investigateurs (gemcitabine, vinorelbine ou doxorubicine) en comparaison avec un placebo [3]. Deux cents patients ayant progressé après une 1re ligne à base de pémétrexed ont été inclus dans chaque bras. Dans le bras expérimental NGR-hTNF - chimiothérapie, la survie globale n’a pas été significativement améliorée par rapport au bras chimiothérapie - placebo (médianes : 8,4 vs. 7,9 mois [HR = 0,94, p = 0,61]). Il semble difficile de pronostiquer un avenir à cet agent anti-vasculaire, même si les auteurs rapportent un bénéfice de survie pour le NGR-hTNF dans le sous-groupe prédéfini de patients présentant un intervalle libre avant inclusion inférieur à 4,8 mois (n = 198, médiane de 9,0 vs. 6,3 mois et survie à 1 an de 39 % vs. 23 % HR = 0,65 p = 0,01) [4]. À ce jour, le bévacizumab reste donc le seul anti-angiogénique ayant montré une efficacité dans le mésothéliome pleural, sous réserve d’être associé à une chimiothérapie à base de pémétrexed. Au même titre que dans le CBNPC métastatique, la question du maintien du bévacizumab lors de la progression se pose. Cette option devrait faire l’objet, au même titre que l’immunothérapie, de nouvelles évaluations cliniques dans le mésothéliome pleural.
Cancer bronchique non à petites cellules (CBNPC)
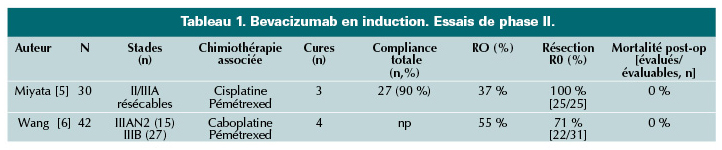
Bévacizumab en induction (tableau 1)
L’essai de phase II de Miyata et al. [5] aborde la question du taux de résection complète (R0) après induction par 3 cures de bévacizumab (15 mg/kg) – cisplatine (75 mg/m2) – pémétrexed (500 mg/m2) dans les adénocarcinomes II/IIIA résécables. Trente patients ont été inclus, 27 patients (90 %) ont reçu l’induction prévue. Les auteurs rapportent une réponse partielle dans 37 % des cas. Parmi les 25 patients opérés, la résection était complète dans tous les cas, sans mortalité post-opératoire. Sous réserve d’une sélection des patients et d’un management approprié, avec notamment arrêt de l’anti-angiogénique 3-4 semaines avant la chirurgie, l’adjonction en induction du bévacizumab semble non seulement faisable mais aussi efficace en terme de réduction du volume tumoral. L’induction passera-t-elle sous peu par un triplet ?
Un essai de phase II chinois a évalué l’impact de 4 cures d’induction par bévacizumab (7,5 mg/kg) – pémétrexed (500 mg/m2) – carboplatine (AUC = 5) sur la résécabilité des adénocarcinomes de stade III initialement non résécables (15 cas de bulky N2 et 27 stades IIIB) [6]. Après cette induction, les auteurs obtiennent une réponse complète et 22 réponses partielles parmi les 42 patients inclus. Trente et un patients (74 %) ont pu être opérés, dont 11 par pneumonectomie. La résection était complète chez 22 patients. La tolérance de ce schéma multimodal semble correcte, sans complication spécifique de type hémorragie et/ou défaut de cicatrisation ; la mortalité post-opératoire a été nulle et la survie sans progression à 1 an de 56,1 %. Dans les stades III jugés non résécables après avis multidisciplinaire (RCP), les recommandations sont en faveur de la radio-chimiothérapie. Cet essai, même s’il ne peut remettre en cause cette orientation, prouve qu’une discussion au cas par cas reste parfois utile.
Bévacizumab au-delà de la progression
L’intergroupe japonais WJOG a présenté les résultats de son essai multicentrique randomisé de phase II qui a comparé docétaxel (60 mg/m2) à docétaxel (60 mg/m2) – bévacizumab (15 mg/kg) toutes les 3 semaines chez des patients métastatiques ayant progressé après leur 1re ligne à base de platine et bévacizumab [7]. La médiane de survie sans progression (objectif principal) est de 4,4 mois dans le bras doc + bev (n = 50) et de 3,4 mois dans le bras doc (n = 50) (HR : 0,71, p = 0,058). La médiane de survie globale est supérieure dans le bras doc + bev sans toutefois atteindre la significativité (13,1 vs. 11 mois, HR : 0,74, p = 0,11). Le taux de neutropénie fébrile est de 26 % dans les 2 bras avec 1 décès toxique dans chaque bras. Les résultats de l’essai de phase III AVALL sont attendus.
Le bio-similaire qui venait du froid
Le BCD-021 est décrit comme un bio-similaire du bévacizumab. Cet agent a été comparé au bévacizumab dans un essai multicentrique impliquant exclusivement l’Ukraine et la Russie [8]. Un total de 138 patients atteints de CBPNC non épidermoïdes de stade IIIb/IV ont reçu le BCD-021 ou le bévacizumab (15 mg/kg) en association au paclitaxel (175 mg/m2) - carboplatine (AUC 6). Les auteurs ne rapportent aucune différence significative entre les 2 bras en termes de réponse objective et de toxicités. Les auteurs n’apportent par ailleurs aucune donnée médico-économique.
Pazopanib en adjuvant : pas de perspective dans les stades IA
Le pazopanib est un inhibiteur multi-cibles des VEGFR (VEGFR1, 2, 3), PDGFR (α, β) et KIT. En inhibant l’autophosphorylation du VEGFR2 induite par le VEGF, il inhibe la croissance tumorale et l’angiogenèse. Ces propriétés justifient, entre autres, son évaluation en situation adjuvante lorsque la masse tumorale a été réduite par un geste radical. Les résultats de survie de l’essai de phase II non comparatif IFCT 0703 ont été rapportés par B. Besse. Rappelons qu’il s’agit d’un essai évaluant le pazopanib, en adjuvant, versus placebo dans les stades IA [9]. Soixante et onze patients ont été inclus dans le bras placebo et 71 l’étaient dans le bras pazopanib. 72 % des patients étaient au stade pIA et 16 % atteints de carcinome épidermoïde. La posologie a rapidement été réduite de 800 à 400 mg/j pour améliorer la compliance des patients au traitement. Sous pazopanib, les toxicités de grade 3 les plus fréquentes ont été les diarrhées, l’HTA et la cytolyse hépatique. Ces effets secondaires étaient corrélés à la dose de pazopanib : respectivement 9 %, 13 %, et 16 % pour la dose de 800 mg/j et 6 %, 6 %, 0 % pour celle de 400 mg/j. L’essai est négatif ; le taux de survie sans maladie à 3 ans est de 77 % dans le bras pazopanib et de 83 % dans le placebo (HR : 1,3, p = 0,53). Les taux de survie à 5 ans ne sont pas significativement différents (83 % vs. 94 %, HR : 1,9, p = 0,27). La recommandation actuelle en faveur d’une surveillance dans les stades IA réséqués reste donc de mise.
Liens d’intérêts : Participation à un essai clinique Roche.