Médecine de la Reproduction
MENUMicrofluidics for reproductive medicine Volume 24, issue 1, Janvier-Février-Mars 2022
Microfluidique et organe-sur-puce
Brève introduction à la microfluidique
La microfluidique peut être définie comme la science des écoulements à petite échelle, dans des structures et des canaux de taille micrométrique [1]. Les systèmes microfluidiques, qui sont aussi connus sous le nom de laboratoires-sur-puce, sont des dispositifs ayant une taille comparable à celle d’un timbreposte (quelques centimètres carrés) et qui comportent des structures micrométriques utilisées pour l’écoulement de fluides, le plus souvent en phase liquide mais aussi en phase gazeuse (figure 1A,B).
Les premiers dispositifs microfluidiques ont été réalisés dans l’optique de miniaturiser un laboratoire d’analyses dans une puce portative, pour réaliser des analyses complexes directement sur le terrain, au lieu de transporter les échantillons à analyser dans un laboratoire centralisé. Les champs d’application visés initialement étaient la surveillance de l’environnement, les analyses médicales ou la médecine légale. À l’heure actuelle, les champs d’application sont fort divers, allant de l’analyse moléculaire et biomoléculaire à la réalisation de modèles cellulaires complexes, en passant par la synthèse organique et des études physiques et chimiques fondamentales.
Outre la possibilité de conduire des analyses en continu et/ou en temps réel sur le terrain et le gain de temps évident qui en découle, cette approche miniaturisée apporte un grand nombre d’avantages. Si le système d’analyse est entièrement intégré et automatisé, la manipulation des échantillons est bien moindre, ce qui se traduit par une diminution des risques de perte et de contamination des échantillons. Par ailleurs, diminuer les tailles internes et caractéristiques des systèmes s’accompagne non seulement d’un gain de temps mais aussi d’une meilleure sensibilité des analyses, et d’un besoin moindre en échantillon, ce qui est particulièrement intéressant dans le domaine médical. Les écoulements dans les systèmes microfluidiques sont laminaires et non turbulents (figure 1B) ; de ce fait, les flux sont prévisibles et très contrôlés, et se prêtent bien à la formation de gradients de facteurs solubles. De surcroît, tous les phénomènes de transport (surfaciques et massiques) sont plus efficaces dans des systèmes miniaturisés. Enfin, les dimensions caractéristiques dans ces systèmes microfluidiques sont similaires aux dimensions rencontrées dans le corps humain, ce qui permet de confiner des cellules biologiques dans des volumes et des structures réduits, et d’ainsi recréer leur microenvironnement physicochimique.
Un autre argument, fréquemment mis en avant, est lié au coût des procédures. Cette réduction (hypothétique) des coûts trouve plusieurs origines : celui des dispositifs (coût de fabrication), des réactifs et du fonctionnement. Si les dispositifs sont produits à grande échelle, leur coût nominatif en diminuera autant. De même, si les volumes sont réduits pour l’analyse, les quantités de réactifs s’en trouveront réduites. Enfin, pour des systèmes plus petits, les besoins énergétiques, que ce soit pour déplacer les liquides ou effectuer des mesures électriques, sont aussi diminués, ce qui contribue au gain financier global des analyses sur puce microfluidique. Finalement, ces systèmes sont caractérisés par une forte intégration, celle-ci se traduisant par un multiplexage des opérations sur un dispositif unique, la réalisation de processus analytiques complexes comprenant plusieurs étapes, ou l’incorporation dans les structures microfluidiques d’éléments actifs comme des capteurs ou des actuateurs, ou pour réguler la température, par exemple.
Les premiers dispositifs microfluidiques ont été fabriqués en silicium et/ou en verre à l’aide de techniques issues de l’industrie microélectronique, dans des salles blanches. Les matériaux polymériques connaissent actuellement un essor notable ; ils sont moins onéreux et leur usinage ne nécessite pas d’accès a priori à un environnement particulier. Les techniques de fabrication qui dominent pour ces matériaux sont le moulage par polymérisation ou embossage à chaud, et le micro-usinage, suivant le type de polymères utilisés. L’impression en trois dimensions commence aussi à être utilisée, même si cette dernière approche est souvent contestée en termes de résolution (taille des structures à réaliser) et de biocompatibilité, en particulier en absence de post-traitement des structures imprimées en trois dimensions.
Qu’est-ce qu’un organe-sur-puce ?
Les organes-sur-puce sont des produits dérivés de la microfluidique. Un organe-sur-puce est un modèle miniature d’un organe humain réalisé dans une puce microfluidique, reproduisant des éléments clés structuraux et fonctionnels de l’organe modélisé (figure 2) [2]. Ces modèles hybrides allient des microstructures, pour mimer certains aspects de l’architecture de l’organe, des cellules humaines (et souvent plusieurs types cellulaires) et, dans certains cas, des biomatériaux et/ou hydrogels, visant à mimer la matrice extracellulaire. Les cellules sont cultivées en trois dimensions dans ces modèles, sous perfusion continue, et le système peut aussi inclure des éléments de stimulation physique active des cellules (cisaillement, compression, étirement, simulation électrique, etc.). Enfin, afin d’étudier des processus plus complexes, mettant en jeu plusieurs organes, des modèles combinant plusieurs organes-sur-puce peuvent êre envisagés [3].
Ce terme générique d’organe-sur-puce regroupe plusieurs stratégies de développement, en fonction de l’organe modélisé et de l’application visée. Une première stratégie est d’utiliser l’outil microfluidique comme un bioréacteur miniaturisé, pour la culture de cellules dans un environnement dynamique et contrôlé, offrant la possibilité de stimuler les cellules sur demande, que ce soit de façon transitoire ou continue. Dans ce cas, les cellules sont introduites dans le système soit dans une matrice de type hydrogel, soit sous forme d’agrégats tridimensionnels (sphéroïdes ou organoïdes), ou encore de biopsies (culture ex vivo). Une autre stratégie, plus complexe, vise à incorporer des microstructures dans le système ou à modeler une matrice d’hydrogel pour reproduire certains éléments architecturaux de l’organe, comme une barrière physiologique, des structures cylindriques pour créer des vaisseaux sanguins ou tout autre tissu présentant un lumen [4]. Par exemple, pour modéliser une barrière physiologique, la puce microfluidique comprendra deux compartiments séparés par une membrane poreuse horizontale, sur laquelle des cellules épithéliales sont cultivées sous flux (compartiment apical), et sous laquelle des cellules endothéliales sont ensemencées pour reproduire la circulation (compartiment basolatéral) [5]. Ce format est particulièrement intéressant pour étudier la communication chimique ou biochimique entre différents types cellulaires, puisque la membrane permet le transport moléculaire, tout en bloquant la migration des cellules (tant que la taille des pores est inférieure à quelques microns).
Quelles applications pour la microfluidique et les organes-sur-puce ?
La microfluidique est née du besoin d’avoir des dispositifs portatifs pour conduire des analyses moléculaires ou biomoléculaires sur le terrain. Depuis, ce domaine a connu un essor important et une forte diversification de ses applications. Dans le cadre de cette mini-revue, nous nous intéresserons tout particulièrement à trois types d’applications pertinentes pour la biologie et la médecine de la reproduction : les dispositifs d’analyse médicale dits point-of-care (POC), les systèmes d’analyse et d’expérimentation à l’échelle de la cellule unique et les modèles cellulaires plus complexes de type organe-sur-puce.
Les dispositifs de type POC sont développés à plusieurs fins :
- –utilisation par le patient à la maison (test de grossesse, test d’ovulation, surveillance du taux de glucose, etc.),
- –par du personnel hospitalier aux urgences ou auprès du patient, dans son lit d’hôpital, pour une réponse rapide sur sa condition,
- –par le médecin traitant, dans la même optique de diagnostic rapide,
- –dans des pays en développement n’ayant pas toujours accès à une infrastructure médicalisée sophistiquée.
Ce sous-domaine de la microfluidique est en plein essor, avec la décentralisation actuelle des soins et le développement de la télémédecine.
Du fait de leur taille micrométrique et des faibles volumes internes, les systèmes microfluidiques se sont révélés être des outils puissants pour manipuler et analyser des cellules uniques [6]. Les cellules peuvent facilement être capturées à l’aide de microstructures ou dans des chambres ou gouttelettes présentant un volume « comparable » à celui des cellules (de l’ordre du nanolitre, voire du picolitre), stimulées sur demande, suivies au cours du temps par microscopie ou caractérisées en termes de métabolisme, de profil sécrétoire, de propriétés mécaniques ou d’un point de vue moléculaire plus global.
Même si le troisième sous-domaine des organessur-puce ou modèles cellulaires complexes est beaucoup plus récent, sa croissance ces dernières années a été vertigineuse, ce qui peut s’expliquer par le potentiel énorme de ces mini-organes humains et la pression globale à limiter, remplacer et raffiner les expériences sur les animaux [7]. Les applications de ces modèles sont multiples : dans le secteur de l’ingénierie tissulaire, pour réaliser des tests de criblage à haut débit de médicaments ou de substances potentiellement toxiques, pour conduire des études métaboliques (ADME, pour absorption, distribution, métabolisme et excrétion), créer des modèles de maladie afin de mieux appréhender les mécanismes moléculaires et cellulaires en jeu dans leur apparition et leur progression, ou encore pour identifier de nouvelles cibles thérapeutiques.
Les apports potentiels de la microfluidique à la médecine et à la biologie de la reproduction
Sur la base de ces applications phares de la microfluidique, plusieurs pistes se dessinent quant à son utilisation dans le cadre de la biologie et de la médecine de la reproduction. Tout d’abord, les dispositifs de type POC peuvent être utilisés non seulement pour déterminer la période d’ovulation (dispositifs déjà sur le marché) mais aussi pour une première analyse du sperme dans le confort de son chez-soi, pour évaluer la concentration en spermatozoïdes et/ou identifier des anomalies patentes comme une motilité altérée ou des aberrations morphologiques sévères. Dans le cadre du laboratoire spécialisé, l’outil microfluidique peut servir à conduire des mesures non invasives sur les gamètes pour en déterminer la qualité et le potentiel de développement en amont d’un cycle de fécondation in vitro (FIV) ; les ovocytes et les spermatozoïdes seront examinés un par un, par exemple dans des cytomètres en flux miniaturisés, adaptés à des mesures sur un grand nombre de cellules pour les spermatozoïdes, ou sur un nombre plus réduit de cellules pour les ovocytes.
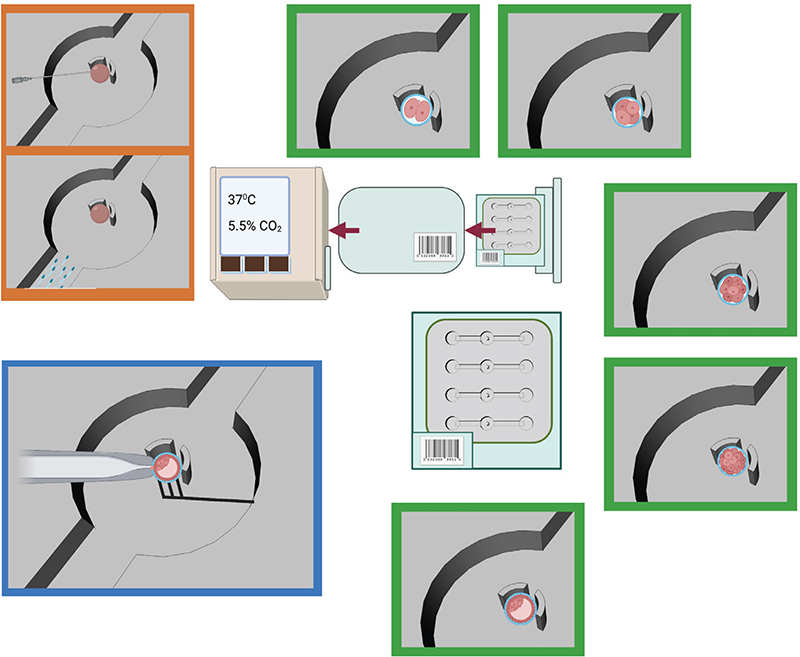
Une fois les gamètes préparés et sélectionnés, tout le cycle de FIV peut en principe être réalisé dans une puce microfluidique, de façon entièrement automatisée. Cette approche intégrée est particulièrement intéressante pour la standardisation des procédures et pour réduire les manipulations des gamètes et des embryons, pendant les différentes étapes du cycle de FIV. Dans la puce microfluidique, les solutions peuvent être rafraîchies et changées de façon dynamique, en perfusant la puce avec des milieux de culture adéquats. Cette manipulation moindre des cellules se traduit par une réduction du stress qu’elles peuvent subir ainsi qu’une diminution des erreurs humaines, entraînant une amélioration potentielle globale des cycles de FIV. Dans ce paradigme, un dispositif pourrait être dédié à chaque patiente, avec plusieurs circuits microfluidiques pour la manipulation en parallèle de tous les ovocytes/embryons de la patiente. Le format microfluidique garantit aussi un bien meilleur contrôle du microenvironnement des gamètes et des embryons, réduisant aussi le stress que ces derniers peuvent subir par suite de changements brusques du pH, du taux d’oxygénation ou de la température, par exemple. Cette approche touten-un permet aussi de coupler dans le même dispositif la culture des embryons à leur caractérisation à l’aide de capteurs ou d’outils analytiques intégrés. Une telle caractérisation multiparamétrique est essentielle pour acquérir une image holistique du bien-être de l’embryon et de son potentiel de développement. Enfin, la miniaturisation des processus pourrait conduire à une diminution des coûts du cycle de FIV, pour les étapes in vitro, du fait de l’utilisation de plus petits volumes. La figure 3 résume ce concept de plateforme intégrée pour réaliser un cycle entier de FIV, de la fécondation à la caractérisation des embryons sur une seule puce.
Outils microfluidiques pour la biologie et la médecine de la reproduction
Divers dispositifs microfluidiques ont été développés pour l’assistance médicale à la procréation (AMP) :
- –pour la réalisation de différentes étapes d’un cycle de FIV,
- –pour la caractérisation, la préparation et le tri des gamètes,
- –pour la cryoconservation des gamètes et embryons.
Plusieurs exemples de dispositifs sont présentés dans les sections suivantes, traitant successivement de l’analyse et du tri des gamètes et des différentes opérations d’un cycle de FIV. Nous aborderons ensuite deux applications requérant des dispositifs plus complexes, reproduisant des organes et des tissus des appareils génitaux. Certaines applications de la microfluidique pour la médecine de la reproduction ne sont pas présentées dans cette revue, telles que la cryoconservation des gamètes et des embryons. De même, cette revue n’est pas complète et ne discute pas toutes les références dans le domaine. Les lecteurs intéressés sont invités à consulter d’autres articles de revue en anglais [8-10].
Outils de type « diagnostique » et de préparation des gamètes
Les outils microfluidiques de type « diagnostique » visent à évaluer la qualité des gamètes avant leur inclusion dans un cycle de FIV. Ils existent donc tant pour les spermatozoïdes que pour les ovocytes.
Analyse et tri des spermatozoïdes
Pour l’analyse et le tri des spermatozoïdes, l’utilisation de puces microfluidiques présente un avantage net : une manipulation moindre du sperme et des cellules, comparé à des techniques de laboratoire classiques et moins intégrées, ce qui se traduit a priori par un risque moindre de stress et de dommages génétiques. Ces systèmes miniaturisés pouvant être autonomes et portatifs, ils peuvent se décliner en version POC, à utiliser par le patient chez lui pour une première analyse qualitative de son sperme. Finalement, pour des appareils plus sophistiqués utilisés dans des laboratoires spécialisés, le tri et/ou analyse des spermatozoïdes peuvent directement être couplés à la fécondation sur puce en aval de cette étape de sélection. En revanche, les systèmes microfluidiques ne peuvent traiter que des volumes restreints d’échantillons du fait de leurs petits volumes internes et des débits limités ; de ce fait, seule une partie de l’éjaculat peut être analysée et triée, ce qui est parfait pour une étape de fécondation sur puce, nécessitant aussi un volume moindre, ou par injection intracytoplasmique de spermatozoïde (ICSI).
Les différents dispositifs microfluidiques proposés pour l’analyse du sperme reposent sur la miniaturisation de stratégies classiques de préparation des spermatozoïdes ou explorent de nouveaux principes de sélection [11, 12]. En particulier, la présence de flux continus permet de trier les spermatozoïdes selon leur capacité à nager à contre-courant ou entre plusieurs lignes de courant, ou encore à sauter des obstacles, ce que des cellules mortes, non motiles ou autres que des spermatozoïdes ne peuvent pas faire, puisqu’elles suivent les lignes de courant dans un flux laminaire. Par ailleurs, les spermatozoïdes sont sensibles à la présence de gradients (de flux, de température, chimiques ou biochimiques), ce qui guide leur progression dans l’appareil génital féminin. La microfluidique se prête bien à la création de gradients stables de facteurs solubles, de température ou surfaciques. De ce fait, plusieurs dispositifs ont exploité cette idée et utilisé divers gradients pour sélectionner des spermatozoïdes sur leur aptitude à se diriger vers une source de chaleur ou de chimioattractants, ou dans un gradient de flux (rhéotaxie) [13, 14]. Dans une autre approche, des spermatozoïdes sont caractérisés à l’aide de mesures d’impédance pour évaluer leur morphologie, leur taille, leur viabilité ou leur contenu génétique [15], ce qui peut être suivi par un tri actif en ligne pour isoler les spermatozoïdes «viables» des cellules mortes ou autres.
Détermination de la maturation et viabilité des ovocytes
L’analyse des ovocytes avant ou après fécondation s’intéresse à trois aspects :
- –leur viabilité ou potentiel de développement,
- –leur maturité, pour identifier la meilleure fenêtre de temps pour la fécondation,
- –la confirmation que la fécondation a eu lieu.
Deux approches dominent pour ces analyses, basées sur les propriétés mécaniques ou optiques des ovocytes. En effet, les ovocytes durcissent après fécondation et ces propriétés mécaniques sont corrélées avec l’âge maternel, la « qualité » des ovocytes, et leur stade de maturation [16]. De la même façon, un index de fertilité a été proposé pour identifier les ovocytes matures sur la base de leur spectre d’absorbance. Les techniques conventionnelles (microscopie à force atomique [AFM] ou aspiration manuelle à l’aide d’une micropipette) pour mesurer ces propriétés sont longues et possiblement invasives, et requièrent une manipulation extensive des ovocytes. En revanche, une approche microfluidique permet d’automatiser ces mesures, de les rendre moins invasives, et d’augmenter leur débit, ainsi que de coupler la caractérisation des ovocytes avec leur fécondation dans la même plateforme [17]. Leur transport sur puce, d’un site de mesure à – par exemple – un site de fécondation, peut dans ce cas être assuré à l’aide d’éléments mobiles [18] ou, plus simplement, en contrôlant l’orientation des flux sur la puce. Pour toutes ces mesures, la puce microfluidique fonctionne comme un cytomètre de flux miniaturisé, dans lequel les ovocytes sont perfusés de façon continue, et caractérisés un par un lorsqu’ils passent au niveau d’éléments de mesure, tels que des fibres optiques, un « cantilever » [19] ou des constrictions [20]. Les fibres optiques permettent de déterminer l’index de fertilité [21], et la poutre et les constrictions de déformer l’ovocyte, de façon active ou passive, pour en déterminer la rigidité. Un autre principe de mesures et de tri a été proposé sur puce microfluidique, utilisant la diélectrophorèse et basé sur des différences de propriétés électriques des ovocytes [22].
Vers une plateforme de fécondation in vitro intégrée
Idéalement, une plateforme intégrée devrait inclure toutes les étapes du cycle de FIV, après collecte des gamètes jusqu’au transfert des embryons ; cette plateforme devrait donc réaliser les différentes étapes de préparation des gamètes, la fécondation, la culture des embryons et leur évaluation prétransfert (figure 3). La microfluidique se prête bien à la réalisation de ces différentes étapes, et plusieurs outils microfluidiques ont été développés à cette fin. Cependant, leur intégration en une plateforme unique, ce qui aurait un impact plus fort d’un point de vue clinique, en est encore à ses balbutiements. Dans cette section, nous discuterons du potentiel de la microfluidique pour plusieurs de ces étapes clés, et présenterons des exemples de plateformes microfluidiques proposées pour chaque étape ou combinant plusieurs étapes. Les lecteurs intéressés sont invités à consulter plusieurs articles de revue plus complets [8-10, 23].
Culture des embryons
Après le tri et l’analyse des spermatozoïdes, la culture des embryons est sans aucun doute l’étape du cycle de FIV qui a été la plus explorée dans un format microfluidique. En effet, l’utilisation de ces systèmes miniaturisés pourrait répondre à certaines limitations du protocole de culture in vitro actuel. Sur puce, le volume de culture peut être réduit de façon drastique, de 100 à 1 000 fois, sans aucun problème d’évaporation du milieu de culture. Les systèmes microfluidiques se prêtent bien à la culture et à la manipulation de cellules uniques, comme discuté précédemment. De plus, ils sont idéaux pour une culture sous flux continu, ce qui permet non seulement de reproduire la stimulation mécanique à laquelle les embryons sont exposés in vivo, mais aussi d’adapter la composition du milieu de culture aux besoins des embryons, potentiellement en temps réel. Comme nous l’avons déjà évoqué, cette option intégrée ne requiert pas de manipulation excessive des embryons, et permettrait de suivre en temps réel le développement des embryons non seulement à l’aide d’imagerie en continu, mais aussi sur la base de leur métabolisme et de leur activité sécrétoire, qui pourraient être mesurés à l’aide de capteurs présents dans la chambre de culture, ce point étant plus détaillé dans la section suivante.
Plusieurs approches microfluidiques ont été testées pour la culture des embryons de mammifères : dans des micropuits, des chambres présentant un volume de quelques dizaines, voire quelques centaines de nanolitres [24-26], contre un rempart pour les piéger dans un canal plus large [27], dans un canal équipé de constrictions pour reproduire la structure de l’oviducte et les exposer régulièrement à des déformations mécaniques [28], ou encore dans des gouttes de liquide (1-10 µL) plus larges, soit déplacées par électromouillage [29], soit régulièrement alimentées en milieu de culture frais [30], dans les deux cas pour stimuler les embryons de façon mécanique. Ces différentes approches sont décrites avec plus de détails dans d’autres revues [9]. Seuls quelques-uns de ces exemples ont prouvé un avantage net de la microfluidique, que ce soit pour la culture d’embryons uniques, l’utilisation de volumes bien moindres que les gouttes traditionnelles, le recours à des conditions de culture dynamiques, ou menant encore à des taux de croissance pré- ou postimplantation supérieurs à ceux obtenus avec une culture classique [24, 30]. Cependant, à l’heure actuelle, aucune plateforme n’a encore combiné tous ces avantages. De plus, dans la plupart des cas, la culture sur puce requiert encore beaucoup d’interventions manuelles.
Dans nos travaux, nous avons utilisé des chambres microfluidiques de 30 ou 270 nL, et nous avons comparé la croissance d’embryons de souris, cultivés soit seuls, soit en groupe de cinq ou 20 [24]. Dans ces systèmes, le taux de croissance préimplantation était bien plus élevé que dans des gouttes classiques, quelle que soit la taille du groupe de culture. Par ailleurs, après transfert des embryons, nous avons caractérisé le taux de naissances. Ces dernières expériences ont révélé un taux de naissance plus élevé après culture sur puce pour les embryons uniques. Nous pensons pouvoir expliquer ces résultats par le fort niveau de confinement qui facilite l’accumulation des facteurs de croissance produits par les embryons, tout en leur permettant de créer leur propre environnement dans la puce. Ces expériences ont été répétées avec des embryons humains, générés dans un cycle de FIV classique et donnés pour la recherche [25]. Ici, aucun avantage clair du format microfluidique n’a été observé au cours de la culture : les taux de blastocystes étaient fort comparables pour la culture sur puce et en goutte. Cependant, ces expériences ont été menées sur des embryons humains après activation de leur génome, et qui avait déjà été cultivés pendant quatre jours dans de larges gouttes de milieu de culture avant leur cryoconservation, alors que les embryons de souris avaient été introduits dans les puces microfluidiques juste après leur fécondation, au stade du zygote.
Évaluation du potentiel de développement des embryons
Traditionnellement, les embryons sont évalués sur la base de critères morphologiques, et les technologies les plus récentes d’imagerie en continu y ajoutent une dimension de suivi continu. La microfluidique apporte, dans ce contexte, plusieurs avantages : le fait d’étendre cette évaluation à d’autres paramètres solubles (métabolisme ou activité sécrétoire), qui peuvent aussi être mesurés en temps réel et en continu, dans le même dispositif [9]. De plus, comme l’embryon est confiné dans un faible volume de milieu de culture, toute activité de consommation ou de production est concentrée et, par conséquent, plus facilement détectable que dans une approche de culture classique qui utilise des gouttes de l’ordre du microlitre. De ce fait, ce format miniaturisé facilite aussi la transposition des protocoles de culture et d’évaluation des embryons vers l’échelle de l’embryon unique et ouvre de nouvelles voies pour des caractérisations multiparamétriques de la qualité des embryons.
Quelques approches microfluidiques de caractérisation des embryons ont été proposées, axées sur des mesures métaboliques (activité respiratoire et utilisation des substrats de base [glucose, lactate et pyruvate]), ou utilisant de l’imagerie en continu [9]. Du fait que les systèmes microfluidiques sont presque toujours fabriqués à base de matériaux transparents, l’imagerie en continu est simple à coupler à la culture. Pour mesurer la consommation en oxygène, qui sert d’indicateur global pour l’activité métabolique des embryons, un capteur électrochimique est incorporé dans la puce dans le voisinage proche de l’embryon [31]. Pour les analyses moléculaires, du milieu de culture doit être prélevé de la chambre de culture ; pour ce faire, une pompe péristaltique a été intégrée entre un espace de culture et un espace de mesure, où des tests enzymatiques étaient réalisés pour évaluer la consommation et la production en glucose, lactate et pyruvate [32].
Exemples de plateformes intégrées
Seules quelques plateformes intégrées ont réalisé plus de deux étapes d’un cycle de FIV complet, incluant une sélection des spermatozoïdes, la fécondation, la culture des embryons générés et leur évaluation par microscopie à divers moments sur la puce [33, 34]. Ainsi, une série d’ovocytes ont été immobilisés dans une puce comprenant 16 structures en colonne, ces structures incluant des fentes micrométriques qui contribuent à la sélection des spermatozoïdes après qu’ils ont nagé jusqu’aux ovocytes. Après sélection, les spermatozoïdes présentaient une motilité accrue de façon significative (de 61 à 96 %). Le milieu de culture était rafraîchi dans la puce sans induire de stress sur les zygotes, après cette étape de fécondation. Globalement, le taux de blastocystes et le nombre de cellules au stade de blastocyste sont restés fort comparables à ceux obtenus avec de la culture classique en gouttelettes. En résumé, cet exemple montre la capacité de la microfluidique à intégrer et à automatiser (au moins de façon partielle) plusieurs étapes clés d’une procédure de FIV, même si plusieurs aspects sont restés manuels, comme la perfusion de milieu de culture, le positionnement des ovocytes et l’introduction du sperme dans la puce. Pour satisfaire à des critères cliniques, l’automatisation de ces systèmes intégrés doit être plus poussée, et toutes les étapes réalisées presque sans aucune intervention manuelle.
Systèmes de type organes-sur-puce
Deux types d’applications d’organes-sur-puce seront discutés ici :
- –ceux destinés à la production d’embryons dans des conditions plus biomimétiques et à mieux appréhender la communication qui s’installe entre un embryon et sa mère, en reproduisant de façon plus fidèle le microenvironnement de l’appareil génital féminin,
- –des bioréacteurs miniatures pour la culture ex vivo de tissus de gonades pour étudier et reproduire la gamétogenèse in vitro ou pour identifier des agents toxiques vis-à-vis de la reproduction humaine.
Création d’un environnement biomimétique
Les conditions de manipulation et de culture in vitro ont été identifiées comme une cause de stress pour les gamètes et les embryons [35], ce stress pouvant trouver plusieurs sources : une exposition à divers matériaux plastiques, l’utilisation de paramètres physicochimiques de culture fort différents de la situation dans le corps humain, un milieu de culture «artificiel» ou le manque d’interactions avec d’autres cellules, comme celles de l’épithélium dans l’appareil génital féminin. Ce stress se traduit tout d’abord par de grandes inégalités de développement préimplantatoire avec un fort taux d’embryons non viables et des aberrations moléculaires et morphologiques desdits embryons. Par ailleurs, de plus en plus de rapports alarmants suggèrent que ces conditions artificielles pourraient favoriser l’apparition de troubles médicaux et de diverses pathologies à l’âge adulte ou chez les jeunes enfants. Même si l’outil microfluidique apporte un plus grand contrôle des paramètres physicochimiques in vitro, et qu’il offre un environnement de culture dynamique avec des opérations en flux, il ne permet pas de restaurer les interactions physiques, chimiques et biochimiques entre les gamètes ou les embryons et leur environnement dans l’appareil génital féminin. Dans ce contexte, les organes-sur-puce offrent un environnement plus complexe et plus biomimétique.
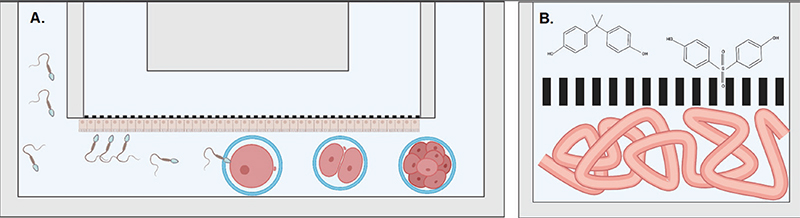
Plusieurs organes-sur-puce ont modélisé différents tissus de l’appareil génital féminin, par exemple pour produire des embryons dans un mini-oviducte sur puce ou mieux comprendre les interactions entre l’embryon et son environnement maternel (utérus, endomètre, oviducte, etc.) [36]. Ces différents modèles sont bâtis selon le même principe, discuté précédemment, permettant de mimer des barrières physiologiques et utilisant une membrane poreuse horizontale, servant de support pour la croissance, la maturation et la différenciation de l’épithélium (figure 4A).
Dans cette optique, nous avons développé un modèle d’oviducte bovin pour la production d’embryons [37]. Une rangée de piliers a été ajoutée dans le compartiment apical pour retenir les ovocytes/embryons pendant la culture sous flux. Après avoir vérifié que l’épithélium recréé sur puce était fonctionnel et différencié, des ovocytes bovins et spermatozoïdes ont été introduits pour fécondation. Les embryons ont été caractérisés au stade de zygote pour leurs profils épigénétique et transcriptomique. Ces analyses ont révélé que les embryons produits sur puce étaient fort différents, d’un point de vue épigénétique, de ceux générés dans un processus de FIV classique, avec une forte réduction de leur taux de méthylation globale, mais qu’ils étaient, en revanche, proches d’embryons issus d’une fécondation naturelle. Ces résultats suggèrent que l’environnement offert par l’oviducte-sur-puce réduit le stress auquel les gamètes et/ou les embryons sont exposés, et démontrent que ce modèle d’oviducte-sur-puce ouvre de nouvelles voies pour la production d’embryons in vitro. Les étapes suivantes sont de vérifier que cette diminution apparente du stress perdure au-delà du stade zygote et d’identifier le ou les facteurs expliquant les bénéfices réels de cet oviducte-sur-puce.
Préservation de la fertilité
Un autre champ applicatif des organes-sur-puce pour la biologie et la médecine de la reproduction est la préservation de la fertilité des patients, ce qui peut revêtir non seulement un aspect thérapeutique mais aussi un côté préventif. Dans les deux cas de figure, les organes ciblés sont les mêmes : ceux qui sont le siège de la production, de la maturation et du stockage des gamètes, soit : les tubules séminifères et l’épididyme chez l’homme, et l’ovaire chez la femme. D’un point de vue thérapeutique, le but est de produire, à partir d’un modèle d’organe in vitro, des gamètes qui peuvent ensuite être utilisés dans une procédure d’insémination artificielle. La possibilité de générer des gamètes in vitro est de prime importance pour les patients infertiles qui sont incapables de produire leurs propres gamètes. Cette possibilité ouvre aussi de nouvelles voies thérapeutiques pour des patients ayant été atteints d’un cancer en bas âge, dont les tissus reproductifs (testicules et ovaires) ont été soumis à une procédure de cryoconservation en attendant l’âge adulte. Les mêmes modèles pourraient aussi servir, à titre préventif, pour identifier des substances pouvant impacter sur la fertilité, comme des perturbateurs endocriniens ou encore des particules micro- ou nanométriques de plastique (figure 4B) [38].
Ces tissus étant très complexes et encore fort peu compris, l’approche de novo discutée dans les exemples précédents, où la structure physique et cellulaire du tissu est recréée dans une puce microfluidique, est peu pertinente. De ce fait, une stratégie plus appropriée consiste à utiliser des modèles cellulaires plus complexes comme des organoïdes [39] ou des cultures ex vivo. Dans ce contexte, l’outil microfluidique sert de microbioréacteur pour la culture de ces tissus très fragiles, garantissant un contrôle très fin des paramètres physicochimiques et permettant une culture sous flux continu pour un apport régulier de nutriments et d’oxygène, et même de facteurs de stimulation solubles, ainsi que l’évacuation des déchets métaboliques [40].
Le groupe d’Ogawa, au Japon, a récemment réussi à reproduire le processus complet de spermatogenèse dans un microbioréacteur, à partir de tubules séminifères intacts de souris [41]. Ces tissus ont été cultivés pendant six mois sur une membrane poreuse séparant deux compartiments microfluidiques, celui du dessous servant à la perfusion des tissus. Des gamètes mâles fonctionnels ont ainsi pu être générés dans le microbioréacteur, et des spermatides rondes utilisées pour être injectées dans des ovocytes de souris, donnant lieu à une progéniture en bonne santé.
Répéter cet exploit avec des tissus humains appartient cependant encore au domaine du rêve [42] : d’une part, le processus de spermatogenèse varie grandement entre les espèces, et la spermatogenèse humaine dure plus longtemps que celle de la souris. D’autre part, les stratégies de culture ex vivo, qui ont permis de produire des gamètes mâles fonctionnels de souris, n’ont pas encore porté leurs fruits pour d’autres espèces, en particulier, pour les humains. Inspirés des travaux du groupe d’Ogawa, nous avons développé un microbioréacteur pour la culture de tubules séminifères de primates [43]. La chambre de culture est entourée de part et d’autre d’un canal de perfusion, reproduisant le rôle de la vascularisation et assurant un apport régulier en nutriments. Dans un premier temps, notre but était de démontrer que nous pouvions cultiver ces tissus isolés de patients transgenres ou de ouistitis, dans une puce microfluidique. Nous avons observé que les tissus restaient viables et « actifs » pour une période d’au moins neuf jours, sous perfusion continue. Dans un deuxième temps, nous voulions évaluer l’applicabilité de ces cultures ex vivo pour conduire des tests de toxicité visà-vis de la reproduction. À cette fin, nous nous sommes intéressés à l’activité endocrine de tubules séminifères de ouistitis, et nous avons prouvé que nous pouvions suivre au cours du temps la production de testostérone et d’oestradiol [43]. La prochaine étape sera d’utiliser ce microbioréacteur couplé à des mesures hormonales pour tester des substances potentiellement toxiques. Un avantage clair de l’outil microfluidique pour ces tests de toxicité est de permettre de paralléliser les expériences, tout en limitant la quantité de tissus requise par microbioréacteur.
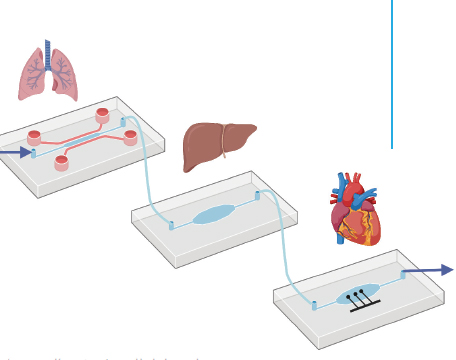
La littérature fournit deux autres exemples de cet effort pour proposer des modèles complexes afin d’évaluer la toxicité possible de substances chimiques sur les organes génitaux et leur impact sur la reproduction. Ces deux exemples suivent des approches plus complexes, puisqu’ils utilisent des modèles dits multi-OoC (pour multiorgan-on-a-chip), combinant plusieurs organes-sur-puce. Le premier propose une coculture entre un modèle de foie réalisé sous forme d’un sphéroïde et d’un organoïde de testicules, dans une puce commerciale permettant une recirculation en continu du milieu de culture [39]. Ce modèle a été utilisé pour tester la toxicité du cyclophosphamide, après sa bioactivation par le foie dans la puce, démontrant la pertinence de cette approche multiorganes. Dans le deuxième exemple, tout l’appareil génital est modélisé avec une coculture de tissus d’ovaires, de trompes de Fallope, du col de l’utérus et de l’utérus, et mis en contact avec des tissus de foie pour modéliser aussi le métabolisme des substances externes, tous ces organes étant ici encore inclus dans une boucle fermée de perfusion [44]. Cette plateforme microfluidique, nommée Evatar, a permis de reproduire in vitro un cycle menstruel complet de 28 jours, ouvrant de nouvelles possibilités pour conduire non seulement des recherches fondamentales sur la reproduction mais aussi pour le criblage de médicaments et de produits potentiellement toxiques.
Conclusion
La microfluidique offre de nouvelles possibilités pour la médecine et la biologie de la reproduction, pour mener les différentes étapes d’un cycle de FIV, pour la réalisation de plateformes intégrées et pour l’automatisation et la standardisation des routines cliniques. Même si la littérature recense de nombreux exemples de puces microfluidiques pour la médecine et la biologie de la reproduction, illustrant les opportunités créées par la microfluidique, des développements complémentaires sont nécessaires, au-delà de la partie microfluidique, avant que ces systèmes miniaturisés et intégrés ne soient utilisés en routine pour les différents aspects d’un traitement FIV. La grande partie des plateformes décrites dans la littérature sont fabriquées dans un matériau élastomère, qui ne se prête pas bien à une production de masse et dont la biocompatibilité ne fait pas l’unanimité [45]. Toute l’interface autour des puces doit aussi être repensée pour en faciliter l’utilisation par des non-experts et leur automatisation. Jusqu’alors, la plus grande partie de ces puces microfluidiques ont été validées sur des modèles animaux, et seuls quelques exemples de systèmes ont été testés sur des gamètes et embryons humains, ce qui reste une étape nécessaire et essentielle pour leur adoption par des cliniciens. Enfin, l’introduction de la microfluidique dans un environnement clinique implique un changement radical au niveau de l’instrumentation dans un centre FIV, ce qui représente une barrière technologique certaine à surmonter.
Liens d’intérêt : Les auteurs déclarent n’avoir aucun lien d’intérêt en rapport avec cet article.