e-VEGF-IMMUNO-actu
MENUVaccination anti-VEGFA Comment combiner le ciblage de l’angiogenèse et l’immunothérapie Volume 12, numéro 1, Mars 2017
Introduction
Les succès de la réactivation des checkpoints immunitaires à l’aide d’anticorps dirigés contre les récepteurs immunosuppresseurs et leurs ligands redonne de la vigueur à toutes les approches relevant de l’immunothérapie – et elles sont nombreuses ! Les thérapies qui font appel à la « vaccination » étaient quelque peu tombées en déshérence, mais plusieurs vaccins sont actuellement en essai clinique de phase III et la recherche de nouveaux antigènes tumoraux susceptibles de servir de base à une immunisation active reste d’actualité : au lieu d’administrer des anticorps, pourquoi ne pas les faire produire par le patient lui-même ? Alors que la stimulation de l’immunité cellulaire (lymphocytes T) est en plein essor sur le plan clinique, la génération d’une immunité humorale (lymphocytes B) est restée marginale…
Dans cette optique, pourquoi ne pas essayer de « vacciner » l’organisme contre les VEGF, essentiellement le VEGFA, au lieu de l’inhiber passivement à l’aide d’un anticorps (le bévacizumab) ou d’une protéine de fusion (l’aflibercept) ?
Il existe, pour explorer cette voie de recherche thérapeutique, plusieurs arguments convaincants : les facteurs pro-angiogéniques, en particulier le VEGF, contribuent à l’immunosuppression en inhibant l’expression des molécules d’adhésion endothéliale [1] et la maturation des cellules dendritiques [2] et en activant les cellules immunosuppressives [3]. En conséquence les anti-angiogéniques peuvent contribuer à la réversion de la faible réactivité immune des patients atteints de cancer, comme l’ont montré Dings et al. [4].
Quels seraient les avantages d’une approche vaccinale, susceptible de générer une destruction active des facteurs de croissance vasculo-endothéliaux, par rapport à leur blocage passif par un anticorps ou une protéine de fusion ? Les auteurs en voient trois, de façon peut-être un peu tendancieuse (il faut bien faire valoir son fond de commerce !) :
• Les anticorps produits « naturellement » auraient une meilleure activité de neutralisation du VEGF ;
• Cette neutralisation serait durable et nécessiterait moins d’injections et d’hospitalisations ;
• Le coût de la thérapeutique serait réduit par rapport au coût des traitements actuels1.
1Que l’on me permette de mettre en doute cette dernière affirmation !
D’ores et déjà, des vaccins anti-VEGFA ont été mis au point [5] et une phase I a été réalisée [6] : elle a montré que cette approche ne présentait pas de toxicité particulière et que les effets indésirables classiquement associés au bévacizumab étaient absents – ce qui jette un doute sur l’efficacité de ces premières tentatives. Plutôt que d’utiliser la protéine entière comme immunogène pour la vaccination, la tendance est maintenant de sélectionner des peptides judicieusement choisis afin d’optimiser à la fois la réaction immunitaire et l’affinité des anticorps endogènes induits vis-à-vis de la protéine ciblée. C’est l’approche qu’a choisie ce groupe de recherche néerlandais.
Choix du peptide immunogène
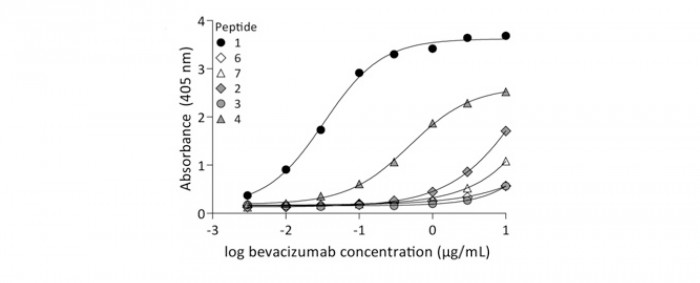
Un total de 33 peptides immunogènes reproduisant diverses parties de la structure du VEGFA ont été conçus, synthétisés et testés en ce qui concerne leur affinité pour le bévacizumab. Plusieurs d’entre eux sont capables de se replier de façon à adopter la structure tridimensionnelle du VEGFA165 ; ils forment, en particulier, spontanément les ponts disulfure intramoléculaires à l’origine du « nœud de cystéines » (cysteine knot) caractéristique du VEGFA et présent dans de nombreux facteurs de signalisation. En revanche, les résidus cystéine responsables, par création de ponts disulfure, de la dimérisation du VEGFA, ont été remplacés par des résidus alanine afin d’empêcher une éventuelle activité agoniste de ces peptides. Parmi ces peptides, le peptide 1 (79 aminoacides, hVEGFA26-104) a été retenu sur la base de son affinité pour le bévacizumab (figure 1), de sa capacité à inhiber la liaison du bévacizumab au VEGFA, et de son incapacité à stimuler la croissance d’une lignée cellulaire dépendante du VEGFA pour sa croissance (figure 2).
Efficacité des anticorps anti-VEGFA obtenus par immunisation contre le peptide I
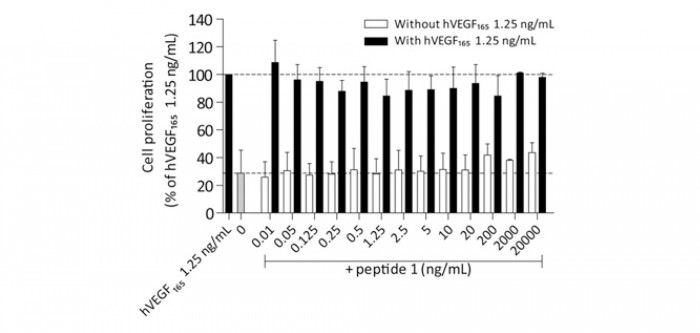
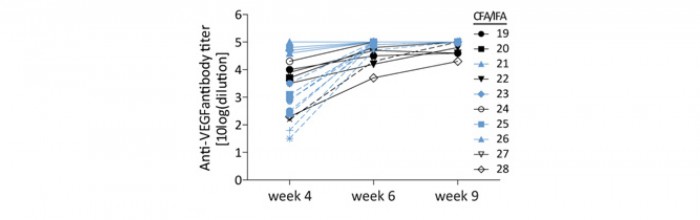
L’immunisation de rats Wistar contre le peptide 1, en présence de divers adjuvants, a été obtenue en 9 semaines (figure 3) et les anticorps, obtenus dans une série d’animaux immunisés, incubés à la dilution 1/100 en présence de VEGFA165, ont montré in vitro une inhibition efficace de la prolifération cellulaire d’une lignée dépendante du VEGFA pour sa croissance, inhibition comparable à celle induite dans les mêmes conditions par le bévacizumab à la dose de 100 ng/mL (figure 4).
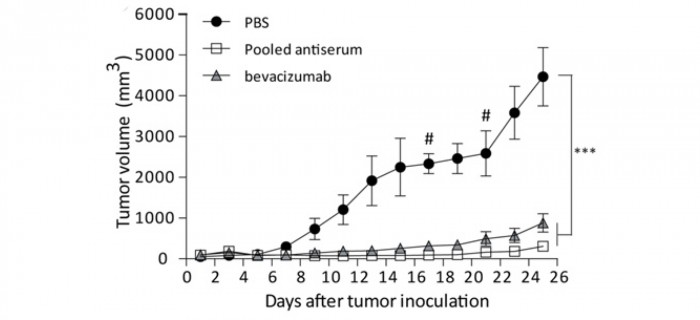
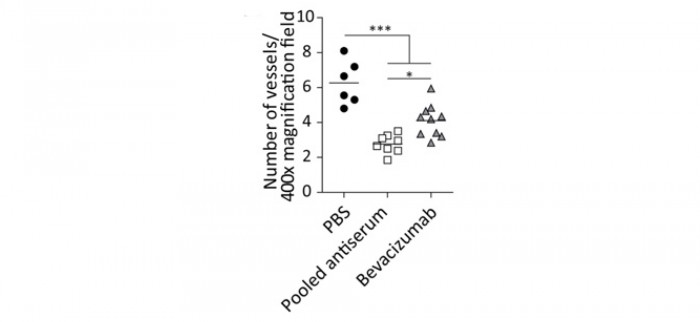
Ces anticorps ont été poolés et testés in vivo sur des souris porteuses de xénogreffes du cancer colique humain LS174T ; l’activité antitumorale est comparable à celle du bévacizumab (figure 5) ; cet effet semble bien lié à une activité anti-angiogénique car elle s’accompagne d’une diminution de la vascularisation tumorale, supérieure à celle induite par le bévacizumab (figure 6).
Vaccination anti-VEGFA
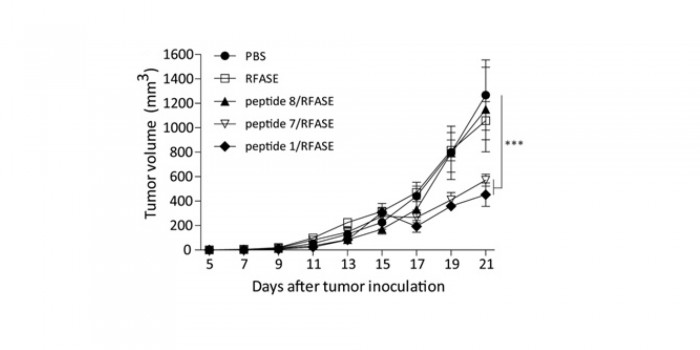
L’activité anti-angiogénique et antitumorale de l’immunisation d’animaux porteurs de tumeurs syngéniques a enfin été réalisée afin de mimer les conditions réelles de vaccination éventuellement applicables en clinique. L’immunisation a été réalisée chez des souris C57BL/6 par trois peptides, le peptide 1, le peptide 7 qui est son équivalent murin, et le peptide 8 (variant du peptide 7 sans structure 3D). Les souris ont été ensuite inoculées par 105 cellules tumorales dérivées du mélanome murin B16 et le développement tumoral suivi pendant 21 jours. L’effet antitumoral des peptides 1 et 7 est significatif (figure 7), alors que celui du peptide 8 est nul, justifiant ainsi l’approche utilisée pour le choix des peptides immunogènes.
Commentaire
Cette étude montre clairement que le peptide 1, qui représente la séquence des aminoacides 26 à 104 du VEGFA humain, incluant le domaine du cysteine knot essentiel à la structure 3D du facteur de croissance, est immunogène chez l’animal bien qu’il reproduise la séquence partielle d’une protéine naturelle endogène. Il ne peut avoir d’effet agoniste au VEGFA puisqu’il est par nature monomérique car dépourvu du site de dimérisation nécessaire à l’activation du récepteur. Son équivalent murin, le peptide 7, est également immunogène chez la souris. Les anticorps obtenus par immunisation contre le peptide 1 et purifiés sont bien actifs in vitro et in vivo (de façon passive) sur des cellules tumorales humaines ; ceux obtenus par immunisation contre le peptide 7 sont efficaces de façon active chez l’animal immunisé.
Un biais expérimental très contestable vient grever la crédibilité de l’approche : dans l’approche de vaccination proprement dite, les souris n’ont reçu la greffe tumorale qu’après leur immunisation : on est très loin des conditions d’utilisation clinique de cette vaccination antitumorale… Il est à noter également que, alors que tous les rats avaient supporté l’immunisation sans problème, une proportion non négligeable de souris a fait une réaction anaphylactique mortelle lors de l’immunisation ; cette dernière ne peut être attribuée à l’adjuvant utilisé. Enfin, la durée de l’immunité n’a pas été mesurée, mais peut être évaluée à une trentaine de semaines d’après des immunisations réalisées pour d’autres peptides, sans lien avec le VEGFA.
Malgré les insuffisances encore patentes de l’établissement des données précliniques, un essai clinique de phase I (NCT-02237638) a été lancé récemment, utilisant le peptide 1 comme immunogène.
Wait and see…
Liens d’intérêts : L’auteur déclare ne pas avoir de lien d’intérêt en rapport avec cet article.