e-VEGF-IMMUNO-actu
MENUPembrolizumab en 1re ligne et atézolizumab en 2e ligne du CBNPC métastatique Volume 12, numéro 1, Mars 2017
Salle comble (avec même à une sacrée bousculade à l’entrée…) pour découvrir les résultats de plusieurs essais d’immunothérapie dans le CBNPC métastatique. Cette séance vedette débutait par les essais de 1re ligne positifs : KEYNOTE 021 pembrolizumab/carboplatine/pémétrexed versus carboplatine/pémétrexed et KEYNOTE 024 pembrolizumab versus doublet à base de platine.
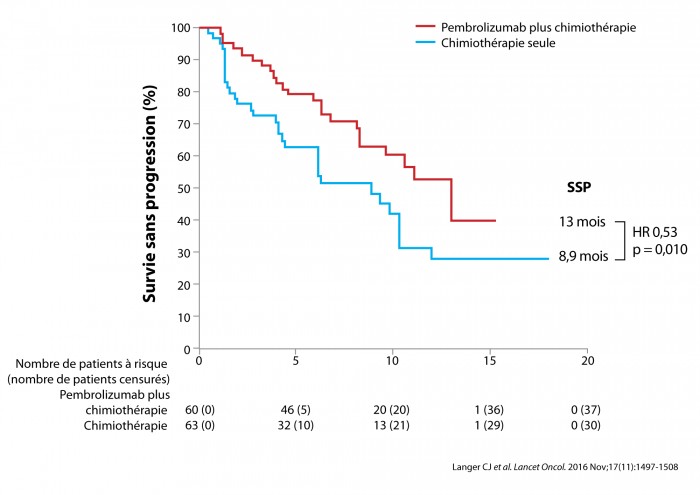
C. Langer présentait les résultats d’une cohorte de l’essai KEYNOTE 021 [1]. Cet essai de phase II randomisait, en 1re ligne de traitement, 60 patients dans le bras pembrolizumab/carboplatine/pémétrexed et 63 patients dans le bras carboplatine/pémétrexed. Il s’agissait exclusivement d’adénocarcinomes EGFR et ALK non mutés. Les patients atteints de métastases cérébrales asymptomatiques prétraitées pouvaient être inclus. La stratification portait sur le statut PDL1 négatif (< 1 %) ou positif (≥ 1 %) établi par immunohistochimie selon les critères et techniques propres au promoteur (anticorps 22C3 Dako). L’objectif principal était le taux de réponse objective (RO) établi par un comité indépendant. L’essai s’est montré positif avec un taux de RO de 55 % pour le bras pembrolizumab/carboplatine/pémétrexed et de 29 % dans le bras carboplatine/pémétrexed. Il existe une corrélation nette entre le taux de RO et le niveau d’expression de PDL1. La survie sans progression (SSP) était en faveur du pembrolizumab avec une médiane de 13 mois versus 8,9 mois (HR 0,53 p = 0,010) (figure 1). La survie globale était comparable dans les deux bras de traitement en raison d’un nombre d’événements faible et d’un cross-over important (51 %) lors de la progression, vers l’immunothérapie chez les patients du bras chimiothérapie initiale. La tolérance de l’association pembrolizumab/carboplatine/pémétred s’est révélée satisfaisante avec des effets secondaires immuno-induits connus et non majorés.
Les résultats de l’essai KEYNOTE 024 ont ensuite été présentés par M. Reck [2]. Cet essai de phase III comparait, en 1re ligne de traitement, 154 patients du bras pembrolizumab aux 151 patients du bras chimiothérapie à base de platine. Seuls les patients dont les tumeurs surexprimaient fortement PDL1 (TPS ≥ 50 %) étaient inclus. Pour inclure ces 305 patients le screening avait concerné 1 900 patients. L’objectif principal de cet essai était la survie sans progression (SSP). L’essai, qui a inclus 81 % de carcinomes non épidermoïdes et 19 % de carcinomes épidermoïdes, s’est révélé positif avec une SSP de 10,3 mois pour le bras pembrolizumab et de 6 mois dans le bras chimiothérapie (HR 0,50, p < 0,001) (figure 2). La survie à 1 an était en faveur du pembrolizumab : 48 % versus 15 % dans le groupe recevant une chimiothérapie à base de platine. Les courbes de SG se séparaient également nettement en faveur du pembrolizumab avec un HR à 0,60 (p = 0,005) alors que près de 50 % des patients du bras chimiothérapie ont bénéficié lors de la progression d’un cross-over vers le pembrolizumab. Le taux de RO était significativement supérieur pour le pembrolizumab (45 % versus 28 %). Les effets secondaires de tous grades étaient de 29 % dans le bras pembrolizumab dont 10 % de grade 3-4 et aucun décès toxique n’a été noté. La toxicité globale du bras pembrolizumab était inférieure à celle du bras chimiothérapie. L’enthousiasme sur l’immunothérapie en 1re ligne fut ensuite quelque peu tempéré par la présentation de M. Socinski des résultats négatifs de l’essai CheckMate 026 nivolumab versus doublet à base de platine [3].
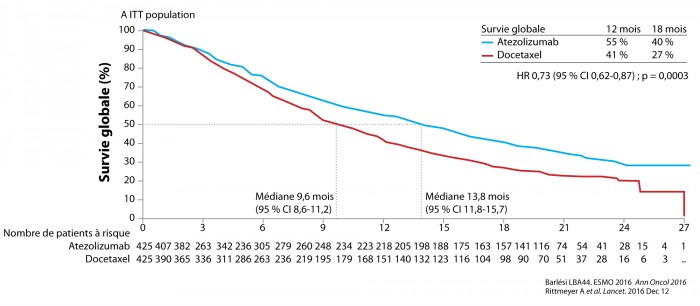
Les résultats de l’essai de phase III randomisé OAK évaluant l’anticorps anti-PDL1 atézolizumab versus docetaxel en 2e ligne de traitement du CBNPC métastatique présentés par F. Barlési à l’ESMO 2016 ont été publiés depuis dans le Lancet [4]. Nous avions déjà rapporté dans VEGF Actu Immuno n°44 les résultats de l’essai de phase II POPLAR qui explorait sur un effectif plus limité la même problématique de 2e ligne avec atézolizumab versus docétaxel. Les résultats de POPLAR étaient favorables à l’atézolizumab avec une amélioration significative de la survie globale (SG) (12,6 versus 9,7 mois, HR 0,73 [95% CI 0,53-0,99] ; p = 0,04) [5]. Les résultats de l’essai OAK confortent tout à fait les données de l’étude précédente POPLAR sur un effectif plus important de 850 patients (425 dans chaque bras). L’objectif principal était la SG en intention de traiter et dans le sous-groupe des tumeurs PDL1 ≥ 1 % au niveau des cellules tumorales (TC) ou immunitaires (IC). Les résultats étaient en faveur de l’atézolizumab (ATZ) avec une différence significative de médiane de survie globale de 13,8 mois contre 9,6 mois pour le docétaxel (DOC) (HR 0,73, p = 0,0003) (figure 3). Les taux de survie à 18 mois étaient de 40 % pour atézolizumab et de 27 % pour docétaxel. Dans le sous-groupe des tumeurs PDL1 ≥ 1 % (55 % des patients), les médianes de SG étaient de 15,7 mois dans le bras ATZ et de 10,3 mois dans le bras DOC (HR 0,74 p = 0,0102). On peut noter qu’une différence de SG était également constatée dans le sous-groupe des tumeurs PDL1 négatives (< 1 %) avec des résultats en faveur de l’atézolizumab (bras ATZ : 12,6 mois ; bras DOC : 8,9 mois, HR 0,75 p = 0,0205). Pour les tumeurs surexprimant très fortement PDL1 (≥ 50 % TC ou ≥ 10 % IC) (16 % des patients), le bénéfice apporté par l’atézolizumab était encore plus marqué, avec une médiane de SG de 20,5 mois à comparer avec celle du bras docétaxel : 8,9 mois (HR 0,41 p < 0,0001). L’histologie du CBNPC, de type épidermoïde ou non, n’a pas influencé le bénéfice constaté. Au chapitre tolérance, les résultats étaient en faveur du bras ATZ avec 15 % de toxicités de grades 3-4 contre 43 % pour le bras DOC. Les toxicités immuno-induites sévères (grade 3-4) regroupaient 0,7 % de pneumopathies interstitielles, 0,3 % d’hépatites et 0 % de colites. L’essai OAK est donc, à ce jour, le premier essai démontrant la supériorité d’un anticorps anti-PDL1 sur la chimiothérapie de référence par docétaxel dans cette situation de 2e ligne. Les anticorps anti-PD1 (nivolumab, pembrolizumab) avaient déjà permis d’afficher de tels résultats. Avec l’essai positif OAK, l’atézolizumab trouve, à son tour, sa place dans la stratégie thérapeutique de 2e ligne du CBNPC métastatique et supplante largement la chimiothérapie conventionnelle. Les résultats des essais d’immunothérapie dans le cancer bronchique présentés lors de cette session du congrès ESMO 2016 sont regroupés dans le tableau 1. C’est peu dire que l’immunothérapie bouleverse les algorithmes thérapeutiques du cancer bronchique métastatique…
Liens d’intérêts : co-investigateur dans les essais cliniques MSD, Roche, Astra Zenaca, BMS ; interventions ponctuelles : Board BMS, Roche