Hépato-Gastro & Oncologie Digestive
MENUDiagnosis, causes and prognosis of acute renal failure during cirrhosis Volume 26, issue 2, Février 2019
Introduction
La survenue d’une insuffisance rénale au cours de la cirrhose est fréquente et comprend classiquement l’insuffisance rénale chronique (IRC) et aiguë (IRA ; le terme « AKI », pour « Acute Kidney Injury », désigne désormais l’IRA dans la littérature anglo-saxonne). L’IRC, définie (critères KDIGO) par un débit de filtration glomérulaire (DFG) inférieur à 60 mL/min/1,73 m2 ou la présence de marqueurs d’atteinte parenchymateuse (albuminurie, anomalies du sédiment urinaire, anomalies de l’histologie et/ou de l’échographie rénale) pendant plus de 3 mois [1], est le plus souvent secondaire à des comorbidités (diabète, hypertension artérielle) et/ou à des causes plus spécifiques (néphropathie à IgA, glomérulopathie liée aux hépatites virales B ou C). L’IRC ayant été beaucoup moins étudié que l’IRA au cours de la cirrhose décompensée (sa prévalence n’est même pas connue), nous ne discuterons ici que de l’IRA, qui s’observe au cours de 40 à 80 % des hospitalisations de patients atteints de cirrhose [2]. La prise en charge adéquate de l’IRA nécessite de pouvoir répondre aux questions suivantes que nous aborderons dans cette mini-revue : 1) Comment diagnostiquer une IRA chez le patient cirrhotique ? 2) Quelles sont les causes de l’IRA ? 3) Quel est l’impact pronostique de cette IRA ? D’autres questions, comme celles des explorations nécessaires en présence d’une IRA et de la prise en charge spécifique de l’IRA, seront abordées dans une mini-revue ultérieure. La connaissance de la physiopathologie de l’IRA survenant au cours de la cirrhose permet de mieux appréhender la plupart de ces interrogations.
Physiopathologie de l’insuffisance rénale aiguë
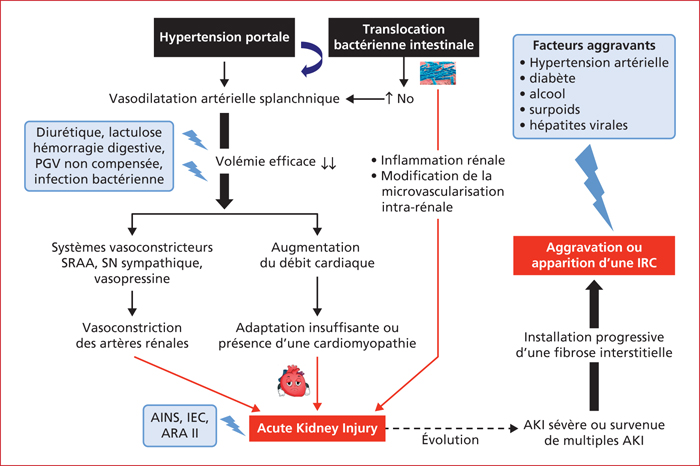
Au cours de la cirrhose, l’IRA résulte le plus souvent d’un effondrement de la perfusion rénale lié aux effets conjoints d’une intense vasoconstriction des artères rénales et d’une diminution du débit sanguin rénal consécutive à une vasodilatation artérielle des territoires splanchniques et systémiques. L’hypertension portale facilite la translocation bactérienne intestinale et induit une production excessive de cytokines pro-inflammatoires (comme le TNFα) et de substances vasodilatatrices (comme le monoxyde d’azote, NO). La vasodilatation artérielle qui s’ensuit est responsable d’une hypovolémie efficace conduisant à l’activation de systèmes vasoconstricteurs (système rénine-angiotensine-aldostérone (SRAA), système nerveux sympathique et production accrue de vasopressine, aussi appelée « hormone anti-diurétique ») ayant pour objectif la restauration de la volémie. Ces systèmes vasoconstricteurs, salutaires pour restaurer une volémie efficace, peuvent devenir délétères lorsque leur activation est excessive et prolongée car ils participent à la baisse du DFG. Les mécanismes de régulation intra-rénale (production de substances vasodilatatrices, comme les prostaglandines et prostacyclines) sont dépassés par un excès de production locale de substances vasoconstrictrices (comme l’endothéline et le thromboxane) [3]. Initialement, la baisse du débit plasmatique rénal (le DPR est habituellement de 600 mL/min) est compensée par une augmentation de la fraction filtrée (chez un sujet normal, 20 % du plasma délivré aux glomérules est filtré) pour maintenir un DFG normal, selon l’équation DFG = [fraction filtrée] × [DPR]. Le maintien d’un DFG normal est rendu possible par l’effet vasoconstricteur de l’angiotensine II sur l’artère efférente rénale et l’effet vasodilatateur des prostaglandines sur l’artère afférente rénale ; ces mécanismes compensateurs sont toutefois dépassés lorsque la baisse du DPR devient trop importante. Tout évènement à l’origine d’une baisse de la volémie (hémorragie, excès de diurétiques, diarrhée par exemple) est susceptible d’induire une IRA. De même, les médicaments susceptibles de bloquer les mécanismes de régulation du tonus vasculaire intrarénal (inhibiteurs de l’enzyme de conversion de l’angiotensine, antagonistes des récepteurs de l’angiotensine II, anti-inflammatoires non stéroïdiens) exposent au risque d’IRA et doivent être proscrits, en particulier au stade de cirrhose décompensée. L’insuffisance rénale aiguë résulte souvent d’un effondrement de la perfusion rénale lié à une vasoconstriction des artères rénales et d’une diminution du débit sanguin rénal consécutive à une vasodilatation artérielle des territoires splanchniques et systémiques
L’activation du SRAA et du système nerveux sympathique est responsable de la rétention de sel (contribuant à l’accumulation d’ascite et aux œdèmes) et de l’hypercinésie circulatoire caractérisée par des résistances vasculaires basses et un débit cardiaque augmenté [4] ; la vasopressine induit une rétention d’eau libre, à l’origine d’une hyponatrémie dite de « dilution » ou « hypervolémique ». L’hypercinésie circulatoire correspond à un mécanisme adaptatif permettant le maintien de la perfusion périphérique des différents organes. La survenue d’une IRA chez des patients ayant un débit cardiaque plus bas que ne le nécessiterait la vasoplégie périphérique suggère l’existence d’une dysfonction cardiaque [5, 6] ; la dysfonction diastolique est présente chez au moins 50 % des patients cirrhotiques et constitue un facteur d’aggravation de la fonction rénale [7]. Toutefois, l’atteinte cardiaque n’étant pas constante, il pourrait s’agir d’une atteinte cardiaque fonctionnelle, la capacité cardiaque maximale d’adaptation aux modifications hémodynamiques périphériques restant inconnue.
La théorie de la vasodilatation ne peut expliquer, à elle seule, la survenue d’une IRA au cours de la cirrhose, tout comme en l’absence de cirrhose. En l’absence de maladie du foie, de nombreux arguments suggèrent en effet que l’IRA n’est pas toujours associée à une diminution du flux sanguin rénal et que l’inflammation systémique joue un rôle important [8]. Les mécanismes impliqués associent des modifications de la microvascularisation intrarénale, altérant les fonctions tubulaire et glomérulaire et entrainant une ischémie de la jonction cortico-médullaire par le biais d’une redistribution du flux sanguin rénal [8].
L’infection bactérienne est un facteur déclenchant très fréquent d’IRA ; cependant, même en l’absence d’une infection bactérienne documentée, la présence d’un Syndrome de Réponse Inflammatoire Systémique est un facteur impliqué dans la survenue d’une IRA [9]. L’inflammation est liée à la translocation, à partir du tube digestif, de bactéries et/ou de produits de dégradation bactérienne qui se lient à des récepteurs spécifiques au sein de différents organes et entraînent des manifestations cliniques variables. Dans un modèle de cirrhose expérimental murin, l’inflammation induite par du lipopolysaccharide augmente l’expression du Toll-Like Receptor 4 (TLR4) sur les cellules du tubule proximal et entraîne des lésions de ces cellules [10]. Chez le patient atteint de cirrhose et d’IRA, l’augmentation de l’expression tubulaire de TLR4 et la présence de lésions tubulaires ont été également décrites, y compris dans le syndrome hépatorénal (SHR) [11] ; cette dernière observation suggère que le SHR n’est pas une entité purement fonctionnelle et peut s’associer à des lésions parenchymateuses rénales [12]. Toutefois, le SHR demeure une IRA (ou insuffisance rénale aiguë) essentiellement fonctionnelle liée à une diminution extrême du flux sanguin rénal et du débit de filtration glomérulaire, secondaire à l’hypovolémie artérielle efficace et non compensée efficacement par l’augmentation du débit cardiaque [4, 6, 13] ; le caractère fonctionnel du SHR est conforté par les constatations suivantes : 1) le SHR est le plus souvent réversible après une transplantation hépatique (TH), et 2) des reins de patients cirrhotiques ayant un SHR ont déjà été transplantés chez des patients ayant une insuffisance rénale terminale avec une excellente récupération de la fonction rénale [14]. La figure 1 résume les principaux mécanismes physiopathologiques impliqués dans l’IRA du patient cirrhotique. L’infection bactérienne est un facteur déclenchant très fréquent d’insuffisance rénale aiguë Le syndrome hépato-rénal n’est pas une entité purement fonctionnelle et peut s’associer à des lésions parenchymateuses rénales
Diagnostic de l’insuffisance rénale aiguë chez le patient cirrhotique
Les critères traditionnels de l’IRA proposés en 1996 [15] puis en 2007 [16] ont été redéfinis récemment [17]. La définition de l’IRA doit prendre en compte désormais la cinétique de la créatininémie, et non sa valeur absolue. En effet, la créatininémie est un mauvais marqueur de la fonction rénale. Elle varie selon l’âge, le sexe, le poids et l’ethnie. Chez le patient cirrhotique, la créatininémie est souvent basse pour les raisons suivantes [18] : (a) une production diminuée de la créatinine en rapport avec une sarcopénie, d’autant plus fréquente que la cirrhose est sévère, (b) une diminution de la synthèse hépatique de créatine du fait de l’insuffisance hépatique, (c) une augmentation du volume de distribution liée à la rétention hydrosodée qui dilue la créatinine, et (d) une interférence de l’hyperbilirubinémie dans le dosage de la créatininémie par la méthode colorimétrique (les méthodes enzymatiques actuelles n’ont pas cet inconvénient). Malgré toutes ces limites, la créatininémie reste un élément essentiel du score MELD (Model for End-Stage Liver Disease), outil robuste de prédiction de la mortalité précoce chez les patients atteints de cirrhose, utilisé dans la majorité des pays occidentaux pour prioriser l’attribution des greffons aux receveurs les plus gravement atteints. L’importance de l’insuffisance rénale, mesurée par la créatininémie, a aussi été montrée dans l’étude CANONIC [19] ; en effet, une insuffisance rénale avec une créatininémie ≥ 165 μmol/L permettait de définir, en l’absence de toute autre défaillance d’organe, le premier grade ACLF (Acute-on-Chronic Liver Failure ; cette entité est définie par une décompensation aigu� de la cirrhose associée à une ou plusieurs défaillances d’organes, une inflammation systémique intense et une importante mortalité à court terme) [19]. La définition de l’insuffisance rénale aiguë doit prendre en compte désormais la cinétique de la créatininémie, et non sa valeur absolue
Proposé en 2015 par les experts du Club International de l’Ascite, le diagnostic et l’évaluation de la sévérité de l’IRA, classée en trois stades de gravité croissante, repose désormais sur une nouvelle classification (tableau 1)[1, 17]. En l’absence de valeur basale de créatininémie à l’admission d’un patient, la valeur basale est celle observée dans les trois mois précédant cette admission. En l’absence totale de valeur basale, le diagnostic formel d’IRA ne peut être fait ; cependant, la présence d’une créatininémie d’emblée élevée (i.e., > 133 μmol/L) et associée à un facteur précipitant identifié permet de porter un diagnostic d’IRA avec une bonne fiabilité [1]. Notons que les critères utilisant la diurèse ont été supprimés de cette définition car ils étaient sujet à des variations importantes du fait de la rétention sodée inhérente à la cirrhose décompensée et à l’utilisation fréquente des diurétiques dans cette population. Cependant, l’aggravation d’une oligurie ou le développement d’une anurie doivent être considérés comme une IRA chez des patients hospitalisés en unités de soins intensifs, indépendamment de la valeur de la créatininémie [20, 21]. Le diagnostic et l’évaluation de la sévérité de l’insuffisance rénale aiguë, classée en trois stades de gravité croissante, repose désormais sur une nouvelle classification
Causes des insuffisances rénales aiguës et facteurs précipitants
Causes
Classiquement, l’IRA peut être de trois types : 1) « pré-rénale » ou fonctionnelle, liée à une hypoperfusion sans lésion glomérulaire ou tubulaire, 2) « intrinsèque » ou organique, liée à une nécrose tubulaire aiguë (ischémique ou toxique), une glomérulonéphrite ou une néphrite interstitielle, et 3) « post-rénale » par obstacle sur les voies urinaires [22]. Environ un tiers des IRA sont associées à une maladie intrinsèque rénale (surtout par nécrose tubulaire aiguë) ; les insuffisances rénales par obstacle urinaire sont plus rares (1 % des cas) ; l’origine pré-rénale (liée par exemple à une hypovolémie ou un sepsis) demeure la plus fréquente (68 % des cas) avec une amélioration de la fonction rénale dans deux tiers des cas par le simple remplissage vasculaire [22] ; le tiers restant, qui ne répond pas au remplissage vasculaire, définit le SHR.
La frontière entre cause fonctionnelle ou organique n’est pas toujours évidente car il existe un continuum physiopathologique débutant le plus souvent par une IRA fonctionnelle pouvant devenir organique (il s’agit alors le plus souvent d’une nécrose tubulaire aiguë) à la faveur d’un autre facteur précipitant ou lorsque l’hypovolémie se prolonge et devient plus marquée. Enfin, le SHR est, en théorie, complètement réversible après la TH, par restauration d’un état circulatoire physiologique, bien que de nombreux patients gardent une IRC après la TH. La frontière entre cause fonctionnelle ou organique n’est pas toujours évidente car il existe un continuum physiopathologique
Le SHR est une entité spécifique de la cirrhose. Jusqu’à récemment, il était considéré comme une atteinte rénale fonctionnelle, sans lésion histologique, ne répondant pas au remplissage vasculaire. Historiquement, on distinguait deux entités ayant un pronostic bien distinct : le SHR de type 1 (SHR-1) et de type 2 (SHR-2) [15]. Le SHR-1, considéré comme une IRA, était caractérisé par une élévation en moins de 15 jours de la créatininémie jusqu’à un taux dépassant 221 μmol/L (25 mg/L) et était associé à une survie médiane d’un mois, en l’absence de traitement. Les études ayant évalué le traitement par terlipressine et albumine, traitement de référence du SHR-1, ont montré que la valeur élevée de la créatininémie en début de traitement était un facteur prédisant la faible probabilité de réponse thérapeutique ; cela suggère que le seuil de 221 μmol/L pour débuter le traitement du SHR-1 est bien trop élevé. Le SHR de type 2 est considéré comme une IRC et est souvent associé à une ascite réfractaire. Son pronostic est meilleur que celui du SHR-1, avec une survie médiane de 6 à 7 mois. Dans la nouvelle classification de l’IRA, le terme SHR-1 a été abandonné et le SHR fait partie intégrante des IRA (il porte alors l’acronyme anglophone « HRS-AKI » pour « hepatorenal syndrome-AKI »). Les nouveaux critères définissant le SHR (tableau 2) ont fait disparaitre la notion de seuil de créatininémie, permettant ainsi d’identifier et de traiter plus précocement ces patients [17].
Facteurs précipitants
Les facteurs précipitants de l’IRA sont essentiellement représentés par les infections bactériennes (surtout l’infection spontanée du liquide d’ascite), les hémorragies digestives et les ponctions d’ascite de grand volume (i.e., > 4-5 litres) en l’absence de compensation par l’administration d’albumine. Une diurèse excessive induite par les diurétiques ou une diarrhée associée à la prise de lactulose peuvent aussi être à l’origine de l’IRA [23].
L’insuffisance rénale aiguë peut également survenir spontanément sans facteurs précipitants mais cette situation reste rare puisqu’elle n’a été observée que chez 1,8 % des 1 115 patients cirrhotiques stables avec ascite et suivis en ambulatoire ; la population concernée était issue de trois essais thérapeutiques évaluant le satavaptan et avait une insuffisance hépatique peu sévère (MELD à 10-11), si bien que ce chiffre de prévalence est probablement sous-estimé [24].
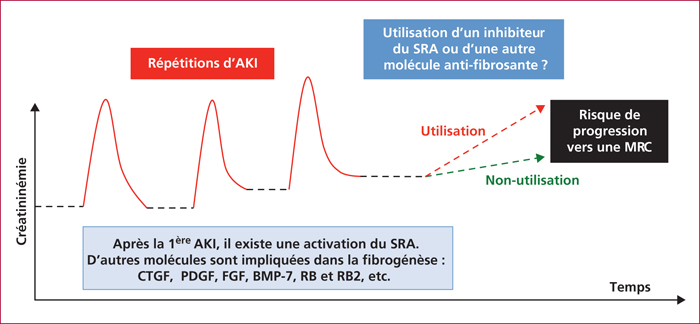
Il est important de noter que l’existence d’une maladie rénale chronique sous-jacente augmente le risque de survenue d’une IRA et, qu’à l’inverse, la répétition d’épisodes d’IRA et/ou la survenue d’IRA sévère augmente le risque de développer une maladie rénale chronique. La récupération ad integrum après une IRA n’est pas constante car une « mauvaise réparation » (« maladaptive repair » des Anglo-Saxons) de l’épithélium à partir des cellules survivantes peut favoriser l’apparition d’une fibrose interstitielle préjudiciable pour le devenir de la fonction rénale [25] ; cette « mauvaise réparation » favorise la transition entre l’insuffisance rénale aiguë et l’IRC qui s’associe aux modifications infra-histologiques suivantes : un arrêt du cycle des cellules tubulaires en phase G2/M avec une production de cytokines profibrogéniques, une transition épithélio- ou endothélio-mésenchymateuse (correspondant notamment à la transformation d’un péricyte, cellule constitutive de la paroi des vaisseaux, en myofibroblaste responsable de l’accumulation de matrice extracellulaire), des modifications épigénétiques des myofibroblastes et une raréfaction de la microvascularisation rénale. Bien que les mécanismes impliqués dans la transition insuffisance rénale aiguë-IRC ne soient que partiellement élucidés, l’activation du système rénine-angiotensine pendant ou après l’insuffisance rénale aiguë joue un rôle essentiel dans la progression vers l’IRC [26]. L’angiotensine II a un rôle majeur dans la progression de la fibrose tubulo-interstitielle rénale ; en effet, ce peptide participe directement à l’inflammation et au chimiotactisme en stimulant l’expression des molécules d’adhésion et la synthèse de chimiokines, il exacerbe l’apparition des myofibroblastes et joue un rôle important dans l’accumulation de la matrice extracellulaire en stimulant la synthèse de collagène I et de fibronectine par les myofibroblastes [27]. Il n’existe pas actuellement de stratégie médicale pour limiter ce risque de transition entre insuffisance rénale aiguë et IRC chez le patient cirrhotique ; les seuls traitements efficaces qui peuvent limiter la production de fibrose rénale sont ceux qui inhibent soit la production d’angiotensine II (inhibiteurs de l’enzyme de conversion), soit l’action de l’angiotensine II sur son récepteur AT1R (i.e., les antagonistes du récepteur de type 1 à l’angiotensine II). Il serait toutefois très réducteur d’associer la progression de la fibrose rénale au seul effet de l’angiotensine II car les mécanismes impliqués dans le processus de fibrogenèse rénale sont multiples, rendant la recherche médicamenteuse très délicate. La figure 2 illustre l’évolution d’un patient cirrhotique avec plusieurs épisodes d’insuffisance rénale aiguë ; l’introduction d’un traitement ralentissant l’évolution vers une IRC est un concept intéressant (déjà proposé par Chou et al. en dehors du cadre de la cirrhose [26]) qui pourrait faire l’objet d’études complémentaires dans le cadre spécifique de la cirrhose. La récupération ad integrum après une insuffisance rénale aiguë n’est pas constante
Pronostic des insuffisances rénales aiguës
Plusieurs études ont montré que cette nouvelle classification de l’IRA (tableau 1) améliore l’évaluation pronostique [28-30] : les patients ayant une IRA de stade 1, 2 et 3 ont une survie à 3 mois respectivement de > 70 %, 42 % et 31 % [29]. Cependant, les patients de stade 1 constituent un groupe hétérogène avec une survie plus faible pour les patients stade 1B (créatininémie maximale ≥ 133 μM) par rapport aux patients stade 1A (créatininémie maximale < 133 μM) [28] ; cette hétérogénéité du stade 1 a été confirmée dans une étude prospective incluant 547 patients hospitalisés pour une décompensation aiguë de la cirrhose : les patients stade 1B avaient une survie à 3 mois sans transplantation diminuée par rapport à ceux du stade 1A (84 % vs. 58 % ; p = 0,001), alors qu’il n’était pas observé de différence significative de survie entre les patients stade 1A et ceux sans IRA (84 % vs. 89 %) [30]. Compte tenu du risque plus important de progression de l’IRA et de survenue d’une défaillance d’organe, une attention particulière doit être portée à ce sous-groupe de patients stade 1B nécessitant une prise en charge identique à celle proposée pour les stades 2 ou 3 [17].
Il a été observé que le pronostic des patients cirrhotiques ayant une IRA est associé à la cause de l’IRA, même si une histologie rénale est absente le plus souvent. Ainsi, la survie à 3 mois de 562 patients cirrhotiques avec une IRA était respectivement de 73 %, 46 %, 31 % et 15 % en cas d’atteinte du parenchyme rénal, d’hypovolémie, d’infection (surtout pulmonaire) et de SHR [31]. La connaissance de la cause de l’IRA permet non seulement d’apprécier le pronostic mais surtout de guider la stratégie thérapeutique. L’apport de vasoconstricteurs et d’une expansion volémique est le traitement du SHR tandis que l’expansion volémique peut suffire en cas d’hypovolémie. La méconnaissance d’une nécrose tubulaire aiguë comporte un risque de surcharge volémique en cas de perfusion trop généreuse [32] ; les patients ayant une nécrose tubulaire aiguë associée à des critères de sévérité peuvent être dialysés et doivent être distingués des patients avec un SHR quand doit se discuter une greffe combinée foie/rein ou une greffe de foie isolée. Le détail de la prise en charge spécialisée de l’IRA sera abordé dans une revue ultérieure.
Conclusion
La compréhension des mécanismes physiopathologiques et la meilleure connaissance de l’évolution de l’IRA au cours de la cirrhose ont permis l’élaboration d’un nouvel algorithme permettant l’identification plus rapide et surtout une prise en charge optimale de l’IRA. Durant ces dernières années de nombreux biomarqueurs ont été décrits pour diagnostiquer l’insuffisance rénale aiguë et son origine, et pour estimer le risque évolutif de l’insuffisance rénale aiguë [33] ; la plupart de ces biomarqueurs (comme la lipocaline associée à la gélatinase des polynucléaires neutrophiles) ont l’inconvénient de faire référence à un processus unique d’atteinte tubulaire alors que l’aggravation de la fonction rénale dépend de processus complexes et hétérogènes. Une approche plus générale (comme la protéomique ou la métabolomique) pourrait révéler de nouveaux biomarqueurs diagnostiques ou pronostiques de l’insuffisance rénale aiguë [34]. En attendant mieux, continuons à surveiller de près, chez nos patients cirrhotiques, l’évolution de la créatininémie.
Liens d’intérêts
les auteurs déclarent n’avoir aucun lien d’intérêt en rapport avec l’article.Take home messages
![]() This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License
This work is licensed under a
Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License